Bcl-2过度表达对全脑缺血再灌注后大鼠海马回P53蛋白表达的影响
李 伟,吴 刚,薛荣亮
(西安交通大学医学院第二附属医院麻醉科,陕西 西安 710004)
在脑缺血再灌注损伤中,程序性细胞死亡即凋亡是脑缺血再灌注损伤神经元死亡的主要方式,对其机制的研究是目前的热点。研究[1]表明:细胞凋亡受多种基因调控,Bcl-2与p53被认为是最重要的调控基因。p53可调节多种基因的转录,参与DNA复制与损伤修复,诱导凋亡。所以,p53及其相关基因的表达已成为目前脑缺血再灌注损伤神经元死亡的关键环节。Bcl-2是凋亡重要调控基因,目前认为,Bcl-2可抑制细胞凋亡,其家族基因在调节线粒体通透性中发挥重要作用。在脑缺血再灌注损伤中Bcl-2对p53表达有无影响尚未见相关研究报道。因此,本研究利用过度表达Bcl-2的大鼠,研究其脑缺血再灌注后P53蛋白的表达,探讨Bcl-2的抗凋亡作用及可能机制。
1 材料与方法
1.1 主要试剂4%多聚甲醛、磷酸盐缓冲液(PBS)及Poly-Lysene多聚赖氨酸(北京中山生物制品公司),P53检测试剂盒(美国Santa Gruz Biotechnology公司),原位未端标记细胞凋亡试剂盒(美国 Oncogene试剂公司),Bcl-2检测试剂盒(北京中山生物制品公司)。
1.2 动物模型的制备及分组雄性健康SD大鼠90只,由西安交通大学医学院动物中心提供,体质量为(300±20) g。随机分为3组(n=30):假手术组(SO组)、缺血再灌注组(IR组)和Bcl-2过度表达组(Bcl-2组)。
Bcl-2组模型利用西北农林科技大学生命科学院生物技术室hbcl-2 cDNA克隆载体,设计引物序列为: 5′-CTCGAGTATGGCGCAAGCCGGGAG,3′-GCGGCCGCTCACTTGTGGCCCAGG-TATGCACC,进行PCR扩增。PCR产物纯化后,与pLNCX2进行双酶切,并用T4DNA连接酶定向连接,构建逆转录病毒载体pLN-Bcl。脂质体Lipofectamine 2000转染法将该载体导入包装细胞PT-67,筛选阳性细胞克隆,进一步培养,收集和浓缩病毒液,最后测定病毒滴度。SD大鼠麻醉固定,参照大鼠立体定位图谱,在立体定位仪上用10 μL的Hamilton微量注射器向左右侧的海马回各注射病毒浓缩液5 μL[2]。
IR组及Bcl-2组全脑缺血再灌注动物模型采用4-血管法建立,全脑缺血6 min后再灌注。SO组大鼠只暴露血管而不夹闭,其余操作与另两组相同。麻醉方法采用2%戊巴比妥钠40 mg·kg-1行腹腔内注射。分别于再灌注后6、12、24、48、72及96 h处死,用4%多聚甲醛200 mL灌注,切取脑组织标本,分别在4%多聚甲醛、酒精、二甲苯及石蜡中浸泡后,对标本行石蜡包埋。
1.3 P53免疫组织化学染色P53蛋白多克隆抗体及生物素标记羊抗原IgG抗体由Santa Cruz公司提供,对标本行免疫组织化学SP法染色,切片脱蜡后加P53多克隆抗体(兔IgG,滴度均为1∶50)染色。阳性标准为细胞核或者细胞浆染色呈棕黄色或淡黄色,测定灰度值。
1.4 细胞光镜观察术后6、12、24、48、72及96 h处死大鼠,4%多聚甲醛灌注固定后HE染色,光镜下观察海马组织学变化。
1.5 原位末端标记法参考李伟等[3]所用方法。石蜡切片经蛋白酶消化后,在末端脱氧核糖核酸转移酶(TDT)作用下将生物素标记的核苷酸原位掺入DNA缺口,再与辣根过氧化酶标记的抗生物素蛋白抗体结合,显色。
1.6 灰度值测定结果判断P53阳性标准为切片中显示细胞浆或细胞核有明显的黄色、棕褐色颗粒或斑片状。对P53阳性结果进行半定量测定,所用仪器为德国Leica-Q550E彩色图文分析计算机系统。
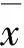
2 结 果
2.1 脑缺血再灌注后P53蛋白在CA1及CA3区的表达及灰度变化全脑缺血再灌注24 h后,IR组CA1区P53蛋白开始微弱表达,随后逐渐升高,于72 h达高峰,而后下降,主要位于胞核。CA3区于再灌注后48 h出现P53蛋白的表达,逐渐增加,于72 h达高峰后下降;但表达强度较CA1区弱,主要位于胞核。见表1。Bcl-2组P53蛋白CA1及CA3区表达强度弱于IR组,但其表达主要位于胞浆。见图1(封二)。
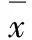
表1 P53蛋白在海马回CA1区和CA3区表达的变化
2.2 HE染色结果SO组中,海马神经细胞排列有序,光镜下细胞核透明清晰、可见1 ~ 2个明显的核仁。全脑缺血再灌注6 h后,IR组HE染色改变不明显;再灌注24 h后,CA1区神经细胞开始出现严重损伤性改变;再灌72 h后,神经细胞损伤最严重,光镜下细胞数目降低,核膜不清晰,未见核仁。与CA1区比较,IR组CA3区神经细胞损伤较轻,Bcl-2组神经细胞损伤较IR组轻微。见图2(封二)。
2.3 原位末端标记法结果IR组全脑缺血再灌注24~48 h后海马CA1区凋亡细胞数最多;至再灌注72 h后,海马CA1区凋亡细胞数开始减少,见表2。与CA1区比较,IR组CA3区24 ~ 96 h凋亡细胞数较少,见表2。与IR组比较,Bcl-2组凋亡细胞数少,见表2及图3(封二)。
3 讨 论
脑缺血再灌注后在神经细胞凋亡区域蛋白表达总体上显著受到抑制,但却有多种蛋白质和转录因子特异性和延迟性表达,P53即是其中较重要的一种。目前已证实,P53可介异细胞凋亡。Bcl-2家族是目前最受重视的凋亡相关基因家族。Bcl-2家族既能阻抑坏死又能阻抑凋亡[4]。Bcl-2过度表达对脑缺血再灌注损伤有保护作用,但其对P53的影响未见报道。
p53基因是与脑缺血再灌注后细胞凋亡关系较为密切的凋亡调控基因之一[5]。本研究利用4-血管法制作大鼠全脑缺血再灌注模型后发现:P53蛋白在缺血再灌注后24 h表达,72 h达到高峰,其表达时间与细胞凋亡时序相吻合,提示p53基因参与神经细胞凋亡的过程。海马神经元对缺血十分敏感,常取海马区测定P53蛋白[6]。本研究结果显示:P53蛋白表达主要集中在CA1区,即神经元严重受损部位,CA3区虽有表达,但程度较CA1区弱,说明P53蛋白表达与凋亡分布在相同区域。本研究证实了P53参与全脑缺血再灌注后海马神经元的凋亡。脑缺血再灌注可干扰脑的氧供和能量代谢,产生大量氧自由基,氧自由基可对DNA造成损伤。DNA受损时缺血缺氧等刺激可引起细胞内的蛋白激酶PKC和JNK磷酸化而激活p53,使p53在丝氨酸位点磷酸化。p53 mRNA和蛋白在细胞内积累,并且免疫活性增强,可直接引起凋亡,也可以通过调节其他相关基因引起凋亡,其作用机制可能是通过影响Bcl/Bax的平衡来调控凋亡。P53蛋白表达后,经过Bcl-2家族成员的调节,使Cyt-c从线粒体转移至胞质,Cyt-c与凋亡蛋白激活因子(Apaf-l)和前caspase-9形成复合物,激活caspase-9,引起caspase家族级联反应,最终导致凋亡。
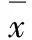
表2 各组大鼠海马回CA1 区和CA3区凋亡细胞数的变化
Bcl-2基因家族是一种重要的内源性抗凋亡因子,对维持脑缺血再灌注后某些神经细胞的生存有重要作用[7]。本研究通过向大鼠海马内注入Bcl-2病毒载体,制成Bcl-2过度表达模型,结果发现:脑缺血再灌注后,CA1区神经元细胞凋亡明显减少,说明Bcl-2的过度表达对神经细胞凋亡有抑制作用,与Linnk[8]的研究结果相符。Bcl-2主要位于线粒体,是一种可以对抗细胞凋亡发生的凋亡调控癌基因,主要分布在线粒体外膜、内质网和核周膜,可以调节膜的通透性,其拮抗细胞凋亡的作用与Bax促凋亡作用相对。Bcl-2可抑制内质网释放Ca2+,抑制caspase-3的激活。研究[9]表明:线粒体膜通透性的增加与促凋亡的Bcl-2家族成员表达下调或抗凋亡的家族成员表达上调有关,Bcl-2水平的增高可抑制细胞凋亡。
本研究发现:Bcl-2组中P53的表达在CA1及CA3区都减弱,提示Bcl-2过度表达对P53的表达产生抑制。Bcl-2抗凋亡可能是通过抑制Bax等促凋亡基因的发挥。Bax是调控凋亡的Bcl-2家族的前凋亡成员,Bax已被确认为p53直接的早期应答基因。推测过度表达Bcl-2可抑制Bax的表达,从而抑制P53表达。本研究中还发现:P53的表达主要位于胞浆,胞核较少。Bcl-2可改变P53 CDC2及CDK2细胞周期调节和核-胞质运转,Bcl-2与编码p53基因的共表达延缓p53诱导的凋亡,Bcl-2封闭p53进入核中,从而阻断P53诱导的调亡。这可能是在研究中Bcl-2组P53在海马表达主要位于胞浆而胞核较少的原因之一。总之,缺血再灌注可导致P53的表达,诱导神经细胞凋亡而引发脑损害,Bcl-2过度表达可减弱P53的表达,但是否通过其抑制凋亡有待进一步研究。
[参考文献]
[1]陆晓红,张亚娟, 王丽华,等.pHGF对脑缺血再灌注大鼠bcl-2、p53表达的影响[J].中风与神经疾病杂志,2009,26(1):11-13.
[2]薛荣亮,吴 刚,吕建瑞,等.β-肌动蛋白启动子指导下人bcl-2转基因小鼠模型的建立[J].第四军医大学学报,2004,25(18):1656-1658.
[3]李 伟,薛荣亮,张 瑛.脑缺血再灌注后神经细胞凋亡及c-Myc蛋白在海马回的表达[J].陕西医学杂志,2005,34(11):1330-1333.
[4]Chen F,Yan ZK,Yang B.Effects of electroacupuncture on cerebral Bcl-2 and caspase-3 expression after cerebral ischemia reperfusion in rats[J].针刺研究,2009,34(6):363-367.
[5]Hong LZ,Zhao XY,Zhang HL.p53-mediated neuronal cell death in ischemic brain injury[J].Neurosci Bull,2010,26(3):232-240.
[6]潘 登,谭 军,赵秀娟,等.葛根素对脑缺血-再灌注损伤细胞凋亡和p53表达的影响[J].中国热带医学,2007,7(7):1100-1101.
[7]Zhang H,Li Q,Li Z.The protection of Bcl-2 overexpressionon rat cortical neuronal injury caused by analogous ischemia/reperfusion in vitro[J].Neurosci Res,2008,62(2):140-146.
[8]Linnk MD.Expression of bcl-2 from a defective herpes simplex virus-1 vector limits neuronal death in focal cerebral ischemia [J].Stroke,1995,26(2): 1670-1675.
[9]刘广义.脑缺血后Caspase-3蛋白Bcl-2和Bax基因表达在神经损伤中的作用[J].中国康复,2010,25(3):163-165.

