先天性巨结肠患儿结肠肌间神经丛内神经节细胞中NKX2-1的表达
陈 琦,王 志,曹振杰,赵金磊,冯伟楼
郑州大学第三附属医院小儿外科 郑州 450052
先天性巨结肠(Hirschsprung’s disease,HD)是新生儿期低位肠梗阻的常见原因之一,其病因尚不十分明确。研究[1]表明在整个神经系统的发育中都存在NKX2-1的合成。近年来NKX2-1的研究主要集中在甲状腺、脑部以及肺部等有关神经系统发育疾病过程[2],在肠神经的研究较少。作者应用免疫组化SP法和RT-PCR技术检测NKX2-1在HD患儿结肠壁肌间神经丛内神经节细胞中的表达,进一步了解NKX2-1在HD发病中的作用机制。
1 材料与方法
1.1 标本来源 郑州大学第三附属医院普外科2010年9月至2011年4月临床确诊HD手术患儿30例,其中男21例,女9例。年龄3 d至5岁,中位年龄13个月。长段型4例,常见型19例,短段型7例。分别取患儿结肠的狭窄段、移行段和扩张段用于实验。同时取30例肠套叠手术患儿切除的正常结肠标本作为对照,其中男19例,女11例,年龄4个月至2岁,中位年龄14个月。
1.2 NKX2-1蛋白的检测
1.2.1 试剂及方法 采用免疫组化SP染色法检测。所有标本均经中性甲醛溶液固定,石蜡包埋、切片,2 μm厚连续切片。一抗为鼠抗人单克隆抗体(稀释200倍后使用),由北京博奥森生物技术有限公司提供,二抗和DAB显色剂购于北京中杉金桥生物技术服务有限公司,染色步骤严格按说明书进行。
1.2.2 结果判定 用Leica病理图像采集仪器采集图像,每例标本随机选取肠壁全层10个高倍视野,观察肌间神经丛和黏膜下神经丛的染色情况,以结肠神经节细胞胞质内出现特异性棕黄色颗粒为阳性。参照文献[3]的标准:未着色为阴性(-)、偶见着色为弱阳性(+)、中等着色为阳性(⧺)、着色丰富为强阳性(⧻)。
1.3 NKX2-1 mRNA的检测 采用RT-PCR法。试剂盒购于北京全式金生物技术有限公司,引物购于北京三博志远生物技术有限责任公司。NKX2-1引物序列:上游 5’-GCCGAATCATGTCGATGAGTC CA-3’,下游 5’-GTTGCCCAGGTTGCCGTTG-3’,扩增产物大小287 bp。内参GADPH引物序列:上游5’-AACGGATTTGGTCGTATTG-3’,下 游 5’-CAC AGTCTTCTGGGTGGC-3’,扩增产物大小 540 bp。RNA提取、逆转录、扩增的步骤均严格按照说明书进行。扩增条件为:95℃变性2 min,95℃预变性30 s,54℃退火30 s,72℃延伸1 min共35个循环,最后一个循环72℃延伸10 min。琼脂糖凝胶电泳观察结果。NKX2-1 mRNA的相对表达量用目的基因与内参条带灰度值的比值表示。
1.4 统计学处理 采用SPSS 17.0分析,HD患儿不同节段结肠组织和正常对照组结肠组织中NKX2-1蛋白表达的比较应用两独立样本的秩和检验,mRNA相对表达量的比较应用两独立样本的t检验或校正t检验。检验水准α=0.05。
2 结果
2.1 HD患儿和正常对照结肠组织肌间神经丛内神经节细胞中NKX2-1蛋白的表达 见图1、表1。

图1 HD患儿和正常对照结肠肌间神经丛内神经节细胞中NKX2-1蛋白的表达(SP,×400)
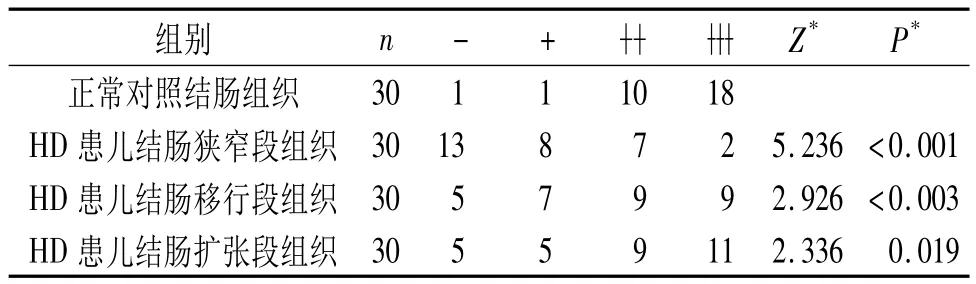
表1 HD患儿和正常对照结肠组织肌间神经丛内神经节细胞中NKX2-1蛋白表达比较
2.2 HD患儿和正常对照结肠组织肌间神经丛内神经节细胞中NKX2-1 mRNA的表达 见图2、表2。
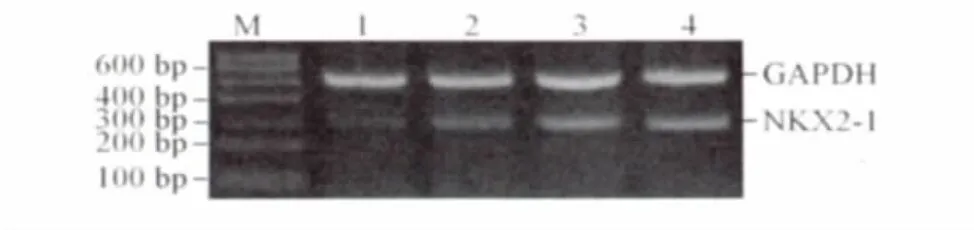
图2 HD患儿和正常结肠组织肌间神经丛内神经节细胞中NKX2-1 mRNA的表达
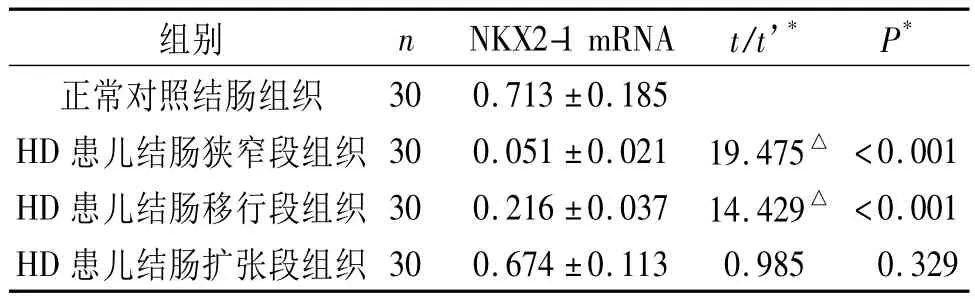
表2 HD患儿和正常对照结肠组织和正常结肠组织中NKX2-1 mRNA表达比较
3 讨论
HD是一种小儿常见的消化道发育畸形,主要机制是起源于内在神经系统的迷走神经嵴的不正常发育,最后导致肠神经节发育缺陷[4]。组织学可见病变段结肠肠管黏膜下层和肌间神经层内神经节细胞减少或缺如。Agoff等[2]发现,神经嵴细胞中NKX2-1基因表达控制着神经元的分化方向。该基因定位于染色体14q13,其编码的蛋白产物含有371个氨基酸残基,相对分子质量为38000,含有3个外显子和1个内含子,是一个含有螺旋-转角-螺旋结构的转录因子,其变异会导致神经节细胞的缺如,引起HD的发生。NKX2-1与肠神经元的发育有一定的联系[4-6]。基因缺失功能试验证实NKX2-1是通过影响中间神经元而实现向不同的方向分化,也可以在不同的程序中终止某一中间神经元的分化,导致中间神经节细胞发育终止。在结肠中NKX2-1主要分布在黏膜下层和肌间神经丛神经节细胞中[4]。
该研究结果表明NKX2-1在正常结肠肌间神经丛神经节细胞中有较高表达,但在HD患儿结肠壁的移行段、狭窄段较正常结肠组织的表达下降。NKX2-1的这种表达不一致的情况可能与肠神经系统的发育成熟有关。
综上所述,推测NKX2-1是保持正常神经系统发育成熟的重要因素可能与HD的发生有关。
[1]Carré A,Szinnai G,Castanet M,et al.Five new TTF1/NKX2.1 mutations in brain-lung-thyroid syndrome:rescue by PAX8 synergism in one case[J].Hum Mol Genet,2009,18(12):2266
[2]Agoff SN,Lamps LW,Philip AT,et al.Thyroid transcription factor-1 is expressed in extrapulmonary small cell carcinomas but not in other extrapulmonary neuroendocrine tumors[J].Mod Pathol,2000,13(3):238
[3]Burnstock G.Pathophysiology and therapeutic potential of purinergic signaling[J].Pharmacol Rev,2006,58(1):58
[4]Leon TY,Ngan ES,Poon HC,et al.Transcriptional regulation of RET by Nkx2-1,Phox2b,Sox10,and Pax3[J].J Pediatr Surg,2009,44(10):1904
[5]Hamvas A.Evaluation and management of inherited disorders of surfactant metabolism[J].Chin Med J,2010,123(20):2943
[6]Flandin P,Zhao Y,Voqt D,et al.Lhx6 and Lhx8 coordinately induce neuronal expression of shh that controls the generation of interneuron progenitors[J].Neuron,2011,70(5):939