陕北枣ISSR反应体系的建立及其优化
王延峰,史妮妮,李永鑫,叶 飞,贺晓龙,陈国梁
(1.延安大学生命科学学院,陕西 延安 716000;2.陕西省区域生物资源保育与利用工程技术研究中心,陕西 延安 716000)
中国是枣类遗传变异和起源较早的中心地区之一。枣也是陕北地区重要的经济植物之一,随着西部大开发以及退耕还林的实施,枣业经济得到迅猛发展,在陕北黄河沿岸诸县脱贫致富中发挥着越来越重要的作用。由于枣树的单胚性特点,在复杂的生态环境下,形成了极其丰富的遗传多样性,这也就导致了至今为止人们对于该种质资源的演化关系及其种间关系不甚清楚,给枣的优质种质资源的保护带来了不便。前人对枣品种的分类从形态学、细胞核型分析、同工酶生化标记等方面做了大量的研究[1],但都因其工作过程繁琐、费时,以及受敏感的生态环境和其有限的标记数量与因素的影响,使枣树的遗传多样性研究一直受到限制,这也就使得人们将研究的方向转到了分子生物学方面。近几年,相继出现了许多DNA 分子标记技术,如SSR(simple sequence repeats,简单重复序列)、简单序列重复区间扩增多态性(inter-simple sequence repeats,ISSR)、RFLP (restriction fragment length polymorphism,限制性内切酶片段长度多态性)、AFLP(amplified fragment length polymorphism 扩增片段长度多态性)、RAPD(random amplified polymorphic DNA,随机扩增多态性DNA)等[2-3]。其中ISSR(inter simple sequence repeat)标记是基于微卫星序列发展起来的一项技术[4],它是根据植物广泛存在简单重复序列的特点,并利用在植物基因组中常常出现的简单重复序列本身设计引物,无需预先克隆和测序。ISSR 标记通常为显性标记,呈孟德尔式遗传,具有很好的稳定性和多态性,已在果树遗传学如品种鉴定、亲缘关系分析、遗传多样性分析以及遗传图谱的构建等方面得到广泛应用[5-12]。为了更好地对陕北枣类种质资源收集保存、分类鉴定,笔者选用陕北地区的11 种枣树品种,对最适ISSR-PCR 反应体系的建立进行了研究,以期为利用ISSR 标记技术分析各品种间的亲缘关系奠定实验技术基础,为陕北枣品种的合理开发利用与选育提供理论依据。
1 材料与方法
1.1 材 料
以陕北地方品种枣树叶片为材料,供试品种有11 个,其中骏枣、脆枣、大团枣、枣梨枣、木枣、灰条枣、赞皇大枣、狗头枣、葫芦枣采自延川县,团圆枣采自清涧县,晋枣采自佳县。采样时均采取幼叶,用冰盒保存后立即带回实验室,洗净、晾干后于-70℃冰箱中保存备用。
所用引物参照刘兴菊等[7]筛选出的10 条引物,由北京奥科鼎盛生物科技有限公司合成。Taq DNA聚合酶及dNTP 购自天根生化科技(北京)有限公司。
1.2 方 法
1.2.1 基因组DNA 的提取 采用改良CTAB 方法进行枣叶片的基因组DNA 提取。获得的DNA 经0.8%琼脂糖凝胶电泳和紫外分光光度计检测合格后,将样品浓度调至50 ng/μL 保存备用。
1.2.2 ISSR 体系的优化 PCR 基本反应体系:1×PCR buffer,12.9 μL Easy PCR ystem,0.3 μmol/L 引物,1.5 U Taq DNA 聚合酶,DNA 模板50 ng。PCR反应的优化包括反应体系各成分的含量和退火温度的优化。以狗头枣的DNA 为模板,选用引物S46(序列为(CA)8G),其中引物浓度设0.1、0.2、0.3、0.4、0.5 μmol/L 5 个浓度梯度;酶用量设0.25、0.5、1.0、1.5、2.0 U 5 个梯度;退火温度设置在46~60℃范围内,梯度温度由美国THERMO 梯度PCR 仪自动生成,采取3 次重复。
1.2.3 11 个枣树品种间DNA 扩增 采用优化的ISSR 体系(25 μL):1×PCR buffer,12.9 μL Easy PCR ystem,0.4 μmol/L 引物S46,DNA 模板50 ng,1.5 U TaqDNA 聚合酶,以及优化后的PCR 程序:95℃预变性5 min;95℃变性50 s,54.8℃退火50 s,72℃延伸5 min,共35 个循环;72℃延伸10 min,4℃保存。在美国THERMO 梯度PCR 仪上进行扩增,然后取PCR 产物5 μL 进行点样,1.0%的琼脂糖(EB)凝胶电泳,在UVP 凝胶成像系统下成像保存。以Tiangenr MarkerⅢ产生的带为标准参照。
2 结果与分析
2.1 ISSR体系的优化
2.1.1 引物对PCR 扩增的影响 从图1 可以看出,在0.1、0.2、0.3、0.4、0.5 μmol/L 引物浓度下,都能扩增出目标条带。随着引物浓度的升高,扩增条带由弱到强,带型弥散程度逐渐减轻,非特异性扩增条带逐渐减少。引物浓度为0.1~0.3 μmol/L 时得到的PCR 产物主带弱,非特异性扩增条带较多。当引物浓度为0.4~0.5 μmol/L 时,PCR 反应稳定,条带清晰,非特异性扩增条带少。考虑节约试剂,试验合适的引物浓度为0.4 μmol/L。

图1 不同引物浓度扩增的ISSR 带型
2.1.2 Taq 酶浓度对PCR 扩增的影响 结果如图2 所示,25 μL 反应体系中Taq 酶用量为0.25 U 和0.5 U 时,带型较模糊甚至某些条带也会不出现;Taq 酶用量为1.0 U 时,条带亮度较大,但出现了较多非特异性条带或拖带现象;Taq 酶用量>1.0 U时,目标条带带型和强度较好。这说明在一定范围内,随着酶量的微量增加,目标条带亮度随之增加。因此,在保证试验结果准确性的前提下,考虑节省试剂,建议Taq 酶用量为1.5 U 。

图2 不同Taq 酶浓度扩增的ISSR 带型
2.1.3 退火温度对PCR 扩增的影响 以骏枣枣树幼叶为材料,退火温度设定为12 个梯度,分别是46.1、46.5、47.4、48.6、50.2、52.1、54.8、56.7、58.4、59.8、60.9、61.3℃。经过电泳检测发现随着退火温度的提高,条带逐渐清晰增多。为了使电泳图谱更加有对比度,从扩增的12 个梯度中选用了7 个梯度(61.3、60.9、58.4、56.7、54.8、52.1、48.6℃)进行电泳,结果如图3 所示,当退火温度<54.8℃时,条带弱少;当退火温度>54.8℃时,主条带减弱,非特异性条带增多,且拖带趋于严重。不同引物的退火温度有一定的差异,这与其碱基组成不同有直接的关系。有的引物在退火温度为43℃时,便能扩增出产物,而有的引物退火温度达到55℃。由此看来,引物不同其退火温度的上下限度有所不同,只有在一定温度范围内提高退火温度才可以增加扩增产物的特异性,但温度升高到一定值时,条带便减弱、减少。试验结果显示,退火温度为52.1、54.8、56.7℃时,扩增特异性表现较好,相比而言退火温度为54.8℃时,主带清晰而副带少且无弥散,因此,引物S46 最适合的退火温度为54.8℃。
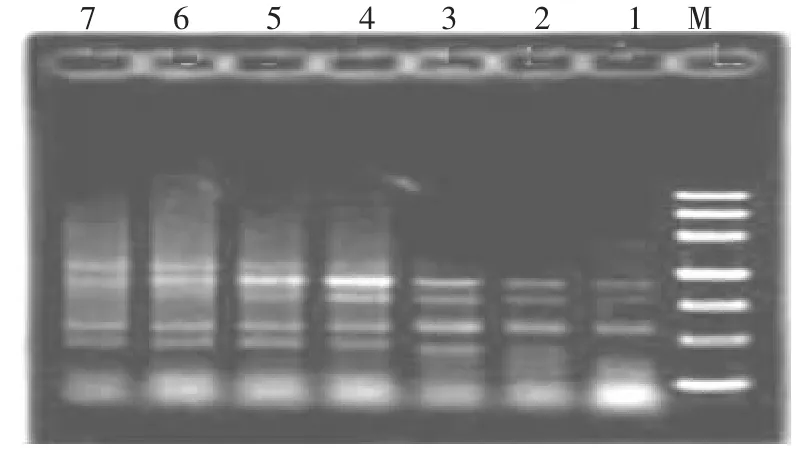
图3 不同退火温度下的ISSR 带型
2.2 枣树品种的扩增结果
利用优化后的ISSR 反应体系和程序筛选出的引物序列S46(退火温度为54.8℃)重现性好、多态性明显,对11 种枣树幼叶的模板DNA 进行扩增,扩增结果见图4。扩增电泳图谱表明,11 种不同品种的条带为4~7 条,主带有2~3 条,次带有2~4 条。依据主要条带可以把所研究的枣树品种分为3 类:骏枣、葫芦枣、灰条枣归为一类;脆枣、大团枣、团圆枣、梨枣,赞皇大枣归为一类;木枣、狗头枣、晋枣归为一类。目前市场上很畅销的狗头枣在约1 300 bp处有一特异性条带,可以和其他种类分开。

图4 11 种枣树品种特异引物扩增
3 讨 论
从ISSR 的扩增结果来看,基于PCR 的ISSR 分子标记技术受到多种因素的影响,尤其是TaqDNA聚合酶浓度、引物浓度及退火温度。Taq 酶浓度和质量对PCR 扩增结果相当重要[21]。Taq 酶浓度太低,会导致无扩增产物或产物量相当少;浓度过高不仅会造成经济上的浪费,而且还会出现非特异性条带,导致假阳性,甚至有时候还会出现一整条通带[13]。引物浓度对PCR 的带型产生也有明显的影响,过低或过高浓度的引物都不能产生很好的扩增效果,这是由于引物浓度过低不能产生或只有极少量的扩增产物,而引物浓度过高会增加引物二聚体的形成,引起模板与引物错配导致条带不清晰或产生新的特异性位点使反应特异性下降[14]。退火温度较高可以提高扩增的特异性,但过高也会使得酶的活性较早的消失,造成假阴性;过低会出现非特异性条带,造成假阳性。笔者优化的最适退火温度为54.8℃,这与刘兴菊等[7],齐靖等[15]的研究结果不同,这可能是由于试验所用的材料品种差异造成的。
通过筛选的S46 引物,在优化的反应条件下,不同的品种中都能产生清晰、稳定的特征带谱。狗头枣可以用特有条带把它与其他10 种枣区分开来。ISSR 通常为显性标记,呈孟德尔式遗传,从而表现出很好的多态性和稳定性,它具有可靠性高,技术难度低,多态性明显,试验可重复性好等优点,与RAPD、RFLP、AFLP、SSR 等分子标记方法相比,具有快捷、稳定、成本低、DNA 用量少和安全性较高等优势[3]。从研究中可以看出,同一样品、同一引物在相同的PCR 反应条件下,扩增结果完全一致,说明ISSR 技术的重复性和稳定性都很好。且琼脂糖电泳检测结果表明,ISSR 标记具有操作简单的特点,容易在短时间内获得大量的分子标记。因此,ISSR 技术已经受到了生物学者的高度重视,并在多种植物的遗传研究中得到了应用。伴随着ISSR标记技术的广泛应用,必将会极大地加快枣属植物分子标记领域的研究步伐,这将对枣种质资源收集保存、分类鉴定、品种选育和合理的开发利用具有重要的意义。
[1]孙世宗,冯宝春,陈学森.枣起源及生物技术育种研究进展[J].山东农业大学学报,2006,37(2):306-308.
[2]乔 勇,赵 锦,杨海旭,等.21 个枣品种(系)的AFLP 指纹分析[J].植物遗传资源学报,2009,10(2):205-210.
[3]蒋彩虹,王元英,孙玉合.SSR 和ISSR 标记技术应用进展[J].中国烟草科学,2007,28(2):1-5.
[4]Zietkicwicz E,Rafalski A,Lahuda D.Genomc fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[5]杨传平,潘 华,魏志刚,等.白桦ISSR 反应体系的优化[J].东北林业大学学报,2005,33(6):1-3.
[6]谢运海,夏德安,姜 静,等.利用正交设计优化水曲柳ISSRPCR 反应体系[J].分子植物育种,2005,3(3):445-450.
[7]刘兴菊,汤新彩,梁海永,等.枣树ISSR 反应体系的建立及优化[J].西北林学院学报,2007,22(5):62-65.
[8]卓书斌,黄小凤,袁志永,等.台湾青枣不同品种表型差异和遗传多样性研究[J].现代农业科学,2009,16(2):13-16.
[9]郭长奎,李 疆,陆 婷,等.新疆枣资源亲缘关系的ISSR 和RAPD 分析[J].经济林研究,2010,28(3):14-19.
[10]侯思宇,孙朝霞,申 洁,等.30 个枣树种质资源遗传多样性的ISSR 分析[J].植物生理学报,2011,47(3):275-280.
[11]张永辉,刘崇怀,樊秀彩,等.ISSR 标记在中国野生葡萄分类中的应用[J].果树学报,2011,28(3):406-412.
[12]Awasthi A K,Nagaraja GM,Naik GV,et al.Genetic diversity and relationships in mulberry (genus Morus)as revealed by RAPD and ISSR marker assays[J].BMC Genet,2004,5:1-9.
[13]席嘉宾,郑玉忠,杨中艺.地毯草ISSR 反应体系的建立与优化[J].中山大学学报(自然科学版),2004,43(3):80-84.
[14]徐 奭,张耀川,李树成,等.银杏ISSR-PCR 扩增反应体系的建立与优化[J].生物技术通讯,2012,23(1):80-85.
[15]齐 靖,董 祯,申连英,等.枣ISSR 扩增体系的建立[J].华北农学报,2008,23:209-212.

