5种微生态制剂对刺参幼参的生态安全性
刘铁钢,赵文,刘钢,梁毅,孟文
(大连海洋大学 水产与生命学院 辽宁省水生生物学重点实验室,辽宁 大连 116023)
近年来刺参养殖业已经成为中国北方海水养殖的重要产业。但随着养殖规模的扩大和养殖密度的提高,养殖水环境日益恶化,出现海参免疫力下降、生长缓慢、成活率低等一系列问题[1-3]。而在养殖过程中长期施用抗生素,不仅会导致动物机体的免疫力下降,而且还会因药物残留而危害食用者的健康[4-5]。微生态制剂是采用有益微生物经特殊工艺制成的活菌制剂[6-8],是一种绿色环保的纯生物制剂,可以起到净化水质,对受到污染的水体进行生态修复[9-12],提高养殖对象的免疫力和生长率的作用[13-15]。因其具有良好的功效,能够解决水产养殖生产上一系列的问题,所以被大量使用。但微生态制剂对水产养殖动物生态安全性目前尚未见报道。本研究中,作者以刺参幼参为试验对象,采用微生态制剂,对幼参进行耐受性、生长、免疫及水质调控试验,旨在了解各种微生态制剂对刺参的半致死浓度、安全浓度和对刺参生长免疫及对养殖水体水质的影响,为微生态制剂在刺参安全生产上的应用提供参考依据。
1 材料与方法
1.1 材料
刺参Apostichopusjaponicus购自大连庄河金砣水产食品有限公司,随机抽取培育池中的幼参,选择体态粗壮、伸展自然、疣刺尖挺、体褐色(混有少量青色)、摄食速度快、排便不黏而散的健壮幼参[16],体质量为2.0 g左右。试验饲料是由马尾藻、鼠尾藻和海泥等主要原料制成的粉末状饲料[13]。试验用海水取自大连市黑石礁海区,经沉淀和砂滤处理后再用200目筛绢网过滤。选取上市成品微生态制剂5种,来自不同的生产厂家(表1)。超氧化物歧化酶(SOD)、溶菌酶(LSZ)和过氧化物酶(POD)试剂盒均购自南京建成生物制品有限公司。
1.2 方法
1.2.1 微生态制剂对幼参的急性毒性试验 挑选暂养7 d后大小均匀的健康幼参,投放在装有60 L海水的PVC水箱中,每箱放幼参10头。试验期间,不投喂饲料,静水,不充气,每24 h全量换水,换水后,重新添加微生态制剂,使之达到试验原始浓度。海水盐度为33,pH为7.8~8.2,水温为(15±1)℃。试验期间,每隔3 h(夜间除外)观察一次刺参的活动情况,记录死亡个数,并及时拣出死亡个体,以免污染试验水质。幼参死亡的判定标准为:身体柔软、自然卷曲,管足及触手收缩回体内,疣刺收缩,无附着能力,无活动及摄食能力,对轻微刺激无反应[16-17]。通过预试验,将微生态制剂分别设4个浓度,每个浓度组设3个重复。试剂一的浓度为1、2、3、4 g/L,试剂二的浓度为0.25、0.50、1.00、1.50 mL/L,试剂三的浓度为0.5、1.0、2.0、3.0 mL/L,试剂四的浓度为150、225、300、375 mg/L,试剂五的浓度为1.5、3.0、4.5、6.0 g/L,对照组不添加微生态制剂。
各试验组取重复平行结果的均值计算死亡率,按下面的公式进行校正[15]:
P=(P′-C)/(1-C),
式中:P′为试验组幼参死亡百分数;C为对照组幼参死亡百分数;P为经校正后的试验组幼参死亡百分数。半致死浓度(LC50)是指全组染毒或给药后幼参半数死亡的浓度。以微生态制剂的浓度对数为横坐标、幼参死亡率的概率单位为纵坐标作曲线,并作线性回归检验,求其95%置信区间,确定48 h半致死浓度(LC50,48 h)和96 h半致死浓度(LC50,96 h)[18-19]。安全浓度(SC)是幼参能安全生活的最高浓度,一般用对应的半致死浓度计算可得,计算公式[20]为

SC=96 h LC50×0.3/(48 h LC50/96 h LC50)2。
1.2.2 微生态制剂对幼参生长及其免疫酶的影响试验 试验采用5种微生态制剂,分别设3个浓度,每个浓度组设3个重复,每组放20头幼参。试剂一的浓度为0.5、2.5、5.0 mg/L,试剂二的浓度为0.25、1.50、2.50 μL/L,试剂三的浓度为0.5、2.5、5.0 μL/L,试剂四的浓度为0.25、1.25、2.50 mg/L,试剂五的浓度为2、10、20 mg/L,对照组不添加微生态制剂。试验水体为60 L,海水盐度为33±1,pH为7.6~8.3,水温为(19±1) ℃。每日投饵率为幼参体质量的10%。充气,每3 d吸一次底,换水量为20%,换水后补加微生态制剂。30 d后结束试验,计算刺参的成活率、特定生长率,测量刺参体腔液中超氧化物歧化酶(SOD)、溶菌酶(LSZ)及过氧化物酶(POD)的活性。各种酶的测定严格按试剂盒说明操作进行。
特定生长率SGR=lnWt-lnW0t×100%,
其中:W0、Wt分别为试验初始和结束时刺参的体质量(g);t为试验天数(d)。
体腔液的采集方法:采用1 mL一次性注射器,从刺参腹面近口身体1/3处(体腔)抽取体腔液0.1~0.2 mL,注入灭菌离心管中。
1.2.3 微生态制剂对幼参养殖水体水质的影响试验 本试验中采用单因素随机区组设计。试剂一至试剂五的浓度分别为5 mg/L、2.5 μL/L、5 μL/L、2.5 mg/L和20 mg/L,对照组不添加微生态制剂。每组设3个重复。试验在60 L的PVC水箱中进行,每箱投放20头刺参,每日投饵量为幼参体质量的5%。海水盐度为33,pH为7.8~8.2,水温为(16±1 )℃。
1)在静水条件下每24 h监测1次。在静水、不换水、不充气条件下,每24 h分别测定一次溶氧(DO)、氨态氮(NH+4-N)、亚硝酸盐氮(NO-2-N)的含量,当水中DO含量低于4 mg/L时结束试验。试验开始时添加一次微生态制剂,使之达到设计浓度。
2)在充气条件下每隔5 d监测1次。在充氧、不换水条件下,每隔5 d分别测定一次水中的NH+4-N、NO-2-N含量,并再次按原始浓度添加微生态制剂。当水中的NH+4-N含量高于0.02 mg/L时结束试验。
采用碘量法测定DO,采用次溴酸钠氧化法测定氨态氮,采用磺胺盐酸奈乙二胺法测定亚硝酸盐氮[21-22]。
1.3 数据处理
应用SPSS 17.0软件对试验数据进行统计分析,用Duncan法进行多重比较,以0.05作为差异显著性水平。
2 结果
2.1 微生态制剂对幼参的毒性
观察发现:在不同种类和不同浓度的微生态制剂中,部分幼参身体出现应激状态,表现为身体收缩、活动能力下降、附着能力减弱,个别出现化皮,排脏现象较为严重;还有部分幼参死亡,死亡个体体色呈青色或黑青色,或者全身化皮、溃烂。试验期间,对照组幼参的成活率为100%。
从表2可见,随着5种微生态制剂浓度的增加,幼参死亡率均逐渐升高。其中试剂一浓度为4 g/L时,幼参48 h和96 h的死亡率分别为(53±4.7)%和(83±4.7)%;试剂二浓度为1.50 mL/L时,幼参48 h和96 h的死亡率分别为(57±4.7)%和90%;试剂三浓度为3.0 mL/L时,幼参48 h和96 h的死亡率分别为(47±4.7)%和(93±4.7)%;试剂四浓度为375 mg/L时,幼参48 h和96 h的死亡率分别为(53±4.7)%和(80±8.2)%;试剂五浓度为6.0 g/L时,幼参48 h和96 h的死亡率分别为(47±4.7)%和(83±4.7)%。
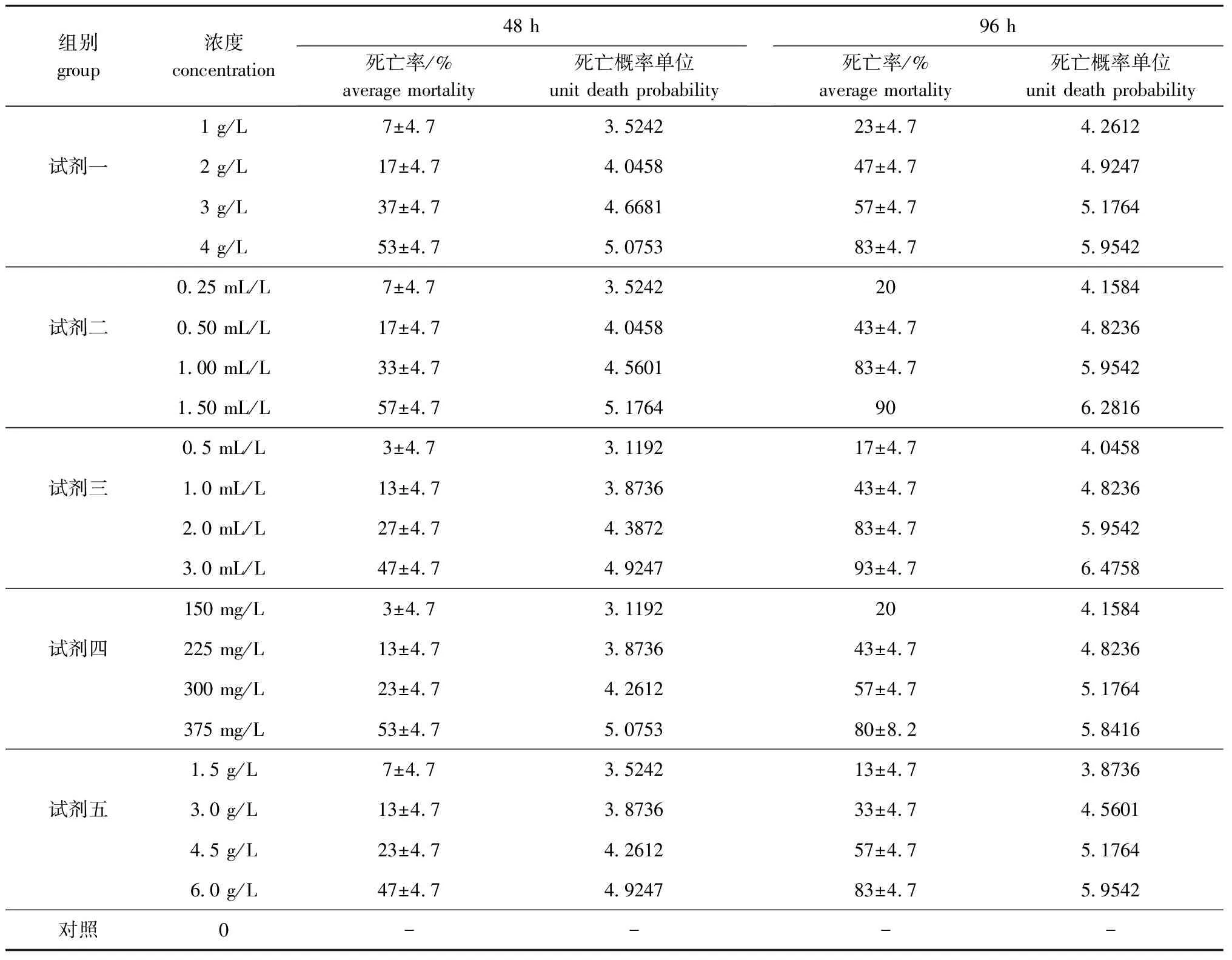
表2 微生态制剂对幼参的急性毒性作用
根据表2作线性回归分析,结果见表3。从表3可见,微生态试剂一对幼参的48 h、96 h LC50分别为4 074、2 041 mg/L,安全浓度为154 mg/L;试剂二对幼参的48 h、96 h LC50分别为1.41、0.51 mL/L,安全浓度为0.02 mL/L;试剂三对幼参的48 h、96 h LC50分别为3.4、1.0 mL/L,安全浓度为0.03 mL/L;试剂四对幼参的48 h、96 h LC50分别为389、246 mg/L,安全浓度为29.5 mg/L;试剂五对幼参的48 h、96 h LC50分别为6 920、3 548 mg/L,安全浓度为280 mg/L。5种微生态制剂对幼参的毒性顺序为试剂二>试剂三>试剂四>试剂一>试剂五,试剂五对幼参的毒性最小,试剂二对幼参的毒性远强于其它各组。
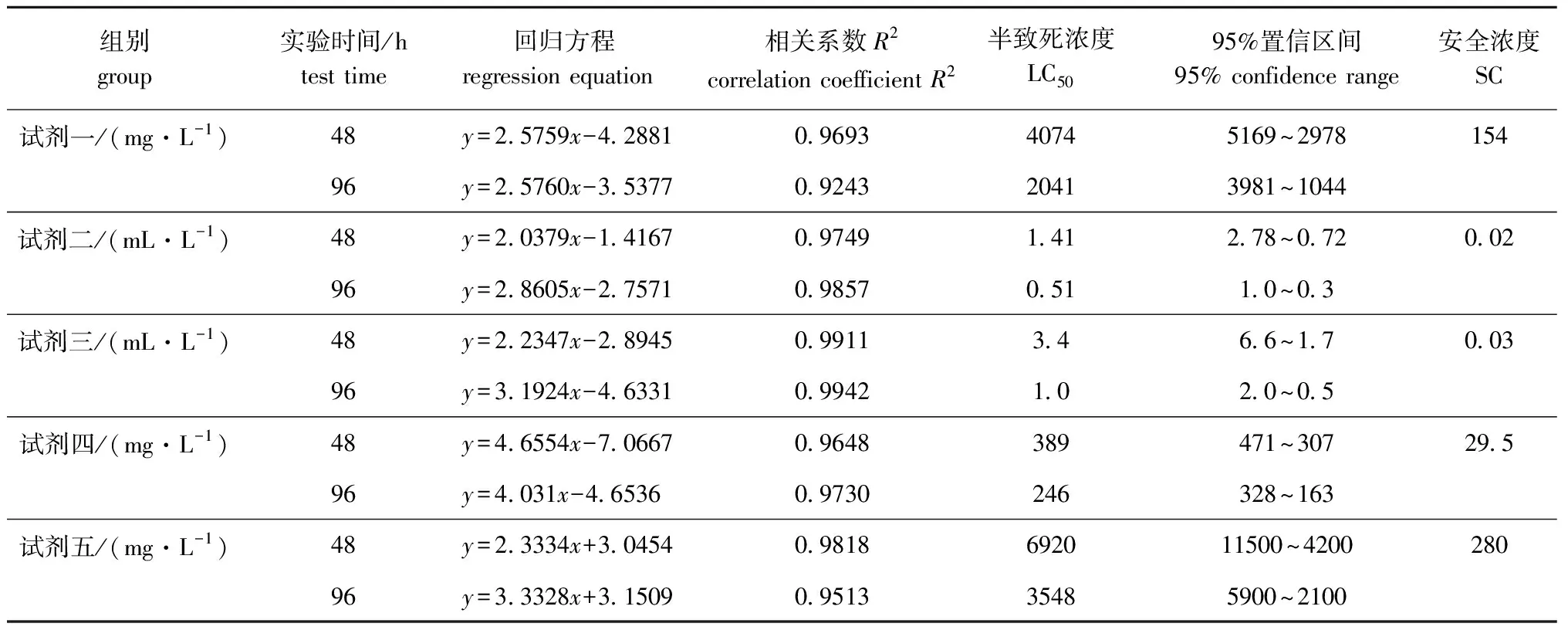
表3 5种微生态制剂对幼参急性毒性作用的分析
2.2 微生态制剂对幼参生长及其酶活性的影响
2.2.1 微生态制剂对幼参生长的影响 在试验进行30d后,各组成活率均为100%。5种微生态制剂对刺参幼参生长的影响以及各组特定生长率的相关性如表4所示。从表4可见,最大特定生长率出现在试剂一5mg/L处理组,为(1.58±0.07)%/d,最小值出现在对照组,为(1.26±0.05)%/d。就特定生长率而言,处理组均高于对照组;试剂一的中、高浓度组,试剂三的高浓度组,以及试剂四的中浓度组与对照组均存在显著差异(P<0.05);试剂一高浓度组与低浓度组间存在显著差异(P<0.05),其它处理组内高、中、低浓度组之间差异均不显著(P>0.05)。
2.2.2 微生态制剂对幼参酶活性的影响 从表4可见,添加微生态制剂组幼参的几种酶的活性除试剂一0.5mg/L和试剂三0.5μL/LPOD组外均显著高于对照组(P<0.05)。SOD、POD和LSZ酶活性最高值分别出现于试剂四的0.25mg/L组、试剂四0.25mg/L组和试剂三5μL/L组,其最高值分别为(78.89±0.3846)U/mL、(5.73±0.2400)U/mL、(6.79±0.0598)μg/mL。
试剂一各浓度组间的SOD、POD和LSZ活性差异均显著(P<0.05);试剂二各浓度组间的SOD和LSZ活性都有差异显著(P<0.05),高浓度组与中低浓度组的POD活性差异显著(P<0.05);试剂三各浓度组间的SOD、POD和LSZ活性均有显著差异(P<0.05);试剂四各浓度组间的SOD活性差异显著(P<0.05),低浓度组与中高浓度组的POD活性差异显著(P<0.05),高浓度组与中低浓度组的LSZ活性差异显著(P<0.05);试剂五低浓度组与中低浓度组的SOD活性差异显著(P<0.05),各浓度组间的POD活性差异显著(P<0.05),高浓度组与中低浓度组的LSZ活性差异显著(P<0.05)。
2.3 微生态制剂对幼参养殖水体水质的影响
2.3.1 静水条件下水质的变化 试验经过48h结束,结束时测定试剂二至试剂五各处理组DO含量低于4mg/L。5种微生态制剂各处理组NH+4-N、NO-2-N、DO含量的调控结果见图1和图2。对照组NH+4-N和NO-2-N含量随时间的增加而升高,与添加微生态制剂组(试剂二NH+4-N24h、试剂四NH+4-N48h组除外)差异均显著(P<0.05)。而对照组DO含量随时间的增加而降低,与添加微生态制剂组(试剂一48h组除外)差异均显著(P<0.05)。24h时,添加微生态制剂组NH+4-N、NO-2-N含量降到最低点,试剂二和对照组NH+4-N含量差异不显著,与其它各组差异显著(P<0.05);试剂二和试剂四间NO-2-N含量差异不显著,与其它各组差异显著(P<0.05),试剂二DO含量与其它各组差异显著(P<0.05),试剂一、三、四和五组间DO含量差异不显著。48h时,各组NH+4-N、NO-2-N含量上升(试剂四NH+4-N组除外),试剂一和试剂二NO-2-N含量差异不显著,与其它各组差异显著(P<0.05);DO含量继续下降,试剂一DO含量和对照组差异不显著,与其它各组差异显著(P<0.05),试剂三、四、五组间DO含量差异不显著。
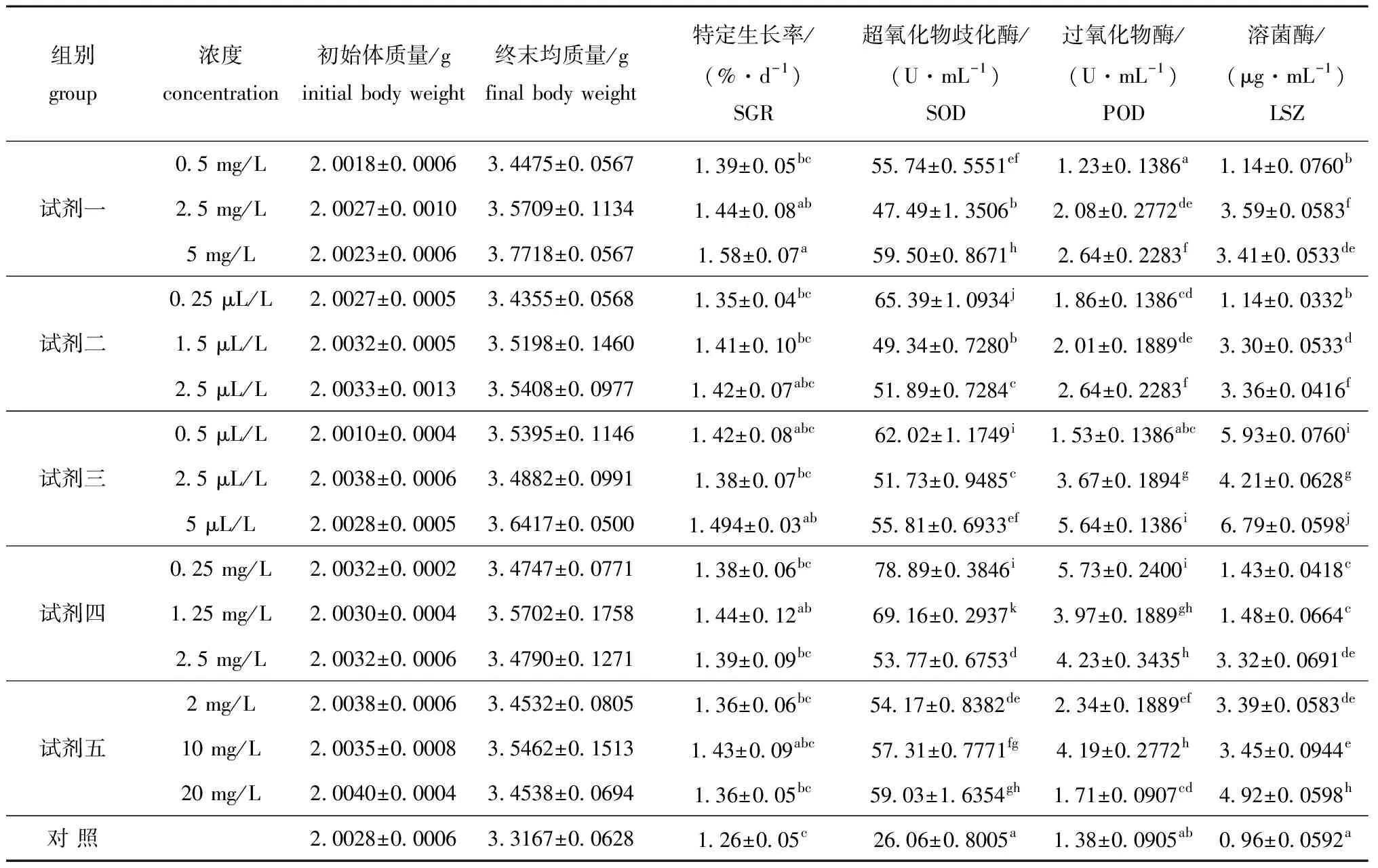
表4 微生态制剂对刺参生长、酶活性的影响
注:标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05)。
Note:The means with the different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences.
2.3.2 充气条件下水质的变化 试验进行第五次(第20天)测定时,发现两种微生态制剂组水体的NH+4-N含量已高于0.02 mg/L,其它各组的NH+4-N含量也接近0.02 mg/L,达到试验设计要求,故结束试验。
5种微生态制剂试验组水中NH+4-N和NO-2-N含量的测定结果见图3。试验结果表明,第20天之前,各组NH+4-N和NO-2-N含量(NH+4-N组15 d除外)差异均不显著(P>0.05);第20天时,试剂一组和试剂四组的NH+4-N含量>0.02 mg/L,显著高于其它组(P<0.05);试剂四组和对照组的NO-2-N含量显著高于其它组(P<0.05)。试验期间NO-2-N含量随试验时间的延续而增高,对照组也有同样趋势。
3 讨论
3.1 微生态制剂对幼参的急性毒性试验
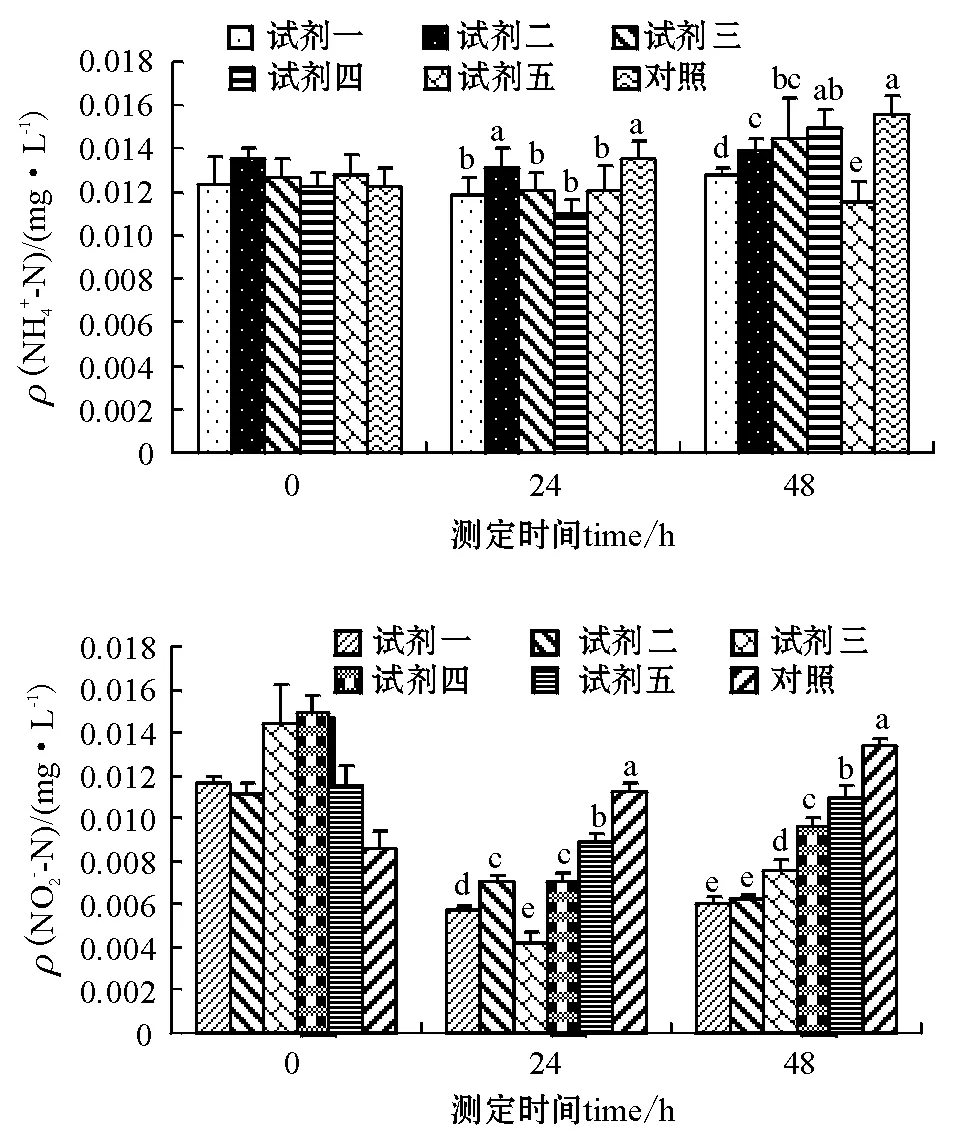
注:标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。Note:The means with the different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia.图1 微生态制剂对静水中NH+4-N、NO-2-N含量的调控Fig.1 The control of NH+4-N, and NO-2-N in the static water by the probiotics
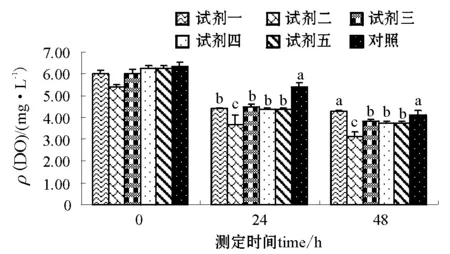
图2 微生态制剂对静水中DO含量的调控Fig.2 The control of DO in the water by the probiotics
随着药物浓度的提高和作用时间的延长,幼参死亡率逐渐增加,这与药物的浓度大小、药物的积累等因素有关。微生态制剂对幼参的半致死浓度均随时间的增加而降低。研究证明,无脊椎动物的氧化杀菌机制是通过血细胞或体腔细胞吞噬活动中释放出的活性氧进行杀菌的,在吞噬过程中,活性氧的强弱直接反映了血细胞杀菌能力的强弱[23-24]。体内累积的微生态制剂不断消耗活性氧,从而降低机体的免疫力,增加死亡几率。急性毒性试验结果表明,5种微生态制剂对幼参的48 h LC50、96 h LC50和SC远远高于Cu2+、Zn2+、Cd2+、Cr6+、Hg2+、Se4+等的浓度[25-26];与常用的抗菌素、消毒剂和除草剂相比,试剂一和试剂四的毒性与之相似,而其它三种微生态制剂的毒性要远小于它们[15,17,27]。高浓度下的微生态制剂能够刺激并导致幼参的细胞脱水收缩,也能造成幼参的急性致死。幼参在高浓度微生态制剂的作用下会出现不同程度的中毒症状,参体收缩,体表黏液分泌增多,出现局部溃烂或水疱状突起,中毒个体活性减弱,严重者死亡;或死亡个体急剧收缩成团,身体僵硬。有资料表明,刺参消化道中细菌数量可达1×107个/mL而不导致疾病[28],微生态制剂对刺参致死,消化道细菌过量也可能是一个原因。
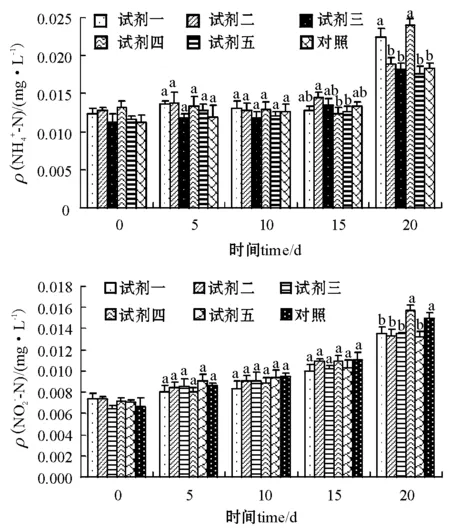
图3 微生态制剂对充气水中NH+4-N、NO-2-N的含量的调控Fig.3 The control of NH+4-N, and NO-2-N in the areated water by the probiotics
安全浓度是在毒性试验中对试验动物无影响的毒物浓度,在生物体内一般仅能理解为相对意义上的安全。通过上述试验,得出了5种微生态制剂的安全浓度,其中试剂五(固态型)最为安全,其安全浓度为280 mg/L,远远高于生产上的使用量(生产中该试剂一般使用量为0.25~0.50 mg/L)。因此,从安全性来说,该种微生态制剂是比较理想的生物制剂,可以用于刺参生产中。固态微生态制剂需要水溶剂,必须溶于水中或与饲料混拌才起作用,故相应的安全浓度要高于液态微生态制剂。本试验结果表明,液态微生态制剂的毒性要大于固态微生态制剂。
本试验中发现,刺参出现严重不适症状(化皮,明显的表皮损伤,身体弯曲,成团),试验结束后及时更换新鲜海水,部分刺参可重新恢复活力,这一现象与周玮等[27]的研究结果一致。更换新鲜海水后刺参虽然存活,但是否对其各项生长指标产生不良影响,该影响日后能否消除,还有待进一步研究。
3.2 微生态制剂对幼参生长和酶活性的影响
本试验中仅在宏观上研究了微生态制剂对刺参生长和酶活性的影响。许多研究结果表明,饲料中添加微生态制剂可以不同程度地提高水产养殖动物的消化酶活性,提高成活率,促进其生长[29-31]。袁成玉等[14]的研究表明,随着肠道中的有益菌逐渐占优势,刺参在微生态平衡系统下生长速度加快。这说明微生态制剂的作用就在于能改善养殖动物肠道环境,使有益菌种成为肠道中的优势种,从而促进机体吸收较多营养物质,提高动物的消化率,促进其生长。微生态制剂对刺参幼体的特定生长率为4~6 %/d[14],而本试验中幼参的特定生长率为1~2 %/d,明显偏低。可能是因为本试验中所用的微生态制剂均是以改善水质环境为主的。张新明等[32]认为,微生态制剂本身含有大量的营养物质,同时随着它们在动物消化道内的繁衍、代谢,可产生动物生长所需的营养物质、生长素、消化酶、各种B族维生素,从而加强动物的营养代谢,协助消化饵料,促进生长;微生态制剂可通过竞争抑制以及产生抑菌物质等方式抑制有害细菌,改善对虾的生存环境,从而促进对虾的生长。
本试验结果表明,5种微生态制剂都能显著提高幼参的SOD、LSZ、POD活性,验证了刺参生长与免疫酶活性之间有一定的正向关系[33],但酶活性达最大值的试验组其特定生长率并没有达到最大,说明添加微生态制剂并不是促进刺参生长的唯一手段。本试验中采用的微生态制剂都含有芽孢杆菌,而芽孢杆菌可以提高消化酶活性,增加机体对养分的消化利用,提高饲料转化率,进而促进生长。因此,酶活性变化可以作为营养状态指标来指导刺参养殖,改善饲养效果[34]。此外,微生态制剂与肠道固有微生物菌群之间以及投喂菌群之间的作用关系还需进一步研究。
3.3 微生态制剂对幼参养殖水体水质的影响
本试验中,在静水且不换水的条件下,最初微生态制剂能够降解刺参的代谢产物和水体中的残饵,使NO-2-N和NH+4-N含量都降低。但微生态制剂同样耗氧,DO若得不到补充(池塘水体有浮游生物微循环),随着时间的延长,微生态制剂净化水质的能力下降,水体中代谢产物和残饵逐渐增多,导致水体中NO-2-N和NH+4-N含量升高,溶氧持续降低,并达到临界点。这可能是该试验中微生态制剂没有达到良好净化水质的原因。从本试验结果可知,24 h前,NO-2-N和NH+4-N含量都降低,尤其对降低NO-2-N的效果十分显著。这说明微生态制剂还是能够起到净化水质的作用,从而也验证了Wang[35]的研究结果。5种微生态制剂中都含有芽孢杆菌,芽孢杆菌能够促进底泥下层需氧异养细菌(包括弧菌)的生长,加快底泥物质和能量的代谢及再循环,有利于养殖环境的自我净化[36]。沈南南等[37]的研究表明,小球藻和芽孢杆菌联合使用,明显优于单一成分。陈海敏等[38]的研究也表明,光合细菌和小球藻联合使用能很好的去除水体中的氮和磷,尤其对氨氮的去除效果最好。
试验期间,微生态制剂对水体的净化能力并没有随时间的增加而呈规律性变化,与对照组差异不显著。其原因可能是,在溶氧充足的条件下(试验期间DO>7 mg/L),氧可以促进亚盐硝酸盐的转化[39],故微生态制剂的作用不明显,而且本试验又是在室内条件下完成的,微生态制剂单一的作用也不明显。
参考文献:
[1] 赵文.刺参池塘养殖生态学及健康养殖理论[M].北京:科学出版社,2009.
[2] 隋锡林,邓欢.刺参池塘养殖的病害及防治对策[J].水产科学,2004,23(6):22-24.
[3] 邹积波,高广斌,姜洪亮,等.分析刺参养殖发病原因、研讨对策,走可持续发展之路[J].水产科学,2006,25(1):53-54.
[4] Parker R B.Probiotics-The other half of the antibiotics story[J].Anita Nutr Heal,1974,29:4-8.
[5] Zheng T L.The contribution of some marine microorganisms in the decontamination of shellfish[J].Revue Internationale Oceanographice Medicale,1989,94:1-14.
[6] 许振英,张子仪.动物营养研究进展[M].北京:中国农业出版社,1994:239-249.
[7] Kozasa M.Toyocerin(Bacillustoyoi) as growth promoter for animal feeding[J]. Microbiol Aliment Nutr, 1986(4):121-135.
[8] Moriarty D J W.Control of luminous vibrio species in penaeid aquaculture ponds[J].Aquaculture,1998,164(1):351-358.
[9] 王彦波,查龙应,许梓荣.微生态制剂改善对虾池塘底质的效果[J].应用生态学报,2006,17(9):1765-1767.
[10] 冯俊荣,陈营,付学军,等.微生态制剂对养殖水体水质条件的影响[J].海洋湖沼通报,2005(4):104-108.
[11] 王志敏,张文香,张卫国,等.在循环养殖系统中添加微生态制剂去除氨氮和亚硝酸氮的实验[J].水产科学,2006,25(4):17-21.
[12] 王彦波,邓岳松.微生态制剂对虾池水质影响的研究[J].水利渔业,2003,23(2):16-17.
[13] Soderhall K.Biochemical and molecular aspects of cellular communication in arthropods[J].Boll Zool,1992,59(2):141-151.
[14] 袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612-615.
[15] 严正凛.微生态制剂对九孔鲍育苗效果的研究[J].水产学杂志,2008,21(1):21-25.
[16] 吕豪,周伯文.四种药物对刺参幼参毒性的初步研究[J].水产科学,2005,24(6):6-9.
[17] 李强,罗永成,李华,等.常用抗菌药物和消毒剂对刺参幼体的急性毒性试验[J].大连水产学院学报,2005,20(2):105-110.
[18] 沈建忠. 动物毒理学[M].北京:中国农业出版社,2004:83-87.
[19] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版杜,1989:75-156.
[20] 湖南医学院卫生教研组.卫生毒理实验方法[M].北京:人民卫生出版社,1979:174-176.
[21] 国家环境保护局《水生生物检测手册》编辑委员会.水生生物检测手册[M].南京:东南大学出版社,1993:112-115.
[22] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[23] Weleh W D,Devlin P.Analysis and comparison of the luminal-depended Chemiluminescence response of alveolar macrophages and neutrophils[J].Reticuloendothel Soc,1980,28:273-283.
[24] Horan T D,English D,Mcpherson T A.Association of neutrophil chemiluminescence with microbicidal activity[J].Clin Immunol Immunophathol,1982,22:259-269.
[25] 孙振兴,陈书秀,陈静,等.四种重金属对刺参幼参的急性致毒效应[J].海洋通报,2007,26(5):80-85.
[26] 孙振兴,王慧恩,王晶,等.汞、镉、硒对刺参(Apostichopusjaponicus)幼参的单一毒性与联合毒性[J].海洋与湖沼,2009,40(2):228-234.
[27] 周玮,夏念丽,刘永兴,等.刺参对几种除草剂的急性毒性试验[J].水产科学,2005,24(5):28-30.
[28] Fletcher T C.Non-specific defense mechanisms of fish [J].Developmental and Comparative Immunology Supp, 1982, 10(2): 123-132.
[29] Pan K C,Yang H B.Progress in study of mechanism ofBacillus[J].Feed Industry, 1997, 18(9):32-34.
[30] 田维熙,陈俊芹,黄莉莉,等.光合细菌在对虾养殖中应用效果的研究[J].饲料研究,1995(8):4-6.
[31] 孙奕,陈玛.刺参体内外微生物组成及其生理特征的研究[J].海洋与湖沼,1989,20(4):300-307.
[32] 张新明,付宁.微生态制剂对凡纳滨对虾促生长作用试验[J].水利渔业,2006,26(4):38-39.
[33] Horan T D,English D,Mcpherson T A.Association of neutrophil chemiluminescence with microbicidal activity[J].Clin Immunol Immunophathol,1982,22:259.
[34] 王彦波,许梓荣,邓岳松.微生态制剂在水产养殖中的作用机理研究[J].中国饲料,2004(3):31-32.
[35] Wang Xianghong.Use of probiotics in aquaculture[J].Hjgh Technology Letters,2002,8(3):22-27.
[36] 杨艳,刘萍,马鹏飞,等.巨大芽孢杆菌MPF-906对养鱼水质净化的初步研究[J].水产养殖,2007,28(3):6-8.
[37] 沈南南,李纯厚,贾晓平,等.小球藻与芽孢杆菌对对虾养殖水质调控的研究[J].海洋水产研究,2008,29(2):48-50.
[38] 陈海敏,陈声明.工厂化水产养殖废水菌藻联合处理模式研究[J].浙江树人大学学报,2002,2(4):64-66.
[39] 张进凤,李瑞伟,刘杰凤,等.淡水养殖水体氨氮积累危害及生物控制的研究现状[J].河北渔业,2009(6):41-44.

