肝复康对大鼠肝组织血小板衍生生长因子表达及对胶原合成的影响*
李 骢 周 情 姜妙娜 张彩华 贾玉杰
血小板衍生生长因子(platelet-derived growth factor,PDGF)是目前已知多肽生长因子中对肝星状细胞(HSC)作用最强的有丝分裂原[1-4],在肝纤维化发生发展中起着非常重要的作用。我们观察了肝复康对大鼠肝组织PDGF表达的影响。
材料与方法
一、实验动物和细胞 健康SD大鼠(雌雄不限),体重180~220克,清洁级,由本校动物实验中心提供。HSC-T6细胞株由上海中医药大学肝病研究所徐列明教授惠赠,表型为活化的HSCs。
二、药物及含药血清的制备 同前报道。
三、肝纤维化动物模型的制备 随机将大鼠分为正常对照组、模型组和肝复康治疗组。在造模时,皮下注射以橄榄油稀释的10%四氯化碳(5ml.kg-1),每周两次,共12周。正常对照组以同样方法皮下注射生理盐水。其中肝复康治疗组于造模第9周后开始用肝复康(溶于10ml/kg生理盐水)312.5mg.kg-1.d-1灌胃至20周,而正常对照组和模型组则以等容量的生理盐水灌胃。于21周末处死动物,迅速取出肝组织,称取肝脏湿重,置-70℃冰箱保存备检。
四、HSC-T6细胞培养 将传代培养的HSC按常规方法接种于6孔板中,分为正常对照组:加10%对照血清的DMEM;模型组:10%对照血清+PDGF(终浓度60ng/ml)的DMEM;肝复康治疗组:10%药物血清+PDGF(终浓度60ng/ml)的DMEM。以上各组均培养24小时,分别收集细胞。
五、大鼠肝组织PDGF-BB表达的检测 采用SP法,兔抗鼠PDGF-BB多克隆抗体(工作浓度1:400)购自北京博奥森生物技术有限公司。
六、肝组织及HSCsⅠ型胶原mRNA检测 采用RT-PCR法。引物由华大基因研究中心合成。引物详见表1。

表1 引物序列
七、统计学处理 应用 SPSS 13.0软件,所有数据均用表示,采用单因素方差分析,然后用LSD法进行两两比较。P<0.05为有统计学差异,P<0.01为有显著性统计学差异。
结果
一、中药对大鼠血清生化指标的影响 模型组大鼠血清ALT、AST和球蛋白含量明显高于正常对照组,白蛋白和白/球比明显低于正常对照组(P<0.01);肝复康治疗组大鼠血清ALT、AST水平及血清球蛋白水平均明显降低,与模型组相比有显著性差异(P<0.01);治疗组大鼠血清白蛋白和白/球比水平明显上升,与模型组相比有显著性差异(P<0.01,表2)。
表2 各组血清生化指标()的比较

表2 各组血清生化指标()的比较
与模型组比,①P<0.01
组别 只 ALT(U/L)AST(U/L)白蛋白(g/L)球蛋白(g/L) 白球比对照组 12 20.26±6.12① 42.75±10.19① 42.03±5.17① 23.45±4.61①1.91±0.24①模型组 11 74.19±11.74 89.63±11.97 26.41±3.79 34.42±2.53 0.91±0.30治疗组 12 28.73±7.59① 47.01±10.72① 40.92±6.38① 24.93±4.43①1.61±0.41①
二、肝复康对大鼠肝组织PDGF-BB蛋白表达的影响 在正常组大鼠肝细胞PDGF-BB呈弱表达;模型组大鼠肝组织PDGF-BB呈强阳性表达,主要见于纤维间隔区,尤其见于纤维间隔和炎性细胞浸润区,细胞内有粗糙的阳性团块表达;与模型组相比,治疗组大鼠肝组织PDGF-BB阳性细胞数量则明显减少。对PDGF-BB蛋白光密度积分分析,发现模型组PDGF-BB的表达(0.297±0.01)显著高于正常组(0.229±0.03,P<0.01);治疗组 PDGF-BB 表达(0.231±0.04)较模型组明显下降,差异有统计学意义(P<0.01),而治疗组与正常对照组比较,无统计学差异(图1)。

图1 大鼠肝组织PDGF-BB表达情况(SP,×400)
三、肝复康对肝组织Ⅰ型胶原mRNA水平的影响 正常组大鼠肝组织Ⅰ型胶原mRNA水平较低;模型组大鼠肝组织则明显上升,与正常组相比有显著性差异(P<0.01);治疗组大鼠肝组织较模型组明显下降,有显著性差异(P<0.01),但与正常对照组相比无统计学差异(P>0.05,图 2、3)。

图2 肝组织Ⅰ型胶原mRNA水平

图3 肝组织β-actin mRNA水平
四、肝复康对HSCsⅠ型胶原mRNA水平的影响 在未加入PDGF刺激的正常对照组,细胞Ⅰ型胶原mRNA呈相对低水平;在加入对照血清及PDGF刺激的模型组,细胞Ⅰ型胶原mRNA水平与正常对照组相比明显上调(P<0.01);药物治疗组与模型组比,由PDGF刺激诱导的Ⅰ型胶原mRNA水平明显下降(P<0.01,图 4)。
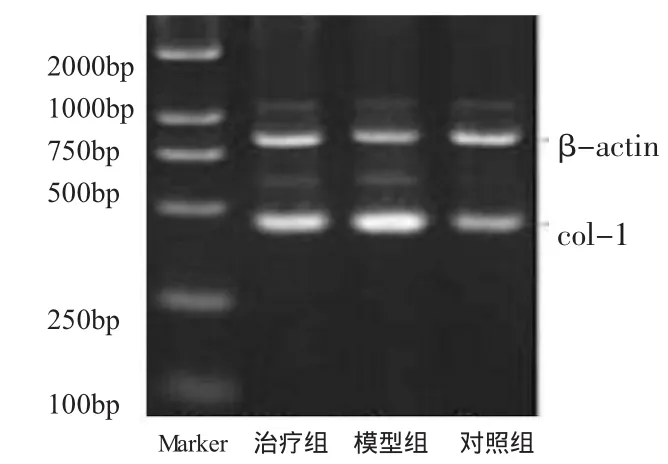
图4 HSCsⅠ型胶原mRNA水平
讨论
肝纤维化的发生机制是十分复杂的病理生理学过程,主要由于ECM过度增生及降解减少所致。HSC在肝纤维化的发生发展中起重要作用[5,6]。许多细胞因子可作用于HSC,经多种信号转导途径使其激活[7,8],并转化为肌成纤维细胞。PDGF能够强烈刺激HSC[9,10],使其活化,并分泌大量ECM,沉积于肝脏。这也是肝纤维化形成的关键。PDGF主要有三种形式的二聚体亚型,即PDGF-AA、PDGF-BB及PDGF-AB。二聚体之间通过三对二硫键相连接[11]。最近还发现了PDGF家族的新成员PDGF-C和PDGF-D。目前的研究表明,他们与恶性肿瘤的形成和胚胎发育有关[12]。PDGF必须与细胞膜上的相应受体结合后才能发挥其生物学效应。PDGF受体(PDGFR)分子由 α(PDGFR-α)及 β(PDGFR-β)两种亚单位组成,在肝纤维化时HSC表面的PDGF受体以β受体为主,该受体与PDGF-BB具有较强的亲和力,故PDGF-BB在肝纤维化过程中的作用尤为突出[13,14]。有研究发现在肝纤维化时,PDGF-BB mRNA水平明显上调[15]。本实验结果显示,模型组大鼠肝组织PDGF-BB阳性细胞数目明显增多,这与以往所报道的PDGF-BB在肝纤维化发生中的作用相符。
中药肝复康的主要成分有丹参(活血化瘀)、柴胡、当归(补血合血)、黄芪(益气)、赤、白芍(活血化瘀)等。本课题组多年来已经证实其对肝纤维化具有很好的治疗作用[16]。本实验结果显示,与模型组相比,治疗组大鼠血清ALT、AST和球蛋白水平明显下降,白蛋白和白/球比明显升高;免疫组织化学染色显示治疗组肝组织PDGF-BB阳性细胞数较模型组明显减少。此外,应用肝复康治疗后,肝组织和HSC中Ⅰ型胶原mRNA水平较模型组也明显下调。因此,本研究通过体内和体外实验均证实,肝复康通过降低PDGF的表达,抑制了Ⅰ型胶原的合成,缓解了肝纤维化的程度。
[1]Kisseleva T,Brenner DA.Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis.J Gastroenterol Hepatol,2007,22(Suppl 1):S73-S78.
[2]Karlin RK,Ralfalff W,Henning WZ,et a1.Hepatic recruitment of the inflammatory Gr1+monocyte subset upon liver injury promotes hepatic fibrosis.Hepatology,2009,50(1):261-274.
[3]Xu TT,Jiang MN,Li C,et al.Effect of Chinese traditional compound,Gan-fu-kang,on CCl4-induced liver ibrosis in rats and its probable molecular mechanisms.Hepatol Res,2007,37:221-229.
[4]Lou JL,Jiang MN,Li C,et al.Herb medicine Gan-fu-kang attenuates liver injury in a rat fibrotic model.J Ethnopharmacol,2010,128:131-138.
[5]Gabele E,Brenner DA,Rippe RA.Liver fibrosis:signals leading to the amplification of the fibrogenic hepatic stellate cell.Front Biosci,2003,8:69-77.
[6]Fu YM,Zhou YJ,Zheng SZ,et al.The antifibrogenic effect of(-)epigallocatechin gallate results from the induction of de novo synthesis of glutathione in passaged rat hepatic stellate cells.Lab Invest,2006,86:697-709.
[7]吴文娟,杨妙芳,朱人敏.肝星状细胞活化的分子生物学机制研究进展.实用肝脏病杂志,2009,12(4):308-311.
[8]汪美凤,平键,成扬.肝星状细胞主要信号转导通路与肝纤维化的关系.实用肝脏病杂志,2010,13(6):466-469.
[9]Lin JG,Chen AP.Activation of peroxisome proliferator-activated receptor by curcumin blocks the signaling pathways for PDGF and EGF in hepatic stellate cells.Lab Invest,2008,88:529-540.
[10]Liu Y,Wen XM,Liu EL,et al.Therapeutic targeting of the PDGF and TGF-beta-signaling pathways in hepatic stellate cells by PTK787/ZK22258.Lab Invest.2009,89(10):1152-60.
[11]王琳芳,杨克恭.医学分子生物学原理.北京:高等教育出版社,2001:188-202.
[12]Reigstad LJ,Varhaug JE,Lillehaug JR.Structural and functional specificities of PDGF-C and PDGF-D,the novel members of the platelet-derived growth factors family.FEBS J,2005,272(22):5723-5741.
[13]Di SA,Bendia E,Svegliati-Baroni G,et al.Rearrangement of the cytoskeletal network induced by platelet-derived growth factor in rat hepatic stellate cells:role of different intracellular signalling pathways.J Hepatol,2002,36(2):179-190.
[14]Taylor CC.Platelet-derived growth factor activates porcine thecal cell phosphatidylinositol-3-kinase-AKT/PKB and ras-extracellular signal-regulated kinase-1/2 kinase signaling pathways via the platelet-derived growth factor-beta receptor.Endocrinology,2000,141(4):1545-1553.
[15]Borkhan-Kamphorst E,Van Rreyen CR,Ostendorf T,et al.Profibrogenic potential of PDGF-D in liver fibrosis.J Hepatol,2007,46(6):1064-1074.
[16]张彩华,姜妙娜,袁丽君,等.肝复康对HSC-T6细胞Wnt信号转导通路调节作用的观察.实用肝脏病杂志,2011,14(4):253-256.

