OGG1 Ser326Cys多态性与结直肠癌发病风险的meta分析
高天翼,李瑞,许晔琼,聂珍琳,顾玲,陈丽萍,宋国齐,王书奎
南京医科大学附属南京第一医院中心实验室,江苏 南京 210006
0 前言
结直肠癌是西方国家最常见的死亡原因之一,常常受到环境因素和遗传特性的影响。许多癌症的发生,特别是结直肠癌,常由DNA的损伤引起,而这些影响因素有化学物质、吸烟、高脂饮食、饮酒等[1];但是人类已经建立起一套复杂的基因修复系统来避免DNA损伤引起的染色体异常[2-3]。目前在基因修复系统的各条路径上已发现100多种蛋白[4-5],包含碱基切除修复蛋白(BER)、核苷酸切除修复蛋白、双链断裂修复蛋白以及错配修复蛋白(MMR)等。流行病学调查表明,除了MMR基因在结直肠癌的发病中有重要作用外,参与活性氧簇(ROS)造成的基因氧化损伤初始修复的BER路径上的基因同样在肿瘤的发生过程中起到重要作用。ROS引起的基因损伤方式包括造成G:C 到T:A 的转化,引起致癌基因的活化以及引起肿瘤抑制基因失活导致的致癌作用等,而BER通路在抵抗DNA氧化损坏的影响中起着重要的作用。
8-羟基鸟嘌呤DNA糖苷酶1(OGG1)[6]是BER通路中一个关键蛋白,能够识别和切除那些单个DNA损伤引起的寡核苷酸病变,包括8-羟基鸟嘌呤(8-oxoGua)、2,6-二氨基-4-羟基-5-甲酰胺基嘧啶(FapyGua)、2,6-二氨基-4-羟基-5N-甲基甲酰胺嘧啶(Fapy-7-MeGua)、8-羟基腺嘌呤等[7-8]。许多研究发现肿瘤患者在基因修复效率上呈现下降趋势[9-10],而DNA修复基因多态性的表现形式或许是导致这些酶活性下降最为可能的原因[11]。目前已发现的OGG1基因多态性有多种[12-14],但越来越多的研究侧重于常见的Ser326Cys单核苷酸多态性的研究。OGG1外显子7在1245 bp(C1245G)处C/G多态性造成了密码子326的单个氨基酸置换,即丝氨酸(Ser)被半胱氨酸(Cys)取代(Ser326Cys,rs 1052133 )[15]。更重要的是,在8-oxoGua被删除的寡核苷酸[16]及经过纯Cys326或Ser326 OGG1酶处理的8-oxoGua和FapyGua释放的γ-辐照DNA中[7,17],OGG1-Cys326被发现呈现出更低的酶活性。自从OGG1在肿瘤发病的潜在功能被研究者发表以来[18],许多研究探讨了OGG1的遗传变异与结直肠癌易感性的联系以及基因与环境的相互作用[19-24]。尽管OGG1 Ser326Cys多态性与CRC发病风险的关联在很多研究中得到呈现[25-26],但这些结果研究仍没有定论。考虑到OGG1在结直肠癌中的作用,我们对有符合条件的病例对照研究进行meta分析,全面评估OGG1 Ser326Cys多态性在结直肠癌发病风险中的作用。
1 资料与方法
1.1 搜索策略
Pubmed的搜索项目为“OGG”“OGG1”“hOGG1”“ polymorphism”“colorectal cancer”,搜索截止日期为2010年9月22日。搜索结果限制为英文表达的文献,并且Pudmed中“Related Articles”选项也被用来寻找潜在的相关文献。另外,文献中引用文献也在我们的搜索范围内,最后12篇文献被确定能够用于本次meta分析,并且这些文献都遵循以下标准:① 评估了OGG1 Ser326Cys多态性在结直肠癌发病风险中的作用;② 符合病例-对照研究;③ 包含可用基因型频率。
1.2 数据提取
两名研究者分别将所需信息从这些被选的文章中仔细筛选出来,所摘录的信息包括:作者、出版年限、癌症病例与对照的选择和特点、质控来源(随机抽取或医院来源为基础)、人口、民族、基因分型资料和族群等,根据族群信息将提取数据归类为欧洲人和亚洲人,本次研究不包含非洲人。
1.3 统计方法
通过χ2检验对文献中的质控人群基因型分布进行检测,检验在人口分布上是否符合哈温平衡(HWE;P<0.05,具有显著差异)。OGG1 Ser326Cys多态性与结直肠癌发病风险的关联强度采用OR及其95%可信区间(CI)表示。研究采用Z检验汇总的OR值统计学差异。以野生型Ser/Ser纯合子为对照,首先评估Ser/Cys和Cys/Cys基因与结直肠癌的关系,来评价Ser/Cys + Cys/Cys 与 Ser/Ser 及 Cys/Cys与Ser/Cys +Ser/Ser在结直肠癌发病风险中的显性和隐性作用。并且本次研究对人种以及标本来源进行了分层分析。采用Q统计[27](P<0.1,具有显著差异)和I2统计进行异质性检验,以量化异质性在总变异中的比例。作为标准,I2值<25%为低,<50%为中,>50%为高[28]。固定效应模型和随机效应模型在数据合并中都被采用,但当存在异质性时,随机效应模型更为适合[29-31]。通过漏斗图和Egger’s线性回归来检验文献数据的偏倚情况。本次meta分析中所有统计学检验采用的都是STATA 10.0(Stata Corporation College Station,TX,USA)。
1.4 主要方法
本文纳入的文献主要运用了以下3种测序方法:
(1)聚合酶链反应和限制性片段长度多态性(PCRRFLP):是用PCR仪扩增目的DNA片段,扩增产物用特异性内切酶消化切割成不同大小片段,经过凝胶电泳,在凝胶成像与分析系统上分辨。不同等位基因的限制性酶切位点分布不同,产生不同长度的DNA片段条带。
(2)直接测序法:利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。直到掺入一种链终止核苷酸为止。每次序列测定由一套4个单独的反应构成,每个反应含有所有4种脱氧核苷三磷酸 (dNTP),并混入限量的一种不同双脱氧核苷三磷酸(ddNTP)。由于ddNTP缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。终止点由反应中相应的双脱氧而定。每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千个碱基的链终止产物。它们具有共同的起始点,但终止在不同的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
(3)Taqman:Taqman荧光探针是一寡核苷酸,两端分别标记一个荧光发射基团和一个荧光淬灭基团。探针完整时,发射基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使荧光发射基团和荧光淬灭基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步,从而实现定量。
1.5 主要仪器设备
普通离心机 卢湘仪集团
2 结果
2.1 数据特征
通过关键词和手动搜索,总共有182篇相关文献,见图1。首先,浏览这些文献,可排除128篇文献(122篇文献不是有关结直肠癌的研究,6篇文献不属于肿瘤研究);其次,回顾文献摘要,将具有完整文献发表的留下。对这些文献进一步浏览,再排除36篇(6篇文献是综述,2篇文献没有可用数据,9篇文献非英文书写,19篇文献为基础研究);然后,对剩下的文献全文进行筛选后,排除6篇文献(3篇没有报道可用的数据,1篇是综述,2篇是对以前文献的重复);将剩下的纳入标准,共有12个条件符合研究,涉及4233例和6494组对照被纳入最后的数据分析,见表1。其中4篇为有关亚洲人的研究,8篇为有关欧洲人的研究。其中10篇文献应用Tapman探针和PCR-RFLP。共有8篇研究欧洲后裔,4篇研究亚洲后裔。结直肠癌在大多数的研究都经过病理组织确认。此外,对照组在年龄上相匹配,且其中8组以随机人群抽取为基础,4组以医院来源为基础。
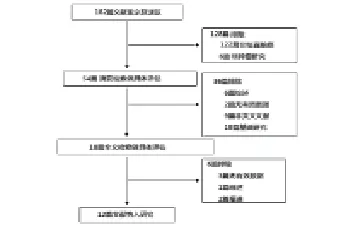
图1 文献纳入和排除流程图
2.2 定量分析
如表2所示,OGG1 Ser326Cys的全部基因型与结直肠癌的发病无明显联系。总之,在Cys/Cys vs Ser/Ser(OR=1.19,95%CI=0.92~1.53)、Ser/Cys vs Ser/Ser(OR=1.04,95%CI=0.95~1.13)、Ser/Cys + Cys/Cys vs Ser/Ser(OR=1.06,95%CI=0.98~1.16)(图2)和Cys/Cys vs Ser/Cys + Ser/Ser(OR=1.11,95%CI=0.90~1.38)无明显联系;此外,在种族及对照组来源的分层分析中,OGG1 Ser326Cys的各基因型无明显的风险增长。
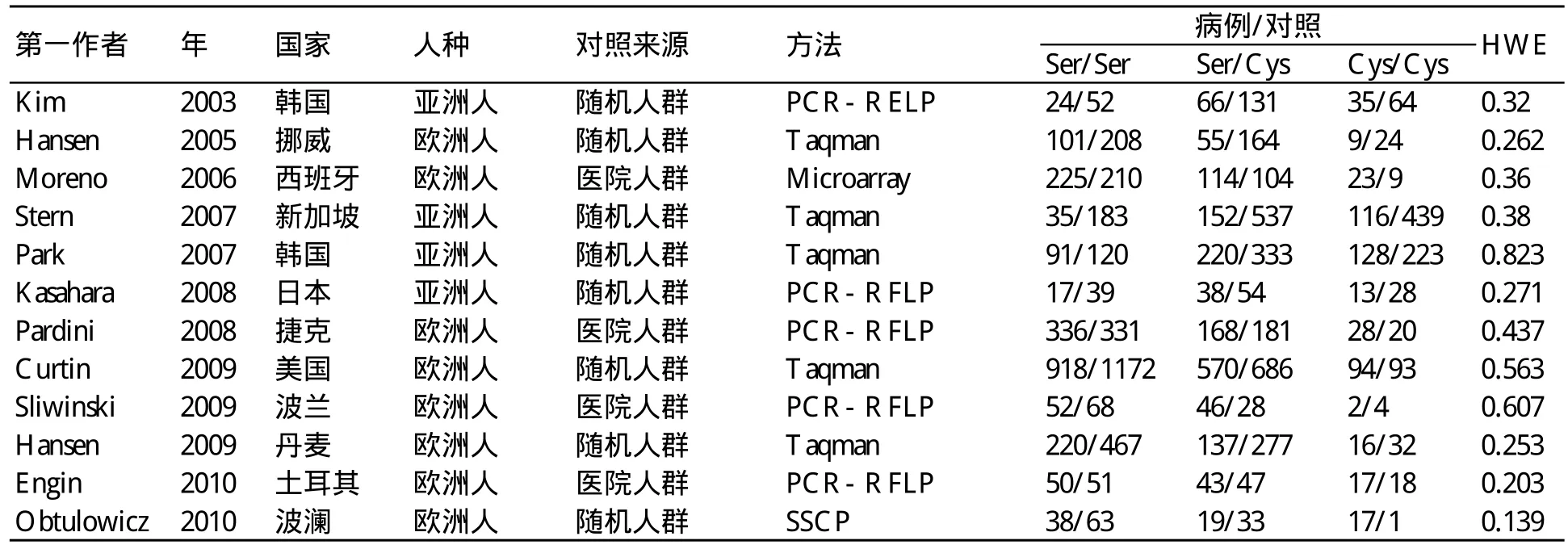
表1 hOGG1 Ser326Cys多态性和结直肠癌发病风险病例-对照研究概要
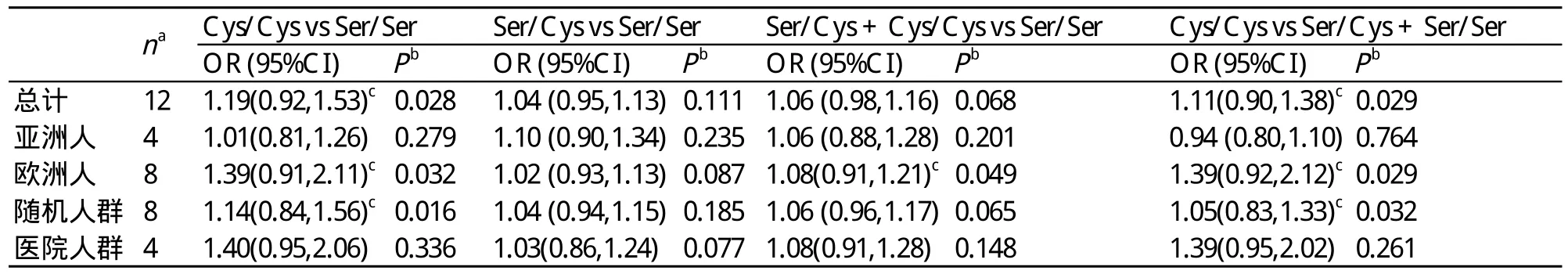
表2 hOGG1 Ser326Cys多态性和结直肠癌发病风险的分层分析

图2 OGG1 Ser/Cys多态性与结直肠癌发病风险联系随机效应森林图(Cys/Cys + Ser/Cys vs Ser/Ser)
2.3 敏感性分析和发表偏倚
敏感性分析时,通过依次移除单个研究评估研究个体对合并OR值的影响。结果显示无研究个体对整体OR值具有显著影响。森林图和Egger’s 检测被用来检验发表偏倚。漏斗图的形状未显示任何对称的迹象,同时Egger’s 检测显示发表偏倚缺失(t=0.87,P=0.404,Cys/Cys + Ser/Cys vs Ser/Ser),见图3。
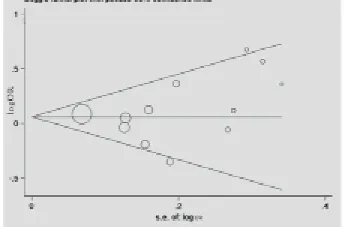
图3 hOGG1 Ser326Cys多态性发表偏倚95%可信区间漏斗图(Cys/Cys +Ser/Cys versus Ser/Ser)
3 讨论
过去可能受样本量或者基因背景的影响,有关OGG1 326Cys 等位基因和结直肠癌发病风险的研究呈现出相互矛盾的结果。meta分析是一个有效解决大量研究结果不一致的分析方法。在本次研究中,通过对12篇文献严格的meta分析,提供了有关OGG1 Ser326Cys与结直肠癌发病风险关系最为详尽的评估。同时,本次研究对人种和对照来源进行了亚组分析。异质性和敏感性研究都被严格执行,确保本次meta分析的可靠性。本次研究通过meta分析表明OGG1 Ser326Cys多态性与结直肠癌总发病率无联系。
由于其相较于Ser326较弱的防止8-oxoG相关突变的能力,以往研究表明OGG1-Cys326能增加癌症易感性[7,32]。在本次meta分析中,我们未发现OGG1 Ser326Cys多态性与结直肠癌之间的联系,此外,人种的分层分析表明亚洲人与欧洲人无差异。有研究表明遗传基因异质性在结直肠癌病理中具有重要作用,此外,结直肠癌的致癌作用受遗传背景与环境因素间相互作用的影响。另有研究推断不同种族和环境暴露会影响结直肠癌的易感性[33],是因为欧洲人和亚洲人饮食文化不同,前者更多的红肉摄食可能是结直肠癌发病的高危因素[34];但是本次研究未能证实该发现,需要更多的研究积累来证实这一差异。
本次meta分析仍存在一些限制。首先,文章中对照组来源不够一致,大部分来自于健康人群外,还有一部分来自于医院病人。其次,本次研究的病例和对照组数量仍然较少,未能具备完全诠释真正内在关系的能力。另外,本次研究采用的12篇文献间存在异质性,除了Ser/Cys 与Ser/Ser 和Ser/Cys + Cys/Cys 与 Ser/Ser间的比较,其他总OR值的计算采用了随机效应模型。最后,由于研究对象详细的信息无法获得(如年龄、性别、吸烟史、饮酒史和生活情况等),我们未经调整的评估结果需要今后的研究来证实。
总之,本次研究通过meta分析表明OGG1 Ser326Cys多态性与结直肠癌发病率无联系,并且OGG1 Ser326Cys多态性在结直肠癌发病中不是一个孤立的风险因素。
[1]Levi F,Pasche C,La Vecchia C,et al.Food groups and colorectal cancer risk[J].Br J Cancer,1999,79(7-8):1283-1287.
[2]Hoeijmakers JH.Genome maintenance mechanisms for preventing cancer[J].Nature,2001,411(6835):366-374.
[3]Wood RD,Mitchell M,Sgouros J,et al.Human DNA repair genes[J].Science,2001,291(5507):1284-1289.
[4]Umar A,Boland CR,Terdiman JP,et al.Revised bethesda guidelines for hereditary nonpolyposis colorectal cancer(Lynchsyndrome)and microsatellite instability[J].J Natl Cancer Inst,2004,96(4):261-268.
[5]Farrington SM,Tenesa A,Barnetson R,et al.Germlinesusceptibility to colorectal cancer due to base-excision repairgene defects[J].Am J Hum Genet,2005,77(1):112-119.
[6]Cheng KC,Cahill DS,Kasai H,et al.8-Hydroxyguanine, an abundant form of oxidative DNA damage,causes G→T and A→C substitutions[J].J Biol Chem,1992,267(1):166-172.
[7]Dherin C,Radicella JP,Dizdaroglu M,et al.Excision of oxidatively damaged DNA bases by the human alpha-hOgg1 protein and the polymorphic alpha-hOgg1(Ser326Cys)protein which is frequently found in human populations[J].Nucleic Acids Res,1999,27(20):4001-4007.
[8]Audebert M,Radicella JP,Dizdaroglu M.Effect of single mutations in the OGG1 gene found in human tumors on the substrate specificity of the Ogg1 protein[J].Nucleic Acids Res,2000,28(14):2672-2678.
[9]Gackowski D,Speina E,Zielinska M,et al.Products of oxidative DNA damage and repair as possible biomarkers of susceptibility to lung cancer[J].Cancer Res,2003,63(16):4899-4902.
[10]Paz-Elizur T,Ben-Yosef R,Elinger D,et al.Reduced repair of the oxidative 8-oxoguanine DNA damage and risk of head and neck cancer[J].Cancer Res,2006,66(24):11683-11689.
[11]Tudek B.Base excision repair modulation as a risk factor for human cancers[J].Mol Aspects Med,2006,28(3-4):258-275.
[12]Kim JI,Park YJ,Kim KH,et al.hOGG1 Ser326Cys polymorphism modifies the significance of the environmental risk factor for colon cancer[J].World J Gastr oenterol,2003,9(5):956-960.
[13]Fearon ER.Human cancer syndromes: clues to the origin and nature of cancer[J].Science,1997,278(5340):1043-1050.
[14]Marnett LJ.Oxyradicals and DNA damage[J].Carcinogenesis,2000,21(3):361-370.
[15]Xing DY,Tan W,Song N,et al.Ser326Cys polymorphism in hOGG1 gene and risk of esophageal cancer in a Chinese population[J].Int J Cancer,2001,95(3):140-143.
[16]Hill JW,Evans MK.Dimerization and opposite basedependent catalytic impairment of polymorphic S326C OGG1 glycosylase[J].Nucleic Acids Res,2006,34(5):1620-1632.
[17]Sidorenko VS,Grollman AP,Jaruga P,et al.Substrate specificity and excision kinetics of natural polymorphic variants and phosphomimetic mutants of human 8-oxoguanine-DNA glycosylase[J].FEBS J,2009,276(18):5149-5162.
[18]Shinmura K,Yokota J.The OGG1 gene encodes a repair enzyme for oxidatively damaged DNA and is involved in human carcin ogenesis[J].An tioxid Red ox Signal,2001,3(4):597-609.
[19]Elahi A,Zheng Z,Park J,et al.The human OGG1 DNA repair enzyme and its association with orolaryngeal cancer risk[J].Carcinogenes,2002,23(7):1229-1234.
[20]Takezaki T,Gao CM,Wu JZ,et al.hOGG1 Ser(326)Cys polymor phism and modification by environmental factors of stomach cancer risk in Chinese[J].Int J Cancer,2002,99(4):624-627.
[21]Kohno T,Kunitoh H,Toyama K,et al.Association of the OGG1-Ser326Cys polymorphism with lung adenocarcinoma risk[J].Cancer Sci,2006,97(8):724-728.
[22]Le Marchand L,Donlon T,Lum-Jones A,et al.Association of the hOGG1 Ser326Cys polymorphism with lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2002,11(4):409-412.
[23]Hansen R,Saebo M,Skjelbred CF,et al.GPX Pro198Leu and OGG1 Ser326Cys polymorphisms and risk of development of colorectal adenomas and colorectal cancer[J].Cancer Lett,2005,229(1):85-91.
[24]Moreno V,Gemignani F,Landi S,et al.Polymorphisms in genes of nucleotide and base excision repair: risk and prognosis of colorectal cancer[J].Clin Cancer Res,2006,12(7Pt1):2101-2108.
[25]Pardini B,Naccarati A,Novotny J,et al.DNA repair genetic polymorphisms and risk of colorectal cancer in the Czech Republic[J].Mutat Res,2008,638(1-2):146-153.
[26]Sliwinski T,Krupa R,Wisniewska-Jarosinska M,et al.Common polymorphisms in the XPD and hOGG1 genes are not associated with the risk of colorectal cancer in a Polish population[J].Tohoku J Exp Med,2009,218(3):185-191.
[27]Handoll HH.Systematic reviews on rehabilitation interventions[J].Arch Phys Med Rehabil,2006,87(6):875.
[28]Higgins JP,T hompson SG,Deek s JJ,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[29]DerSimonian R,Kacker R.Random-effects model for metaanalysis of clinical trials: an update[J].Contemp Clin Trials,2007,28(2):105-114.
[30]Mantel N,Haenszel W.Statistical aspects of the analysis of data from retrospective studies of disease[J].J Natl Cancer Inst,1959,22(4):719-748.
[31]Egger M,Davey Smith G,Schnei der M,et al.Bias in metaanalysis detected by a simple, graphical test[J].BMJ,1997,315(7109):629-634.
[32]Yamane A,Kohno T,Ito K,et al.Differential ability of polymorphic OGG1 proteins to suppress mutagenesis induced by 8-hydroxygua nine in human cell in vivo[J].Carcinogenes,2004,25(9):1689-1694.
[33]Li H,Hao X,Zhang W,et al.The hOGG1 Ser326Cys polymorphism and lung cancer risk: a meta-analysis[J].Cancer Epidemiol Biomarkers Prev,2008,17(7):1739-1745.
[34]Willett WC,Stampfer MJ,Colditz GA,et al.Relation of meat, fat,and fiber intake to the risk of colon cancer in a prospective study among women[J].N Engl J Med,1990,323(24):1664-1672.

