多层纳米金修饰膜的HCG表面等离子体传感器
袁 璐 杨玉琮* 方湘怡 梁晓慧(西安交通大学第一附属医院检验科,西安 70600)
2(西安交通大学理学院实验物理中心,西安 710049)
多层纳米金修饰膜的HCG表面等离子体传感器
袁 璐1杨玉琮1*方湘怡2梁晓慧2
1(西安交通大学第一附属医院检验科,西安 710600)
2(西安交通大学理学院实验物理中心,西安 710049)
探索一种可以高密度固定抗原的新方法,并用于研究多层纳米金修饰金膜表面包被抗原的新型人绒毛膜促性腺激素(HCG)表面等离子体共振(SPR)传感器。3-巯丙基甲基二甲氧基硅烷(MPTMS)与纳米金粒子(AuNPs)可通过Au-S键在传感器金膜表面交替组装形成三维网络,膜表面空间结构中的纳米金经静电作用可吸附大量的小分子抗原HCG,从而获得多层膜修饰的HCG免疫传感器用于检测抗原抗体结合反应。用所构建的HCG传感器,直接检测不同浓度的anti-HCG抗体有良好的线性关系,且修饰两层胶体金膜比修饰一层时抗体响应的共振峰移动幅度提高了1.8倍,检测下限降低至1.5 μg/mL。间接法测定了不同浓度的 HCG,其浓度与 SPR共振峰的位移呈负相关。实验通过修饰两层胶体金膜大大提高了金膜表面固定抗原的量,提高了检测抗体的灵敏度,并且进而用竞争法可检测HCG抗原而不需要用第二抗体进行信号放大。有望用于临床实验诊断。
自组装纳米金;MPTMS法;人绒毛膜促性腺激素;SPR免疫传感器
引言
人绒毛膜促性腺激素(humanchorionic gonadotropin,HCG),是妊娠期间胎盘合体滋养层细胞分泌的一种糖蛋白激素,由两个不同的亚基α、β,以非共价键连接组成。血尿中HCG浓度的测定在临床中具有广泛的应用。包括:诊断早期妊娠、异位妊娠、先兆流产、唐氏综合症的产前筛查、妊娠滋养层疾病(葡萄胎、绒癌等)的诊断和检测等;还可以作为一些肿瘤的标志物(如睾丸癌、胚胎细胞瘤)[1-4]。目前的检测方法主要有免疫放射法、酶联免疫吸附实验(ELISA)、放射免疫分析(RIA)、金标免疫分析(GIA)、微粒子酶免疫分析、化学发光免疫分析法(CLIA)、电化学发光免疫分析、时间分辨免疫荧光分析法(TRFIA)等[5],这些方法检测的结果稳定,特异性灵敏度高,但是都需要标记,需要的标本量大,且操作复杂费时。
表面等离子体共振(surface plasmon resonance SPR)是一种利用金属薄膜的光学耦合产生的物理现象。近年来,SPR技术是一种新兴的生化检测,已经广泛应用于分子间相互作用的检测[6-8]。20世纪60年代,Otto和Kretschmann分别发明了用可见光激发表面等离子体的方法。1982年Nylander等首次将SPR技术用于免疫传感器领域。1983年Liedberg等成功地将SPR用于IgG蛋白与其抗原的反应测定。1990年BiocoreAB公司开发了首台商品化 SPR仪器[9-10]SPR生物传感器具有非破坏性、无需标记、高灵敏度、操作简单和实时在线检测等优点,已经在微生物检测、血液分析、DNA分析、抗原抗体分析、有毒气体检测等方面广泛应用[11-13]。本实验采用SPR技术来研究HCG免疫传感器,以达寻求一种新的简便检测血液中HCG的方法。
免疫传感器的制作基础是抗原或抗体在金膜表面的固定。近年来研究传感器表面固定生物分子的技术越来越多,其中最受欢迎的是利用金巯键固定含巯基的化合物,再通过偶联剂将生物分子以共价键的形式连接于金膜表面[14-18]。但是此类方法的灵敏度有限,要检测更小的生物分子还需要再应用生物素亲和素、纳米金颗粒、酶等标记物进行放大来提高检测的灵敏度[19-22],如Yu等应用 MUA巯基组装的方法制备了SPR免疫传感器芯片用于检测肿瘤标志物AFP,采用双抗夹心法检测的灵敏度不高,作者还利用了第二抗体来提高检测的灵敏度[14]。近几年来,基于纳米金固定抗原抗体的方法越来越受到重视 因其具有良好的生物相容性和强的信号增强效应[23-26],从而在提高检测灵敏度方面取得了一定的进展。如Gan等人研制了多层纳米金修饰的免疫传感器(Au|{HL/AuNPs}n-anti-HCG)[22],使得 HCG 的检测范围变宽(0.1 ~100 mg/L);Chen等人用MPTMS/Nanosilver方法构建了ATP和R6G传感器[27],使 ATP和 R6G的检测下限降低。层层组装是靠2种分子间的作用力交替组装到电极表面形成多层膜,进而在其表面固定探针分子可有效提高固定量。为了提高检测灵敏度,克服固定抗体方向性的限制,本实验研究了一种在传感膜表面高密度固定抗原的新方法。实验通过金膜表面自组装多层纳米金形成空间三维网络结构来固定HCG抗原用于SPR检测。
1 材料和方法
1.1 材料
自行构建的Kretschmann结构波长调制型SPR生物传感器,KQ-100KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司)、KYKY SBC-12型真空离子溅射仪(北京中科科仪技术发展有限责任公司)、人绒毛促性腺激素 HCG标准品(包括几种不同浓度)、抗HCG抗体(50 μg/mL)和抗甲胎蛋白抗体(均由西安交通大学医学院第一附属医院检验科提供)、实验室自制15 nm和50 nm的胶体金溶液、2%MPTMS乙醇溶液、1%NaOH、牛血清蛋白(BSA)、丙酮、TBST溶液、无水乙醇等。实验室所用试剂均为分析纯。所用水均为二次去离子水,所用缓冲液为磷酸盐缓冲液(PBS PH 7.4)。
1.2 方法
1.2.1 SPR生物传感器的原理
实验采用的SPR生物传感器基于Kretschmann-Raether衰减全反射配置,采用固定入射角在一定波长范围(400~700 nm)内对共振波长进行测定。如图1所示,入射光以合适的角度入射到超白玻璃条的一端上,并在玻璃条中不断发生全反射,最后从超白玻璃条的另一端射出来。光线在经过玻璃条表面镀有金膜的区域时,会激发表面等离子波,当入射光和表面等离子体波满足一定条件时就会发生共振,此时便可观察到SPR谱曲线。
工作原理是:通过待测物和固定在传感器芯片上的配体分子特异性反应,引起芯片金膜接触的介质介电常数的变化,折射率的变化引起反射光谱的移动,共振峰的移动值和样品浓度存在对应关系。

图1 SPR传感器系统的原理图Fig,1 Schematic diagram of the established SPR sensor system
1.2.2 传感器芯片的制备
芯片选用稳定性好的金膜作为传感膜,折射率与棱镜相匹配的玻璃片作为基片。基片分别用去离子水、丙酮、无水乙醇、去离子水超声清洗5 min,氮气吹干。将清洗好的基片放入KYKYSBC-12型真空离子溅射仪中,先镀一层铬2 nm厚目的是增强金原子的黏附力而不易脱落,最后在其上镀一层50 nm厚的金膜。
1.2.3 传感片金膜表面多层组装胶体金
实验采用了MPTMS/AuNPs自组装法在金膜表面组装纳米金,其原理如图2所示。
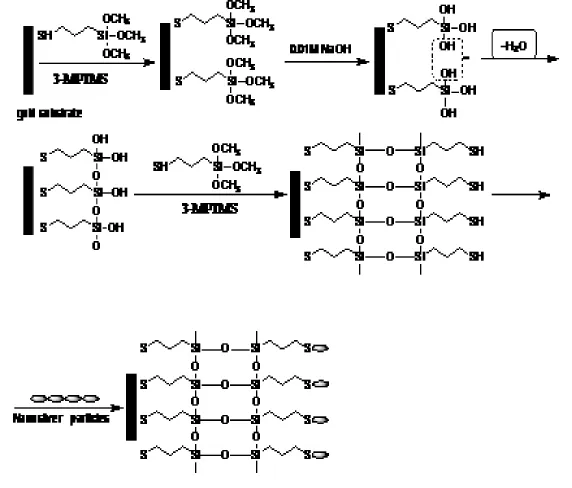
图2 胶体金自组装原理图Fig.2 Schematic showing the fabrication process of gold surface
将镀好的金膜芯片浸入2%MPTMS乙醇溶液中组装12 h,分别用无水乙醇、去离子水清洗后氮气吹干后泡入1%NaOH溶液中2 h,同上方法清洗后氮气吹干再次浸入2%MPTMS乙醇溶液中交替组装12 h,清洗吹干后在金膜上滴加配置好的胶体金溶液,室温放置16 h。至此金膜上组装了第一层纳米金层。如上方法再交替浸泡在MPTMS和NaOH溶液中,可在金膜表面形{MPTMS/AuNPs}多层膜。本实验选用了直径分别为 和 的胶体金溶液。
1.2.4 组装好的传感片上包被HCG抗原
在组装了纳米金的传感片上直接滴加20 μL一定浓度的HCG,室温下保湿放置2 h,用PBS缓冲液清洗3~5遍洗去未吸附的蛋白分子。最后在金膜表面滴加20 μL 1%BSA溶液,室温下放置30 min,目的是将未吸附蛋白的胶体金表面位点封闭。用PBS缓冲液清洗后氮气吹干,得到修饰有人绒毛促性腺激素HCG的传感器芯片Au|{MPTMS/AuNPs}n-HCG。可直接用于检测或者置于4℃冰箱保存备用。
1.2.5 Au|{MPTMS/AuNPs}n-HCG SPR免疫传感器检测不同浓度的anti-HCG抗体
将已经修饰了HCG抗原分子的传感器芯片安置于光路系统中,调节好光路先测定PBS缓冲液中的光谱,以此为初始位置,然后加样。于传感片表面滴加10 μL不同浓度的anti-HCG抗体溶液 37℃温育30 min,使抗原抗体充分反应,然后用 TBST溶液冲洗传感器芯片去除非特异性吸附,然后用PBS缓冲液清洗,在相同的PBS环境下检测并记录SPR光谱图。
1.2.6 检测不同浓度的HCG标准品抗原
首先将10 μL不同浓度的标准品抗原(浓度分别为 5、20、100、200 ng/mL)与一定浓度的 anti-HCG antibody混合后,37℃下温育30 min,然后取混合液10 μL滴加在传感片金膜表面,37℃下温育30 min。反应完全后TBST溶液充分清洗,在PBS缓冲液中测定SPR光谱,抗原抗体结合后其共振峰的位移与标准品的浓度在一定范围内成反比。
1.2.7 传感片的再生
免疫传感器的重要优点之一就是可以反复利用。再生是将一定浓度的酸或碱溶液或者离子试剂破坏抗原抗体间的结合。本实验利用Piranha试剂(98%H2SO4∶30%H2O2=3∶1)混合液,现配现用。清洗时将混合液滴加于金膜表面约5 min,反复2~3次,洗脱掉金膜表面的生物蛋白。
2 结果与讨论
2.1 胶体金在SPR传感器金膜表面的组装及抗原的固定
图3是金膜表面胶体金组装不同阶段的SPR光谱图。在图3中,曲线B和A之间的共振峰位移表示金膜表面介质折射率发生变化,折射率的改变与金膜表面组装的金胶体粒子有关 组装第一层胶体金SPR共振波长移动约17 nm,曲线C和B之间共振峰的移动约10 nm,表示第二层胶体金组装后的共振峰位移。共振波长明显的移动说明金膜表面纳米金颗粒的分布随着修饰层数的增加越来越密集,由SPR光谱图可直接监测到纳米金修饰的过程。曲线D相对于C的位移表示固定了HCG抗原后金膜表面折射率的变化,其共振峰移动幅度越大,则抗原固定量越多。实验中还发现组装两层胶体金吸附一定浓度的抗原后共振峰移动幅度大于组装一层纳米金后固定相同浓度抗原共振峰的移动值,其共振波长移动值分别为12和8。说明组装两层纳米金包被抗原的量大。
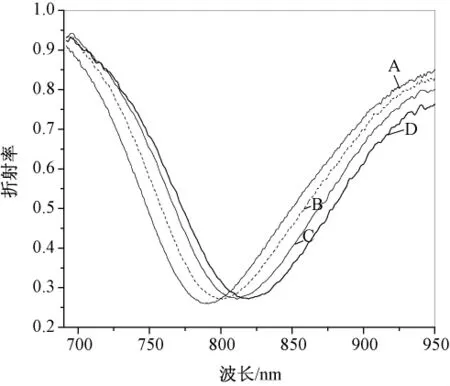
图3 金膜表面不同修饰步骤的SPR光谱图(A:MPTMS自组装;B:组装第一层胶体金;C:组装第二层胶体金;D:人绒毛膜促性腺激素HCG的固定)Fig.3 SPR spectra curvesin every step of modification on gold surface(A:assembly MPTMS;B:the fist layer of nano gold;C:the second layer of gold nano-particles;D:immobilization of the HCG antigen)
图4 为组装一层和两层纳米金时HCG传感膜对不同浓度抗体的SPR响应情况。结果显示,修饰了两层纳米金薄膜的SPR传感器对结合相同浓度抗体的响应幅度大,即检测的灵敏度高。这种组装两层纳米金的方法不仅通过增加传感器膜的表面积来吸附更多抗原,而且通过 MPTMS桥形成一种空间二维结构,使得可以结合抗原的位点显著增加并且更加牢固,从而可以大大提高检测的灵敏度。在实验过程中,分别用15 nm和50 nm胶体金进行组装固定,结果发现选用15 nm胶体金自组装固定HCG抗原的量大。分析可能是50 nm胶体金颗粒体积过大,形成空间二维结构时可以吸附蛋白分子的区域减少。因此本次实验选用修饰两层15 nm胶体金来构建Au|{MPTMS/AuNPs}2-HCG免疫传感器进行检测。

图4 组装一层和两层纳米金的Au|{MPTMS/AuNPs}n-HCG传感器对不同浓度抗体SPR响应值的直方图Fig.4 Histogram of the SPR singal shift responded by diferent Au|{MPTMS/AuNPs}n-HCG sensors after reaction with different concentration of anti-HCG antibody
2.2 不同浓度抗体的检测
采用实验所构建的Au{MPTMS/AuNPs}2-HCG表面等离子体共振免疫传感器,对溶液中不同浓度的anti-HCG直接进行检测,结果示于图5和图6。
在图5(a)中,曲线 B和 A之间的位移表示HCG抗原的固定量;曲线C和B间的位移表示BSA结合在金膜表面的量,用BSA封闭未结合抗原的胶体金表面位点,从而消除检测抗体时的非特异性吸附作用。两条曲线之间的距离越大说明未结合抗原的位点越多,相反若没有移动说明抗原已经将可结合的位点占据满;曲线D相对于 C的位移,表示抗体与传感器金膜表面探针抗原发生了特异性结合,从而使金膜表面折射率改变,SPR共振峰发生相应的移动。如图5(b)所示,制备好的HCG传感器对抗甲胎蛋白抗体没有信号响应,说明该传感器的特异性好。Au|{MPTMS/AuNPs}n-HCG传感器芯片表面固定的抗原密度一定,抗体浓度越大则通过抗原抗体反应共价结合在传感膜表面的抗体的量越多,通过 SPR系统检测到的共振峰移动幅度越大。
不同修饰层数的传感膜检测不同浓度抗体时所对应的的SPR共振峰位移如下面图6所示。两种修饰膜的SPR检测结果均显示,随着抗体浓度的增加,SPR共振峰移动的幅度相应增大,SPR共振峰移动幅度与抗体的浓度变化之间呈近似线性关系;比较一层和两层修饰膜对抗体的SPR响应信号,结果两层修饰膜下各个浓度抗体所检测到的共振峰位移平均是一层修饰膜时的1.8倍,且抗体检测的最低限降至 1.5 μg/mL。

图5 两层纳米金修饰膜的HCG传感器的特异性反应。(a)两层纳米金修饰的Au|{MPTMS/AuNPs}n-HCG传感器对anti-HCG的SPR响应值(A:组装两层纳米金;B:固定HCG抗原;C:BSA封阻;D:抗HCG抗体的结合反应);(b)两层纳米金修饰的HCG传感器对抗甲胎蛋白抗体的SPR响应(A:固定了HCG抗原且BSA封阻后;B:与抗甲胎蛋白抗体反应后)Fig.5 The specific reaction of the two-layer nanoAU modified HCG biosensor.(a)the SPR spectra curve of two-layer Au|{MPTMS/AuNPs}n-HCG biosensor surface responsed to anti-HCG antibody(A:assembly two layers of gold nano-particles;B:immobilization of HCG antigen;C:blocking with BSA;D:incubation with anti-HCG antibody);(b)the SPR spectra curve of two-layer Au|{MPTMS/AuNPs}n-HCG biosensor surface responded to anti-AFP antibody.(A:immobilizing of HCG antigen and blocking with BSA;B:incubation with anti-AFP antibody)
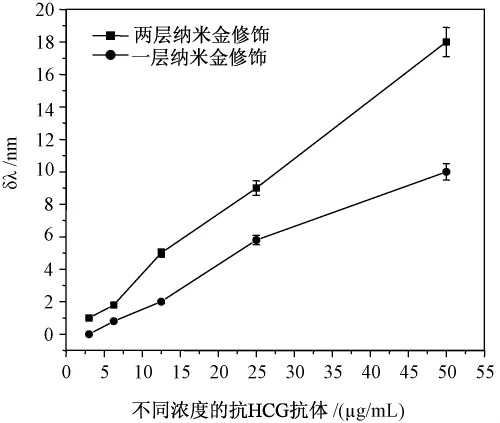
图6 不同修饰层数传感膜anti-HCG antibody浓度与SPR响应值的关系的比较Fig.6 theSPR signalshiftresponded by diferent Au|{MPTMS/AuNPs}n-HCG sensors.for detection varies concentration of anti-HCG antibody
2.3 间接法检测不同浓度标准品HCG
通过将相同体积的4个浓度 HCG标准品(5、20、100、200 ng/mL)与一定量的 anti-HCG抗体混合反应后,再用传感器膜表面的探针分子检测,结果如图7所示,待测的 HCG的浓度越大,SPR检测到的共振峰的移动越小。标准品反应曲线结果表明,SPR共振峰的位移与待测HCG的浓度成反比。因为待测HCG标准品浓度越大,结合的抗体量就越多,从而剩下的可以与探针抗原结合的抗体越少,相应传感器表面可检测到的抗体的SPR共振峰的移动幅度减小。

图7 不同浓度HCG标准品的检测Fig.7 The detection ofdifferentconcentration of HCG
实验过程中,每张传感器芯片可以反复利用多次,如图8所示,曲线B和A之间的距离σλ表示修饰了两层纳米金后固定的抗原量。曲线C表示用piranha液清洗后金表面固定的抗原被洗脱掉,共振峰回到组装了两层纳米金的位置,说明传感膜表面只剩下组装的纳米金层 可以再次用于固定.

图8 传感片的再生(A:组装两层纳米金;B:固定HCG抗原;C:Piranha溶液清洗后)Fig.8 SPR spectra curves of regeneration of sensor chip(A:assembly two layers of nanoparticles;B:immobilized with HCG;C:washing with prianhan solution)
3 结论
本实验利用MPTMS/AuNPs交替修饰的方法成功地在金膜表面组装了两层纳米金,构成的空间三维结构纳米颗粒层,增大了结合蛋白分子的量。胶体金颗粒大大提高了传感器芯片膜的表面积,从而也使得固定蛋白分子的密度大大增加。而且实验中固定了HCG抗原,克服了以往固定抗体时容易阻碍抗原结合位点的问题。本实验运用这种新的组装工艺首次制备了 Au{MPTMS/AuNPs}2-HCG生物传感器芯片,应用于表面等离子体共振(SPR)技术,检测了HCG抗原抗体特异性结合。该传感器明显增加了HCG的固载量,成功的检测出不同抗体的浓度,提高了检测抗体的灵敏度,使得抗体检测下限降低至1.5 μg/mL。并且可用间接法检测出不同浓度的HCG标准品。该生物传感器有望应用于HCG的临床检测中。与传统的检测方法相比,SPR生物传感器有操作简单迅速、无需标记、灵敏度高等优点,在检测生物分子中具有广阔的前景。同时,尚需要不断研究更多的提高灵敏度的方法来提高SPR传感器的检测效率。本次实验为改良SPR传感器制备的技术及检测HCG等小分子抗原提供了新的思路。但是,此次实验仅为新方法研究的初期探索阶段,要应用于临床检测还需要对间接法检测抗原的灵敏度、检测限、抗干扰性等继续研究,需要进行大量的临床标本测试。
[1] 郭娟,聂尚丹,陈廷.в-HCG含量检测在临床诊断中的意义[J].医药论坛杂志,2011,32(1):15 -18.
[2] 孙婷.HCG检测的临床意义[J].实用医技杂志,2007,14(17):2390-2391.
[3] 田丽霞,田志远,刘桂香.血清Free-B-HCG检测的临床意义及评价[J].放射免疫学杂志,2003,16(2):56 -58.
[4] 王小平,李蕾,向阳.人绒毛膜促性腺激素及其临床意义[J].中国妇产科临床,2001,2(1):47 -49.
[5] 杨廷富.人绒毛膜促性腺激素的临床意义及检测进展[J].检验医学与临床,2007,10(4):976 -978.
[6] David Wilson W.Analyzing biomolecular interactions[J].Science,2002,295(15):2013 -2015.
[7] Homola J,Vaisocherová H,Dostálek J,et al.Multi-analyte surface plasmon resonance biosensing[J].Methods,2005,37:26-36.
[8] Alexander S,Lesley S,Russ G.Surface plasmon resonance and its use in biomolecular interaction analysis[J].Current Opinion in Structural Biology,1995,5:699 -705.
[9] Piliarik M,Vaisocherová H,Homola J.Towards parallelized surface plasmons resonance sensor platform for sensitive detection of oligonucleotides[ J].Sensors and Actuators B:Chemical,2007,121(1):187-193.
[10] Liedberg B,Ny lander C,Lundstrom I.Biosensing with surface plasmons resonance-how it all started[J].Biosensors and Bioelectronics,1995,10(8):1 -6.
[11] 徐霞,叶尊忠,吴坚,等.表面等离子体共振免疫传感器在蛋白质检测中的应用及其研究进展[J].分析化学.2010,38(7):1052-1059.
[12] Godoy S,Leca-Bouvier B,Blum LJ.Electrochemiluminescent detection of acetylcholine using acetylcholinesterase immobilized in a biomimetic Langmuir-Blodgett nanostructure[J].Sensors and Actuators B:Chemical,2005,107(1):82 -87.
[13]Homola J,ˇCtyroky J,Skalsky M,et al.A surface plasmon resonance based integrated optical sensor[J]. Sensors and Actuators B:Chemical,1997,39:286 -290.
[14] TeramuraYJ, Iwata H. Label-free immunosensing forafetoprotein in human plasmona using surface plasmon resonance[J].Analytical Biochemistry,2007,365:201 -207.
[15] Peluso P, WilsonDS, DoD, etal. Optimizingantibody immobilization strategies for the construction of protein microarrays[J].Analytical Biochemistry,2003,312:113 - 124.
[16] Hang IN,Herron JN.Orientation of acid-pretreated antibodies on hydrophobic dichlorodimethylsilane-treated silica surfaces[J].Langmuir,1995,11:2083 - 2089.
[17] Lee Y,Lee EK.Cho YW,et al.Protein Chip:a highly sensitive protein micro-arrayprepared bya novelmethod ofprotein immobilization for application of protein-protein interaction studies[J].Proteomics,2003,3:2289 - 2304.
[18] Chen Hongxia, Huang Junyi, Jaebeom Lee, et al. Surface plasmon resonance spectroscopic characterization ofantibodyorientation and activity on the calixarene monolayer[J].Sensors and Actuators B,2010,147:548 -553.
[19] Green RJ, Davies J, Davies MC, et al. Surface plasmon resonance for real-time in situ analysis of protein adsorption to polymer surfaces[J].Biomaterials,1997,18:405 - 413.
[20] Huang YY,Hsu HY,Charles Huang CJ.A protein detection technique by using surface plasmon resonance(SPR)with rolling circle amplification(RCA) and nanogold-modified tags[J].Biosensors and Bioelectronics,2007,22:980 -985.
[21] 姜雄平,许丹科,刘耀清,等.金表面抗原抗体的固定及其荧光法的测定[J].高等学校化学学报,2000,21(11):1664-1666.
[22] Gan Ning,NiMinjun,Zheng Lei, etal. Amperometric immunosensor forhuman chorionic gonadotrophin based on antibody coated nano gold multilayer modified electrode[J].Journal of Xi’An Jiaotong University,2010,44(7):114 - 120.
[23] ChaiRong,Yuan Ruo,ChaiYaqin,etal.Amperometric immunosensors based on layer-by-layer assembly of gold nanoparticles and methylene blue on thiourea modified glassy carbon electrode for determination of human chorionic gonadotrophin[J].Talanta,2008,74(5):1330 - 1336.
[24] Idegami K,Chikae M,Kerman K.Gold nanoparticle-based redox signalenhancementforsensitive detection ofhuman chorionic gonadotropin hormone[J].Electroanalysis,2008,20(1):14-21.
[25] Jia JB,Wang BQ,Wu AG,et al.A method to construct a thirdgeneration horseradish peroxidase biosensor:self-assembling gold nanoparticles to three-dimensional sol-gel network[J].Anal Chem,2002,74:2217 -2223.
[26] Xia Zhong,Yuan Ruo,Chai Yaqin,et al.Glucosebiosensor based on self-assembled gold nanoparticles and double-layer 2dnetwork(3-mercaptopropyl)-trimethoxysilanepolymer onto gold substrate[J].Sensors and Actuators B,2005,104:191 -198.
[27] Chen Hongjun,Wang Yuling,Dong Shaojun,et al.An approach for fabricating self-assembled monolayer of Ag nanoparticles on gold as the SERS-active substrate[J].Spectrochimica Acta Part A,2006,64:343-348.
Surface Plasmon Resonance Based Immunosensor for Human Chorionic Gonadotropin Using Nano Gold Modified Substrate
YUAN Lu1YANG Yu-Cong1*FANG Xiang-Yi2LIANG Xiao-Hui2
1(Department of Clinical Laboratories,The First Hospital Affiliated to Xi’an Jiaotong University,Xi’an 710600,China)
2(Experimental Physics Center,School of Science,Xi’an Jiaotong University,Xi’an 710049,China)
To explore a new method of immobilizing human chorionic gonadotropin(HCG)antigen on gold surface with high density and develop a new type of surface plasmon resonance(SPR)-based immunoassay sensor modified with multilayer gold nanoparticles coated HCG antigen.Multilayer gold nanoparticles were assembled through Au-S binding on the gold surface to form a 3D-network structure,which can immobilize HCG antigen efficiently by electrostatic adsorption.Different concentration of anti-HCG antibody and HCG were detected by SPR system.The SPR signal shift was linearly related to the concentration of anti-HCG antibody.The SPR resonance wavelength shifted produced by two layers of gold nanoparticles was 1.8 times as a layer one after reaction with anti-HCG antibody.The detection limit was down to 1.5 ug/ml.The HCG antigen has been tested using inhibition assay and the SPR signal shift was negatively related to the HCG concentration.Multilayer assembly is an efficient method to immobilize much more HCG antigen to improve the detecting sensitivity.The concentration of anti-HCG antibody could be detected directly,and HCG antigen could be detected indirectly by this biosensor chip,which was simple,dynamic and did not need secondary antibody.The method was expected to be applied in clinical diagnostics.
self-assembly gold nanoparticles; MPTMS; human chorionic gonadotropin,HCG; SPR immunoassay sensor
R318
A
0258-8021(2012)05-0748-07
10.3969/j.issn.0258-8021.2012.05.015
2012-05-16,录用日期:2012-06-08,
* 通信作者。E-mail:yyc1103@mail.xjtu.edu.cn

