竞争酶联免疫法测定食品中鸡蛋过敏原
张世伟 赖心田 洪晓明 王珍妮 李锐 杨国武
(深圳市计量质量检测研究院 广东深圳 518000)
1 前言
食品过敏是人们对食品产生的一种变态反应,在临床上表现为荨麻疹、哮喘、腹痛和腹泻等多种症状,严重的可导致休克[1]。据统计全世界有0.5% -2.5%的儿童对鸡蛋过敏,其中鸡蛋导致的食物过敏发生率位居第二[2]。加工蛋制品仍然具有致敏性,有文献证实,蛋类过敏原分别经糖基化处理、6mol/L尿素处理、95℃加热处理后仍不能完全脱敏[3]。目前,对鸡蛋过敏原的检测普遍采用以鸡蛋中的主要致敏蛋白——卵白蛋白为检测对象建立的双抗夹心ELISA法。但在检测工作中,笔者发现,双抗夹心ELISA不能准确识别热处理的蛋制品,检测高温烘焙或煎炸的含蛋制品容易发生假阴性。据报道,主要原因在于目标蛋白在加热过程中发生了降解,导致双抗夹心ELISA中的两个抗体无法同时结合抗原[4]。而竞争ELISA中需要使用一个抗体,无论抗原是否发生了变性和降解,只要和抗体对应的抗原决定簇不发生变化,就能被抗体所识别,很好的克服了双抗夹心ELISA的缺点。
2 材料与方法
2.1 材料
2.1.1 试剂
酪蛋白、二甲基亚砜(DMSO)、四氢呋喃(DMF)、四甲基联苯胺(TMB)、福氏完全佐剂及福氏不完全佐剂、辣根过氧化物酶、卵白蛋白、牛血清白蛋白、溶菌酶、麦醇溶蛋白、大豆球蛋白购于Sigma公司;醛基活化的辣根过氧化物酶、脱盐离心柱购于Thermo公司;其余试剂为国产分析纯;BALB/c小鼠A购自中山大学医学院动物中心;ELISA反应检测用试液配制参考文献[5]。
2.1.2 仪器
超声破碎仪为Uibracell VCX750购于Sonics and Materials公司,酶标仪为ELX808购于Biotek公司以及高速离心机、精密电子天平等常规仪。
2.2 方法
2.2.1 抗体的制备
将沸水浴处理30min的1mg/mL的卵白蛋白溶液免疫BALB/c小鼠,每只剂量0.1mL。单克隆抗体制备方法参考冷泉港实验室手册的方法进行[6],使用硫酸铵沉淀法纯化抗体[7]。
2.2.2 酶标抗体的制备
使用辣根过氧化物酶分别标记抗体。将0.3mg纯化的抗体溶解于0.1mol/L pH9.5的碳酸盐缓冲液中。加入0.1mL 10mg/mL的活化醛基的辣根过氧化物酶溶液后4°C反应过夜。加入 30μL 0.2 mol/L的赖氨酸终止反应,透析纯化后备用。
2.2.3 竞争ELISA操作
每孔加卵白蛋白100μL 4℃孵育过夜。第2天倒掉包被液,用洗涤液洗一遍,每孔再加200μL封闭液,37℃孵育3 h,倒掉封闭液。每孔加50μL酶标单克隆抗体和50μL样品(或为卵白蛋白标准溶液以及沸水浴处理30min的卵白蛋白标准溶液),阴性对照孔用 PBS代替。37℃反应0.5h,完后用PBST洗3次。加底物液,37℃反应10 min,H2SO4终止反应后上酶标仪读数。以卵白蛋白浓度为横坐标,B/B0为纵坐标绘制标准曲线(B为样品或标准品的吸光度值,B0为空白溶液的吸光度值)。使用Origin 7.5四参数拟合计算标准曲线的IC50。同时,采用棋盘法试验优化包被抗原和酶标抗体的最佳稀释倍数。
2.2.4 ELISA 检测抗体特异性
采用其他食品中常见的蛋白作考察对象,采用竞争ELISA检测抗体与其之间的交叉反应。
2.2.5 检测食品样品的前处理
采用含0.5%二硫苏糖醇的7M尿素作为样抽提液体提取其中的蛋白成分。称取5g均质食品样品,使用样品提取液定容至 100mL。超声提取10min后离心,取0.5mL上清液使用脱盐离心柱脱盐后用于ELISA分析。
2.2.6 添加回收率的测定
将0.02g卵白蛋白溶于100mL含有1%NaHCO3的蒸馏水后再加入至100g面粉中,搅拌均匀,模拟烘烤产品制作工艺160℃烘烤30min,以及煎炸产品制作工艺250℃烘烤15min,与未热处理前的样品做对照,计算添加回收率和RSD。
3 结果与分析
3.1 ELSIA对热处理卵白蛋白的识别
分别做出热处理和未经热处理的卵白蛋白标准溶液的ELISA标准曲线,通过计算曲线的IC50进行比较。由图1可知,热处理后的卵白蛋白和抗体的结合力不但未降低,反而有所提高。这可能在于热处理后蛋白的二级结构被破坏,使得与该抗体结合的抗原决定簇更好的暴露。热处理和非热处理卵白蛋白标准曲线的IC50分别为11.8μg/mL和14.9μg/mL。所以,本研究建立的检测方法对长时间热加工的蛋制品仍然适用。由于食品中的卵白蛋白均经过热处理过程,所以本方法采用热处理30min后的卵白蛋白溶液作为方法的标准溶液,线性范围为0.8 -80μg/mL(R2>0.99)。
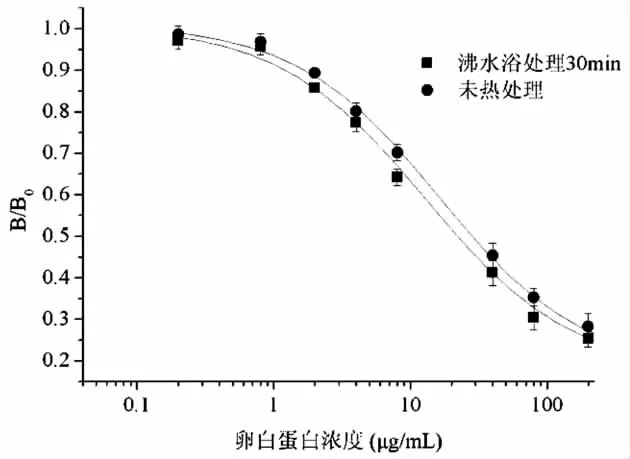
图1 卵白蛋白竞争ELISA标准曲线
3.2 抗体的交叉反应
采用ELISA方法评估抗体对几种食品中常见蛋白和干扰物的交叉反应。由表1可知,该方法特异性良好,对食品几种常见的蛋白、干扰物无交叉反应,不易出现结果误判。
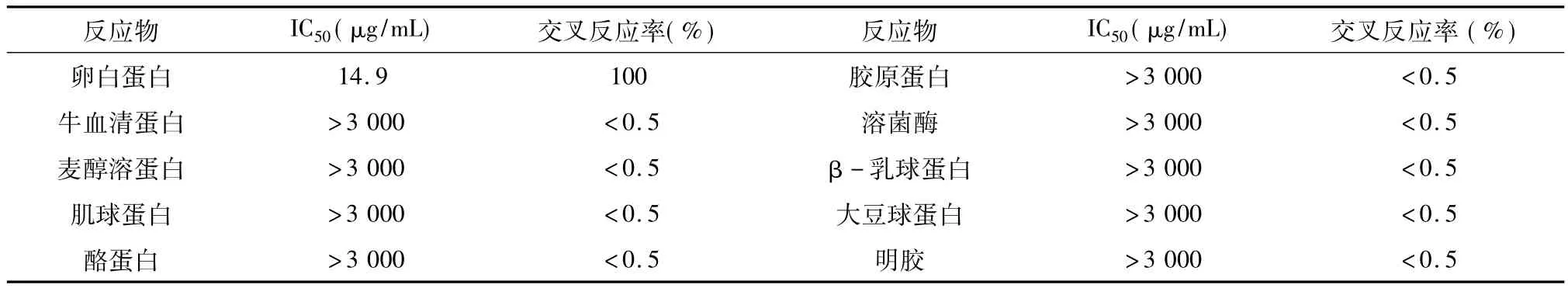
表1 与各蛋白的交叉反应率
3.3 方法的检出限和添加回收率
以阴性面制品(馒头以及未添加卵白蛋白的模拟烘烤产品)的测定值加3倍标准差计算样品的最低检出限计算出本方法检测食品中卵白蛋白的检出限为20μg/mL。对模拟蛋制品的添加回收结果见表 2,未经加热,160℃ 烘烤 30min,230℃ 烘烤10min的产品添加回收率分别为94.3%,53.2%, 41.1%,RSD<15%。

表2 不同热加工样品的添加回收率(n=6)
3.4 ELISA法测定市售样品中卵白蛋白含量
对4个标识有鸡蛋成分的阳性样品和4个阴性样品进行卵白蛋白的定量检测。如表3所示,检测结果和标签标注的情况相符。6个平行样的相对标准偏差RSD<10%,说明该方法检测实际样品稳定可靠,牛奶、猪肉、酱油、葡萄酒中的色素,脂肪,盐分,杂蛋白等均不会对本方法形成干扰。

表3 样品中卵白蛋白含量(n=6)
4 讨论
食品中过敏原种类多样,即使是蛋、奶这类成分较为简单的食品原料也含有多个致敏蛋白。目前,过敏原的检测往往选取食品原料中热稳定且高含量的致敏蛋白作为检测对象。但Fu发现鸡蛋中的致敏蛋白热稳定性普遍不理想。其比较了3个品牌的商品化试剂盒,无论采用卵白蛋白还是卵粘蛋白作为目标检测物,传统的双抗夹心ELISA都无法对热处理后的蛋白做出准确的识别。全蛋粉样品经232℃处理10 min后,最高的回收率也只能达到1%。而本研究建立的竞争ELISA,通过细胞筛选,得到针对热稳定抗原决定簇的抗体,该决定簇不会随蛋白的变性或降解发生改变。由于竞争ELISA只需要一种抗体参与反应,反应时间比双抗夹心ELISA更短,操作也更为简便。沸水浴处理30min的卵白蛋白竞争标准曲线未发生明显的改变。为了更真实的反应卵白蛋白在实际样品热加工过程中的变化,本研究通过将卵白蛋白加入至食品原料中再进行模拟加工的方法进行添加回收率实验。230℃热处理10min的面制品样品的回收率为41%,大大高于Fu用商品化试剂盒报道的回收率[4]。理论上,由于热处理对本研究建立的竞争ELISA的影响并不大,热处理对回收率不应该有明显的下降。但实际上热烘焙的过程让面粉中的蛋白发生变性,淀粉发生糊化、老化、脱水等变化,使目标蛋白的提取更加困难,导致了回收率的下降。
食品过敏原不同于兽药残留、毒素等风险物质,在食品中往往是常量存在,ppm级的检出限足以满足检测要求,其发展方向在于缩短检测时间,降低假阴性率。本研究建立的竞争ELISA法采用辣根过氧化物酶标记的单克隆抗体,不需使用二抗,节约了检测时间,为预防蛋制品过敏的发生提供了有效的检测手段,并为制定我国食品过敏原标签管理奠定了一定的技术基础。
[1] Hattevig G,Kjellman B,Bjorksten B.Clinical symptoms and IgE responses to common food proteins and inhalants in the first 7 years of life[J].Clinical Allergy,1987,17:571 - 578.
[2] Tey D,Heine R G.Egg allergy in childhood:an update[J].Current Opinion in Allergy and Clinical Immunology,2009,9(3):244-250.
[3] Mine Y,Zhang J W.Comparative studies on antigenicity and allergenicity of native and denatured egg white proteins[J].Journal of Agricultural and Food Chemistry,2002,50:2679-2683.
[4] Fu T J,Maks N,Banszewski K.Effect of heat treatment on the quantitative detection of egg protein residues by commercial enzyme- linked immunosorbent assay test kits[J].Journal of Agricultural and Food Chemistry,2010,58:4831-4838.
[5] 韩丹,于梦,吴梅,等.酶联免疫吸附分析法测定食品中的苏丹红Ⅰ号[J].分析化学,2007,35(8):1168-1170.
[6] Harlow E,Lane D.Antibodies:A Laboratory Manual[M].Cold Spring Harbor Laboratory Press,Cold Spring Harbor Laboratory Press,New York,1988:139 -242.
[7] Wengatz I,Stoutamire D,Gee SJ,et al.Development of an enzymelinked immunosorbent assay for the detection of the pyrethroid insecticide fenpropathrin[J].Journal of Agricultural and Food Chemistry,1998,46:2211-2221.

