高效液相色谱法测定硫酸长春新碱的有关物质
李 华 ,龙亚秋 ,罗超华 ,杨 芳
(1.南方医科大学南方医院,广东 广州 510515; 2.广州中医药大学第二附属医院,广东 广州 510120;3.南方医科大学中医药学院,广东 广州 510515)
硫酸长春新碱为抗肿瘤类原料药,中国药典中其有关物质测定采用高效液相色谱法[1]。由于产品工艺中的起始原料发生变更,可能带入新杂质,为此笔者参阅欧洲药典(EP 7.0版)和美国药典(USP 34版),对中国药典所述有关物质的测定方法进行了验证。现报道如下。
1 仪器与试药
岛津LC-20A型高效液相色谱仪,LC Solution色谱工作站;Sartorius-BP210型电子天平。硫酸长春新碱对照品、硫酸长春碱对照品(中国药品生物制品检定所,批号为100130-200502);硫酸长春新碱原料药(广州绿叶化工有限公司,批号为100701,100702,100703);甲醇为色谱纯,水为纯化水,其余均为分析纯。
2 方法和结果
2.1 色谱条件
色谱柱:Shiseido C8柱(250 mm ×4.6 mm,5 μm);流动相:取二乙胺15 mL,加水985 mL,用磷酸调pH至7.5,作为流动相A,甲醇为流动相B,进行梯度洗脱(0~12 min时A体积分数为38%,12~27 min时A体积分数由38%线性变化至8%,27~29 min时,A体积分数由8%线性变化至38%,29~34 min时维持A体积分数为38%);检测波长:297 nm;柱温:30℃;流速:1.5 mL/min。
2.2 溶液制备
取本品,精密称定,加水溶解并稀释制成每1 mL中约含1 mg的溶液,作为高浓度供试品溶液;精密量取1 mL,置25 mL量瓶中,用水稀释至刻度,摇匀,作为低浓度供试品溶液。取硫酸长春新碱及硫酸长春碱对照品适量,用水溶解并稀释制成每1 mL分别含有1 mg的混合溶液,作为系统适用性溶液。
2.3 方法学考察
系统适用性试验:在拟订的色谱条件下,精密吸取系统适用性溶液20 μL,注入液相色谱仪。结果硫酸长春新碱的保留时间约为15 min,硫酸长春碱峰与硫酸长春新碱峰的分离度应大于4.0,见图 1。
专属性试验:取水(溶剂空白)20 μL 进样,记录色谱图,结果表明溶剂对杂质测定无干扰。取系统适用性溶液和高浓度供试品溶液各20 μL进样,记录色谱图,结果硫酸长春碱峰与硫酸长春新碱主峰之间的分离度大于4.0,硫酸长春新碱峰与相邻各杂质峰之间的分离度均大于1.5(见表 1 和表 2、图 1),表明方法的专属性较好。
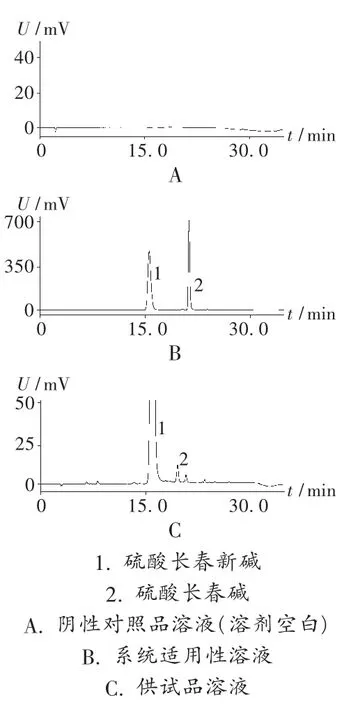
图1 高效液相色谱图

表1 已知物质的分离度测试
线性关系考察:取硫酸长春碱对照品约25 mg,精密称定,用水溶解并稀释至质量浓度为0.1 g/L,作为标准贮备液A;精密吸取标准贮备液A 1 mL,用水稀释至10 mL,质量浓度0.01 g/L,作为标准贮备液B。取硫酸长春新碱样品约0.1 g,精密称定,置10 mL容量瓶中,用水稀释至刻度,混合均匀,质量浓度约为10 g/L,作为标准贮备液 C。分别精密吸取标准贮备液 B 0.5,1.0,5.0 mL 和标准贮备液 A 1,2,4,5 mL,各置 10 mL 容量瓶中,精密吸取1 mL,用水稀释至刻度,混合均匀,得到编号1-7的标准溶液。取1.0 mL标准贮备液C,置10 mL量瓶中,加水稀释至刻度,摇匀,作为高浓度样品溶液;取1.0 mL高浓度样品溶液,置25 mL量瓶中,加水稀释至刻度,摇匀,作为低浓度样品溶液。取编号1-7的标准溶液,分别进样,每个质量浓度连续进样3次。以硫酸长春碱为代表杂质,其实际质量浓度在 0.510 ~51.04 μg/mL,(相当于0.05% ~5.0%)范围内与峰面积呈良好的线性关系,线性回归方程为 Y=0.000 01 X -0.147 5,r=0.999 98。

表2 样品存在杂质的分离度测试
精密度试验:分别取硫酸长春碱、硫酸长春新碱对照品溶液,重复进样6次。结果峰面积的 RSD硫酸长春碱为0.20%(n=6),硫酸长春新碱为 0.11%(n=6),均小于 2.0% ,表明方法精密度高。
重复性试验:取同一份样品共6份,依法测定。结果峰面积的RSD硫酸长春碱为0.24%(n=6),硫酸长春新碱为0.14%(n=6),均小于2.0%,表明方法重复性良好。
加样回收试验:称取已知含量的的原料药6份,分别精密加入对照品适量,依法制备溶液并测定含量,计算回收率。结果见表3。硫酸长春新碱的回收率均在98.0% ~102.0%范围内,符合要求。
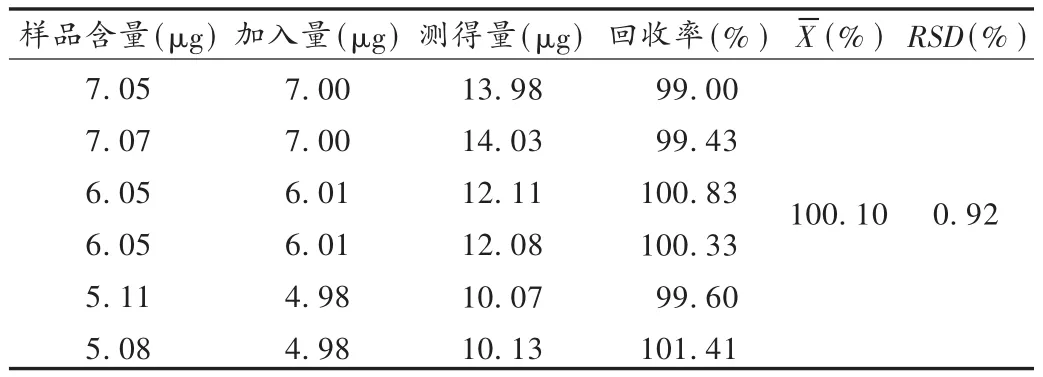
表3 硫酸长春新碱加样回收试验结果(n=6)
检测限及定量限确定:该方法的定量限和检测限以硫酸长春碱作为杂质进行评估。取线性关系考察项下编号1和2的标准溶液逐步稀释,分别进样,记录色谱图。当待测组分的信噪比为2~3倍,对应该组分的最小检测质量浓度为0.51 μg/mL,相当于0.05%;当信噪比10~20倍时,对应该组分的最小定量质量浓度为 1.02 μg/mL,相当于 0.1%。结果表明,该方法的灵敏度足以用于硫酸长春新碱杂质的检测。
稳定性试验:取同一样品,依法制备供试品溶液,于2,4,8,12,24 h时分别进样。结果硫酸长春碱与硫酸长春新碱峰面积响应值的 RSD分别为0.35%和0.17%(n=5),表明该方法所用溶液稳定性良好。
可变参数耐用性试验:取系统适用性溶液(含有硫酸长春新碱及其主要杂质硫酸长春碱),除可变的条件外,其他参数均与常规分析条件一致,依法进样,记录色谱图。结果见表4。可见,对流动相比例、柱温、流速、流动相pH作一定程度的改变时,均可维持硫酸长春碱与硫酸长春新碱分离度大于4的系统适用性要求,表明方法的耐用性较好。
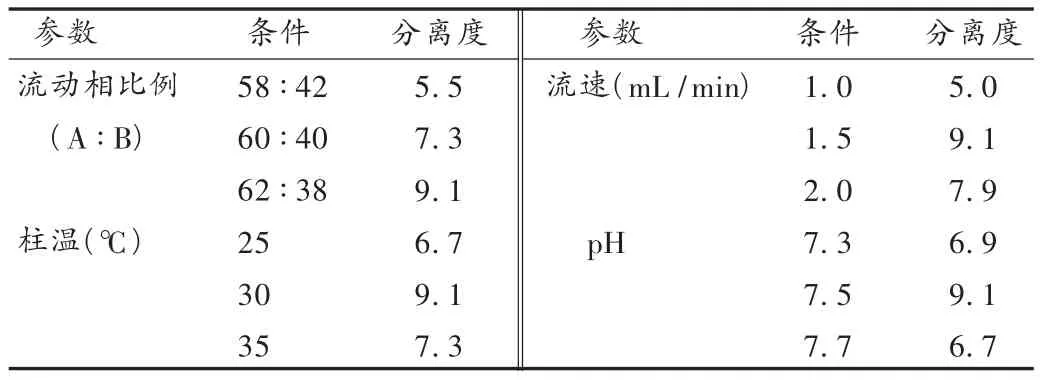
表4 耐用性试验结果
2.4 样品有关物质测定
取起始原料变更前后的3批样品,按2.2项下方法制备供试品溶液,在拟订的色谱条件下进行分析,记录色谱图,按自身对照法以峰面积计算杂质含量。结果见表5。可见,起始原料变更后无新杂质产生,原有杂质含量比起始原料变更前杂质含量有所降低。
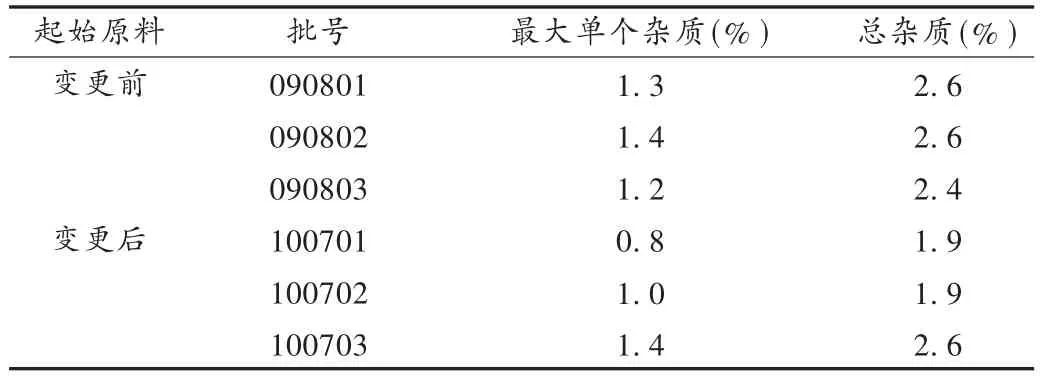
表5 硫酸长春新碱的有关物质含量测定结果
3 讨论
本试验针对硫酸长春新碱原料药的起始物料来源发生变更,按现行版药典的要求,对中国药典收载的硫酸长春新碱有关物质检测方法进行了详尽而全面的方法学考察,重点考察专属性与耐用性。结果表明,该方法专属性、重复性良好,方法准确,检测灵敏度高,耐用性好,可用于起始原料变更后的产品有关物质检测。
在专属性考察中,除关注已知杂质硫酸长春碱与主分硫酸长春新碱的分离情况,更特别关注样品中实际存在的杂质与主成分的分离度,试验结果符合测定要求。此外,还从溶液稳定性、流动相比例、温度、流速和pH等几个方面考察了方法的耐用性,测定结果令人满意。通过方法学考察,为该产品杂质质量控制方法的可靠性和适用性提供了充分的实验依据。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:953-954.

