哮喘大鼠TLR1、FasL和TRAF2表达及甲基强的松龙干预作用
江德富 浙江省温岭市第二人民医院 台州 317500
童夏生 浙江省台州市中西医结合医院 罗冬娇 亢晓冬 杭州师范大学钱江学院
叶 辉 浙江省台州市第一人民医院 范广民 陈 琪 浙江省台州市中心医院
哮喘大鼠TLR1、FasL和TRAF2表达及甲基强的松龙干预作用
江德富 浙江省温岭市第二人民医院 台州 317500
童夏生 浙江省台州市中西医结合医院 罗冬娇 亢晓冬 杭州师范大学钱江学院
叶 辉 浙江省台州市第一人民医院 范广民 陈 琪 浙江省台州市中心医院
目的:探讨TLR1、FasL和TRAF2在大鼠哮喘炎症机制中的作用,观察甲基强的松龙对其表达的影响。方法:27只SD大鼠,随机分成哮喘模型组、正常对照组和甲基强的松龙组,每组9只,采用流式细胞术检测血淋巴细胞TLR1和FasL表达,免疫组织化学法检测肺组织TRAF2表达。结果:哮喘组血淋巴细胞TLR1表达水平显著低于甲基强的松龙组(P<0.05),正常对照组血淋巴细胞TLR1表达水平分别与哮喘组及甲基强的松龙组比较,差异无统计学意义(P均>0.05)。哮喘组和甲基强的松龙组血淋巴细胞FasL表达水平均显著高于正常对照组(P均<0.05),而哮喘组血淋巴细胞FasL表达水平与甲基强的松龙组比较差异无统计学意义(P>0.05)。哮喘组TRAF2光密度值显著高于正常对照组和甲基强的松龙组(P均<0.01),甲基强的松龙组TRAF2光密度值与正常对照组比较,差异无统计学意义(P>0.05)。结论:哮喘模型大鼠FasL和TRAF2表达增加,而TLR1无变化;甲基强的松龙能下调TRAF2和提升TLR1水平,从而起到抗炎作用。
大鼠 哮喘 TLR1 FasL TRAF2 肿瘤坏死因子受体相关因子 糖皮质激素
炎症细胞和炎症因子在哮喘的发病机制中起着非常重要的作用,尤其是淋巴细胞在调节Th1/Th2平衡中起了决定性作用[1]。Toll样受体(TLR)是联系天然免疫与获得性免疫的重要分子,其信号系统可能通过诱导产生Th1和(或)Th2型细胞因子从而参与哮喘的炎症过程。FasL是Fas的天然配体,参与细胞凋亡信号转导。故研究TLR和FasL在淋巴细胞上的表达,对进一步探讨淋巴细胞在哮喘炎症机制中的作用有着深远意义。肿瘤坏死因子受体相关因子(tumornecrosisfactorreceptorassociated factor,TRAF)是TNF超家族成员之一,不仅能增强TNFR诱导的炎症因子的产生,增强TNFR1-TNFR2的协同作用[2],还与炎症细胞的分化有关[3],介导机体自然免疫和获得性免疫。最近发现,TRAF1还与Th1/Th2平衡有关,它能抑制Th2炎性反应[4]。但TRAF2在哮喘发病机制中的作用如何,目前知之甚少。本研究通过观察哮喘大鼠TLR1、FasL和TRAF2的表达及甲基强的松龙对其影响,探讨其在哮喘发病中的可能作用机制,为哮喘的治疗提供理论依据。
1 材料与方法
1.1 主要试剂 鸡卵白蛋白(OVA)Ⅴ级购自美国Sigma公司,小鼠抗大鼠TRAF2多克隆抗体购自美国Santa Cruz公司,兔抗大鼠TLR1-FITC和FasL-FITC抗体均购自上海研吉生物科技有限公司。即用型SP系列检测试剂盒(其中试剂B:生物素标记二抗工作液选用SP-9000)及DAB显色剂(ZLI-9018)均购自北京中山生物有限公司。
1.2 实验动物及分组 清洁级健康雄性SD大鼠27只,4~5周龄,体质量(121±7)g,由上海斯莱克实验动物有限责任公司提供[许可证号:SCXK(沪)2007-0005],在杭州师范大学实验动物中心清洁级环境中饲养,室温20~25℃,湿度40%~60%,自主饮水、进食。随机分成哮喘组、正常对照组、甲基强的松龙组,每组9只。
1.3 动物模型复制[5]第1天和第8天腹腔注射OVA/Al(OH)3混合液2mL[含OVA 1mg和Al(OH)3100mg]致敏,各1次。第15天开始每天向大鼠喷雾(空气压缩雾化器:PARI BOY-037G6000 GERMANY)1%OVA 30min,连续激发7天。表现为烦躁不安、搔痒、喘鸣、腹肌抽搐等症状。对照组致敏和激发均以生理盐水替代OVA和Al(OH)3。甲基强的松龙组处理基本同哮喘组,但在每次抗原激发前30min给予腹腔注射甲基强的松龙4mg/只(辉瑞公司生产,批号X02247)。
1.4 血和肺组织标本制备 末次激发24h后,10%水合氯醛(400mg/kg)大鼠腹腔注射麻醉,心脏抽血1mL(EDTA抗凝)待检TLR1和FasL。取右内侧带肺组织,4%多聚甲醛-PBS溶液固定,常规石蜡包埋、切片,采用免疫组化SP法测定TRAF2的表达。
1.5 血淋巴细胞TLR1、FasL的表达 采用流式细胞术检测,操作步骤:分别取EDTA抗凝全血100μL,加入2个试管,各自分别加入10μL TLR1-FITC 或10μL FasL-FITC、室温下避光孵育20min,加入红细胞裂解液1mL,室温避光放置15~20min,振荡混匀,1500r/min离心5min,弃上清,用2mL PBS洗涤1次,加入400μL PBS重新浮悬细胞,上流式细胞仪检测。流式细胞仪测定:流式细胞仪经常规校正,FLOW CHECK cv值<2,根据前向散射光(FS)和侧向散射光(SS)以淋巴细胞群设门,分别测定TLR1-FITC和FasL-FITC占的平均荧光强度(mean fluorescence intensity,MFI)。并收集10 000个细胞,同时设阴性对照。
1.6 免疫组化结果判定 光镜下观察细胞着色情况,蛋白定位于细胞胞浆内,阳性细胞胞浆呈棕黄色表达,结构清晰,着色明显高于背景。每张切片随机选择5个细支气管,Image-pro Plus 5.1免疫组化图像分析系统对阳性细胞进行灰度扫描,取其平均值代表该片的光密度值(OD值)。
2 结 果
2.1 各组血淋巴细胞TLR1表达 哮喘组血淋巴细胞TLR1表达水平显著低于甲基强的松龙组(P<0.05),正常对照组血淋巴细胞TLR1表达水平与哮喘组及甲基强的松龙组比较,差异无统计学意义(均P>0.05),见表1、图1。
表1 各组血淋巴细胞TLR1和FasL表达水平(±s)

表1 各组血淋巴细胞TLR1和FasL表达水平(±s)
注:与对照组比较,*P<0.05;与哮喘组比较,△P<0.05
n/只TLR1(MFI)FasL(MFI)组 别8 8 7 49.23±4.06 47.58±1.46 52.89±3.92△11.73±1.39 15.52±0.53*14.46±2.19*正常对照组哮喘组甲基强的松龙组
2.2 血淋巴细胞FasL表达水平 哮喘组和甲基强的松龙组血淋巴细胞FasL表达水平均显著高于正常对照组(P均<0.05),而哮喘组血淋巴细胞FasL表达水平与甲基强的松龙组比较,差异无统计学意义(P>0.05),见表1、图2。
2.3 肺组织TRAF2表达 免疫组化结果显示,阳性细胞的胞浆呈棕黄色表达,主要表达于气道上皮细胞和炎症细胞等,而肺组织中却较少表达。哮喘组TRAF2光密度值显著高于对照组和甲基强的松龙组(P均<0.01),甲基强的松龙组TRAF2光密度值与对照组比较,差异无统计学意义(P>0.05),表2、图3。
表2 各组肺组织TRAF2表达水平(±s)
表2 各组肺组织TRAF2表达水平(±s)
注:与对照组比较,*P<0.01;与哮喘组比较,△P<0.01
n/只9 9 8 TRAF2(OD值)0.220±0.057 0.317±0.041*0.235±0.028△组 别对照组哮喘组甲基强的松龙组
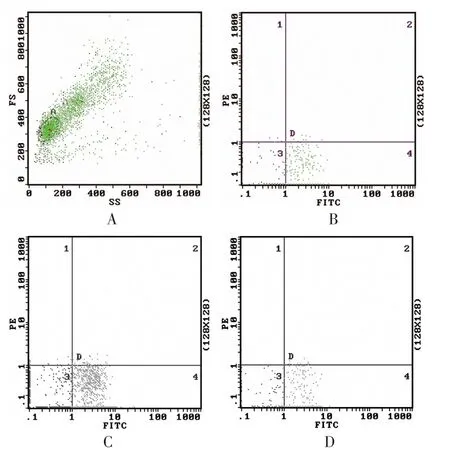
图1 流式细胞术显示血淋巴细胞TLR1的散点图
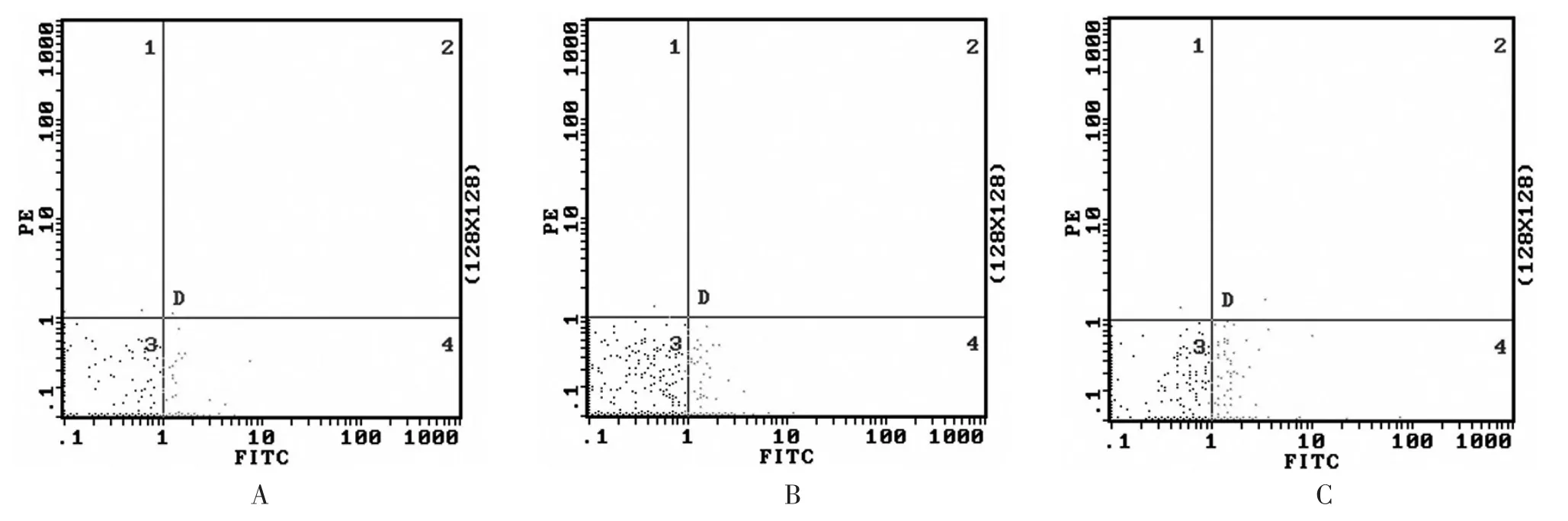
图2 流式细胞术显示血淋巴细胞FasL的散点图
3 讨论
哮喘的病因和发病机制一直是研究的热点,TLR是新近发现的先天性免疫的病原模式识别受体,识别自身和异体抗原,介导多种免疫细胞,激活炎症因子,调节炎症反应[6]。TLR在慢性炎症的发生和发展中起重要作用,它介导的炎症因子、细胞因子可导致哮喘气道重塑[7]。在哮喘发病的“卫生假说”机制中起着重要的作用,不管是先前的“卫生假说”和新的“卫生假说”,都认为环境因素通过TLR影响着哮喘的发病。本研究发现,哮喘组血淋巴细胞TLR1的表达水平与对照组相近,提示TLR1可能不需要通过OVA诱导途经激发;而甲基强的松龙能显著提升TLR1的表达水平,提示甲基强的松龙的抗炎作用可能部分通过上调TLR1起作用。相似的研究也发现,OVA诱导的哮喘大鼠模型中,TLR4在哮喘组和对照组中无差别,而地塞米松可提升TLR4的表达[8],支持糖皮质激素可能通过TLR起到抗炎的作用的论点。

图3 肺组织TRAF2的表达,阳性细胞的胞浆呈棕黄色表达,主要表达于气道上皮细胞等(SP×200)
FasL属于肿瘤坏死因子/神经生长因子超家族成员,在体内主要以膜结合形式存在,是一种Ⅱ型跨膜蛋白。FasL与细胞表面的Fas结合,可诱导表达Fas的靶细胞凋亡[9]。淋巴细胞通过此途径,杀伤表达Fas的靶细胞。正常的Fas系统能有效地去除过度激活的免疫活性细胞,从而下调免疫反应及细胞毒性淋巴细胞的功能。在病理状态下,可影响Fas的表达,使细胞凋亡过程发生改变。本研究结果显示,哮喘组血淋巴细胞FasL表达水平高于对照组(P<0.05),可能与哮喘患儿血淋巴细胞Fas表达下降引起FasL反应性升高有关[10]。甲基强的松龙不能下调FasL表达水平,提示它不是通过抑制FasL表达而发挥抗炎作用,但是否存在量效关系尚有待于进一步研究。
TRAF2是TRAF家族的表达最为广泛的TRAF家族成员,几乎在所有组织中转录,能与TNFR家族中的大多数成员相互作用。TRAF2可以直接与TNF家族中的一些不含死亡结构域的成员连接,也可以与细胞内蛋白,包括MAP3K家族的蛋白酶、激活NF-κB调控因子、抗凋亡因子等相互作用,参与TNF-R1介导的NF-κB和JNK的激活过程,诱导基因表达,对多种生理过程十分重要,如细胞生长、死亡、发育、癌基因的表达、免疫和感染等[11]。本研究发现,TRAF2主要表达于气道上皮细胞和炎症细胞中,而支气管平滑肌中却较少表达,提示它可能主要是通过气道上皮细胞和炎症细胞起作用。TRAF1的表达部位却与之不同,它主要表达在支气管平滑肌细胞,可能通过支气管平滑肌细胞的途经参与哮喘气道高反应性[12]。本研究还发现,哮喘大鼠肺组织TRAF2表达水平显著高于对照组(P<0.01),提示TRAF2可能与哮喘的气道炎症有关。相似的研究也发现,在OVA诱导的哮喘小鼠模型中发现,支气管肺泡灌洗液中炎症细胞(嗜酸粒细胞、中性粒细胞、淋巴细胞)、Th2细胞因子和气道高反应性显著性增加,而TRAF1缺失的小鼠则无上述改变,认为TRAF1可能是促进哮喘炎症的一个细胞因子[13]。上述表明,TRAF家族在哮喘的发病中可能起到致炎作用,抑制或阻断TRAF信号通路可能是治疗哮喘另一个有效的途经。甲基强的松龙组TRAF2表达水平显著下降,且与对照组相近,提示甲基强的松龙能有效地抑制TRAF2表达,且能达到正常的生理水平,其减轻气道炎症可能部分通过TRAF2途经实现。
以上结果显示,哮喘组大鼠FasL和TRAF2表达增加,它们可能参与了哮喘的炎症机制;TLR1无变化,可能它不是通过OVA诱导途经;甲基强的松龙能下调TRAF2和提升TLR1水平,从而起到抗炎的作用,但对FasL无影响。淋巴细胞可能通过FasL和TLR1参与哮喘炎病机制,此过程受甲基强的松龙调节。
[1]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南[J].中华结核和呼吸杂志,2008,31(3):177-185.
[2]Wicovsky A,Henkler F,Salzmann S,et al.Tumor necrosis factor receptor-associated factor-1 enhances proinflammatory TNF receptor-2 signaling and modifies TNFR1-TNFR2 cooperation[J].Oncogene,2009,28(15):1769-1781.
[3]upoux A,Cartier J,Cathelin S,et al.cIAP1-dependent TRAF2 degradation,regulates the differentiation of monocytes into macrophages and their response to CD40 ligand[J].Blood,2009,113(1):175-185.
[4]Bryce PJ,Oyoshi MK,Kawamoto S,et al.TRAF1 regulates Th2 differentiation,allergic inflammation and nuclear localization of the Th2 transcription factor,NIP45[J].Int Immunol,2006,18(1):101-111.
[5]童夏生,罗冬娇,叶斌,等.CXC类趋化因子GROα、ENA-78及NAP-2在大鼠哮喘中的表达及意义[J].中华微生物学与免疫学杂志,2009,29(9):778-781.
[6]苏苗赏,李昌崇.Toll样受体与支气管哮喘免疫调控[J].国外医学儿科学分册,2005,32(2):92-95.
[7]韦江红,莫碧文.Toll样受体与支气管哮喘气道重塑[J].中华哮喘杂志,2010,2(4):44-48.
[8]苏苗赏,李昌崇,林立,等.地塞米松对年幼期哮喘大鼠Toll样受体4信号转导的调节机制[J].中华儿科杂志,2006,44(12):937-940.
[9]邢智伟,李云霞.Fas系统与部分凋亡相关性疾病关系的研究进展[J].医学综述,2010,1(16):33-35.
[10]韩连书,唐美英,沈莉,等.哮喘患儿外周血淋巴细胞Fas及 FasL 的表达[J].上海免疫学杂志,2011,21(1):54-54.
[11]Chen G,Goeddel DV.TNF-R1 signaling:a beautiful pathway[J].Science,2002,296(5573):1634-1635.
[12]Amrani Y,Chen H,Panettieri RA Jr.Activation of tumor necrosis factor receptor 1 in airway smooth muscle:a potential pathway that modulates bronchial hyper-responsiveness in asthma[J].Respir Res,2000,1(1):49-53.
[13]Oyoshi MK,Bryce P,Goya S,et al.TNF receptor-associated factor 1 expressed in resident lung cells is required for the development of allergic lung inflammation[J].J Immunol,2008,180(3):1878-1885.
Regulation with Methylprednisolone on the Expression of Toll like receptor 1,FasL,and Tumor Necrosis Factor Receptor Associated Factor 2 in Asthmatic Rats
JIANG Defu,TONG Xiasheng,LUO Dongjiao,et al.The Second People’s Hospital of Wenling,Taizhou(317500),China
Objective:To investigate the potential effects of methylprednisolone on the expression of Toll like receptor 1(TLR1),FasL,and tumor necrosis factor receptor associated factor 2(TRAF2)in asthmatic rats.Methods:Twenty-seven SD rats were randomly divided into 3 groups,including asthma group,control group,and methylprednisolone-treated group.The levels of TLR1 and FasL in blood lymphocyte were detected by flow cytometry.The expression of TRAF2 protein was detected by immunohistochemical methods.Results:The level of TLR1 in the asthma group(47.58±1.46 )MFI was significantly lower than that in the methylprednisolone-treated group(52.89±3.92 )MFI(P<0.05);The level of TLR1 in the control group did not differ to that in the asthma group or the methylprednisolone-treated group(all P>0.05).The level of FasL in the asthma group(15.52±0.53 MFI)and the methylprednisolone-treated group(14.46±2.19 MFI) were both significantly higher than that in the control group(11.73±1.39 MFI)(all P<0.05),but no significant difference was noted between the asthma group and the methylprednisolone-treated group(P>0.05).The expression of TRAF2 protein in the asthma group(0.317±0.041 optical density)was dramatically higher than that in the control group(0.220±0.057 optical density)and the methylprednisolone treated group(0.235±0.028 optical density)(all P<0.01),but no significant difference was seen between the methylprednisolone-treated group and the control group(P>0.05).Conclusion:The levels of FasL and TRAF2 were elevated and TLR1 had no change in asthmatic rats.The anti-inflammation role of methylprednisolone may be partly through down-regulating TRAF2 and up-regulating TLR1,but had no effect on FasL.
rats asthma Toll like receptor FasL tumor necrosis factor receptor associated factor glucocorticoids
浙江省医药卫生科技计划项目(No.2007-B238),浙江省温岭市科技局基金资助项目(No.2009-2-55)
通迅作者:童夏生,E-mail:xshtzg@163.com
2012-01-13

