灵芝多糖对2型糖尿病大鼠心肌组织氧化应激的影响
冯 艳
江苏省南通市第三人民医院药剂科,南通 226006
灵芝(Ganoderma lucidum)在我国自古就有“仙草”的美誉,已有悠久的药用和食用历史,《神农本草经》、《本草纲目》中都有灵芝的药效记载。灵芝是滋补强壮、扶正固本的珍贵药材。研究表明其主要有效成分是灵芝多糖(Ganoderma Polysaccharides,GLPs),具有免疫调节、抗肿瘤、降血糖、降血脂、抗氧化和延缓衰老等作用[1]。
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病(diabetes mellitus,DM)患者严重的并发症之一,其临床发生率约为75%。有研究表明,糖尿病心肌纤维化与氧化应激之间关系密切。Brownlee[2]提出的糖尿病并发症统一学说更是引起广泛关注,该学说认为:高血糖引起线粒体中超氧阴离子生成过多,引起多元醇通路的激活、糖基化终末产物的形成、蛋白激酶C(PKC)途径及氨基己糖途径的激活,引起细胞功能紊乱,最终导致糖尿病并发症的发生。因此,氧化应激可与糖基化终末产物(AGEs)相互作用加重纤维化,若能寻求有效的物质来降低机体氧化应激水平,对于糖尿病的心肌组织将具有明显的保护作用。
DCM发病机制尚未明确,近年已有研究提示氧化应激在DCM发生和发展的各个环节中起了重要作用[3-4]。本实验旨在研究GLPs对2型糖尿病(T2DM)大鼠氧化应激的影响,通过检测心脏组织中 NO、SOD、MDA、CAT、GSH-Px的含量变化,以分析其作用是否与抗氧化应激有关,为今后更深入研究GLPs药理作用提供依据。
1 材 料
1.1 药物与试剂
灵芝多糖(江苏安惠生物科技有限公司,批号:110601);小檗碱(南京白敬宇制药有限责任公司,批号:110501);链脲佐菌素(streptozotocin,STZ,sigma公司); 一氧化氮(NO)试剂盒(批号:20110407)、过氧化氢酶(Catalase,CAT)测试盒(批号:20110411)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)测试盒(批号:20110411)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:20110312)、丙二醛(malondialdehyde,MDA)试剂盒(批号:20110313)均购自南京建成生物工程研究所。
1.2 仪器
Touch-one血糖仪(美国强生医疗器材有限公司);BH-NIC-B型倒置显微镜(日本Olympus公司)。
1.3 动物
SD清洁级大鼠80只,雌雄各半,体重150~180 g,由南通大学实验动物中心提供,动物许可证:FYXK(苏)2007-0021。
2 方 法
2.1 动物模型的建立与分组
将大鼠随机分为正常对照组(N组,10只)和造模组(70只)。造模组大鼠,雌雄各半,给予高能量饮食(饲料配方:脂肪20%、奶粉5%、蛋黄粉5%、基础饲料70%),4周后禁食12h,由腹腔注射STZ 30mg·kg-1(临用前用0.1 mol·L-1的柠檬酸缓冲液配成浓度为1%的STZ溶液)。注射STZ 1周后,测空腹血糖,血糖值≥16.7 mmol·L-1即造模成功,继续高脂饮食。取成模大鼠50只,随机分为5组,每组10只:模型组(DM组)、灵芝多糖低剂量组(GLPs-L组,200mg·kg-1)、灵芝多糖中剂量组(GLPs-M 组,400mg·kg-1)、灵芝多糖高剂量组(GLPs-H 组,800 mg·kg-1)、小檗碱组(Ber组,30 mg·kg-1)。每天灌胃给药 1次,持续12 w。实验期间,各组大鼠均正常喂养,自由饮水。
2.2 各项指标测定
第12 w末,测量大鼠体重,禁食12 h后,经尾静脉取血测空腹血糖,取心肌组织测定NO、SOD、MDA、CAT 及 GSH-Px。心脏组织中 NO、SOD、MDA、CAT、GSH-Px的测定,按试剂盒说明书操作。
2.3 数据处理
3 结 果
3.1 动物一般情况
实验期间,N组大鼠活动自如,外观状态良好,进水、进食量稳定;模型组大鼠毛色无光泽,活动力差,出现多饮、多食现象;GLPs-M组、GLPs-H组和Ber组的大鼠一般情况与模型组相比有明显改善。
3.2 灵芝多糖对T2DM大鼠血糖的影响
12周后,与DM组相比,GLPs-L组经治疗后血糖无明显变化(P>0.05),GLPs-M 组和 GLPs-H 组血糖浓度较DM组相比均明显下降(P<0.01),而GLPs-H组血糖显著低于GLPs-M组和Ber组(P<0.05)。见表1。
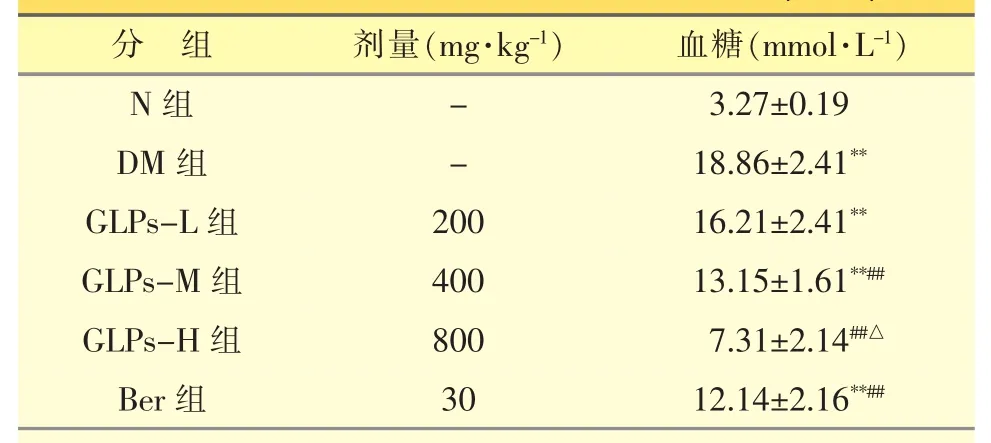
表1 灌胃灵芝多糖对T2DM大鼠血糖的影响(n=10)
3.3 灵芝多糖对 T2DM大鼠心肌 NO、SOD、CAT、GSH-Px活性和MDA含量的影响
与N组相比,DM组心肌NO水平明显降低(P<0.01);与DM组相比,给药后GLPs-L组无明显变化(P>0.05),GLPs-M 组、GLPs-H 组和 Ber组明显上升(P<0.01);与 Ber组相比,GLPs-M 组没有统计学差异(P>0.05),而GLPs-H组的效果要明显优于GLPs-M 组和 Ber组(P<0.05)。
DM组心肌MDA含量比N组明显增高(P<0.01);与DM组相比,给药后GLPs-L组无明显变化(P>0.05),而 GLPs-M 组、GLPs-H 组和 Ber组与DM组相比,MDA含量下降显著(P<0.01)。GLPs-H组与GLPs-M组和Ber组相比,更能降低MDA含量(P<0.01)。
DM组心肌组织中SOD、GSH-PX、CAT活性与N组比较均明显降低(P<0.01);与DM组相比,GLPs-L 组无明显变化(P>0.05),GLPs-M 组、GLPs-H组和Ber组明显上升(P<0.05或 P<0.01); 其中GLPs-M组和Ber组相比,均无统计学差异(P>0.05),而 GLPs-H 组 SOD、GSH-PX、CAT 水平高于GLPs-M 组和 Ber组(P<0.01)。见表 2。
表2 灵芝多糖对T2DM大鼠心肌NO含量、抗氧化酶活性及脂质过氧化物的影响(±s,n=10)
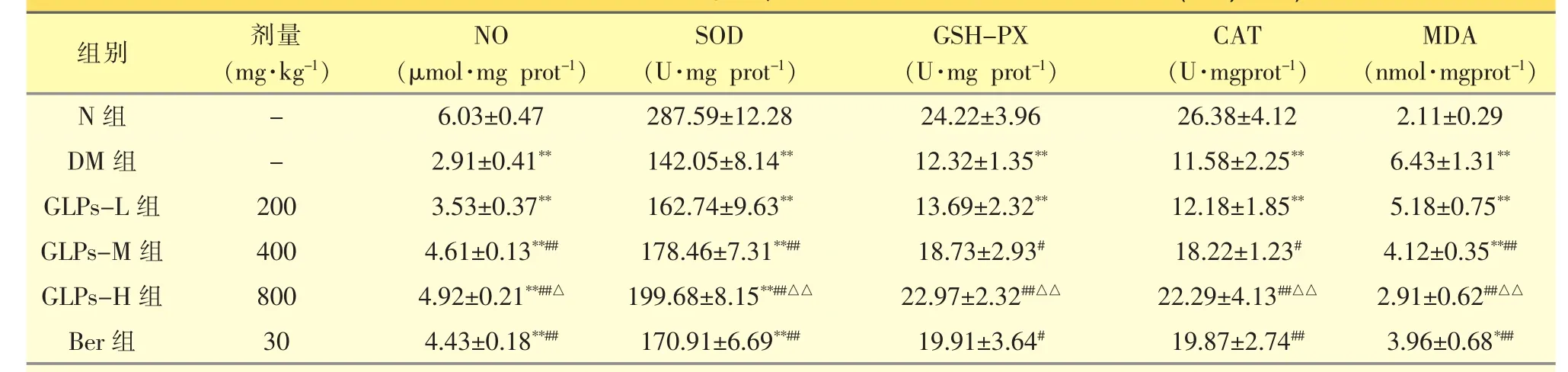
表2 灵芝多糖对T2DM大鼠心肌NO含量、抗氧化酶活性及脂质过氧化物的影响(±s,n=10)
注:与 N 组相比,**P<0.01;与 DM 组相比,#P<0.05、##P<0.01;与 GLPs-M 组和 Ber组相比,△P<0.05、△△P<0.01
3.4 灵芝多糖对T2DM大鼠心肌细胞超微结构的影响
如图1所示,N组心肌细胞内肌原纤维清晰,排列整齐,横纹清楚,线粒体串珠样整齐排列于肌原纤维之间,形态大小正常,可见清晰的闰盘;DM组和GLPs-L组心肌细胞内肌原纤维模糊,排列紊乱,断裂严重,横纹不清,线粒体大量增生,分布紊乱,肿胀变形,可见闰盘;GLPs-M组和Ber组较DM组明显好转,心肌胶原纤维排列相对整齐,可见闰盘,线粒体增生以及水肿减轻,但有一定程度的扭曲、断裂;GLPs-H组大部分肌原纤维排列紧密,线粒体增生明显减少,水肿明显好转,排列较整齐,可见闰盘,扭曲断裂程度较GLPs-M组和Ber组减轻。

图1 灵芝多糖对T2DM大鼠心肌细胞超微结构的影响(12000×)
4 讨 论
糖尿病心肌病变是由糖尿病所致的一种心脏疾病,与血管及瓣膜病理改变无关,随着病情的发展逐渐出现心肌收缩力减弱,心肌舒张受限,每搏心输出量显著减少,并出现代偿性的左心室肥厚,最终导致充血性心力衰竭。糖尿病时,机体的高糖环境是糖尿病心肌病发生和发展的始动因素[5]。因此如能有效地降低机体内血糖水平,对DCM的预防和治疗具有重大意义。本实验中发现高剂量GLPs能够有效降低T2DM大鼠血糖水平。已有研究发现,GLPs可能是通过修复T2DM大鼠的胰岛素β细胞,促进胰岛素的释放,从而降低血糖[6]。
Kakkar等[7]学者研究发现,T2DM大鼠的心脏脂质过氧化程度明显增加;Cail等[8]也在2型DM患者的血液和心肌组织中发现有氧化应激标志物的存在。在高糖环境下,机体一方面清除氧自由基的酶(SOD、CAT、GSH-Px)活性降低;另一方面体内的氧化应激作用增强,造成了体内大量活性氧自由基的积聚,导致活性氧连锁反应,从而促进糖尿病心脑血管以及其他一系列并发症的发生和发展[9]。
小檗碱(Berbrine,Ber),又称黄连素,是黄连的主要活性成分。它具有良好的降血糖作用,并且对防治糖尿病心肌并发症也具有一定的疗效[10]。目前已被用于临床治疗或者辅助治疗DM。本实验中,GLPs-M组的疗效与Ber组相当,GLPs-H组各个指标的改善都优于Ber组。
本研究显示,GLPs的中、高剂量可以有效地提高其心肌组织中SOD、CAT、GSH-Px的活性,提高心肌组织中的NO含量,并降低MDA含量,高剂量组的疗效要优于小檗碱组,表明GLPs对于防治DCM的发生发展具有一定的功效,而且GLPs防治DCM机制,除了本身降血糖的作用外,抗氧化应激可能也发挥着重要作用。DCM的发生和发展是受多种因素影响的,比如蛋白激酶C的活化、肾素血管紧张素系统的激活、心肌血管内皮功能的紊乱等,灵芝多糖是否能通过这些途径来预防DCM的发生和发展,还需要更深入、更广泛的研究。
[1]Lin ZB.The pharmacological effects of Ganoderma lucidum[M]//Lin ZB.Contemporary Studies of Ganoderma lucidum∶2nd Ed.Beijing∶Beijing Medical University Press,2001∶219-83.
[2]Boyer JK,Thanigaraj S,Schechtman KB,et al.Prevalence ofventriculardiastolic dysfunction in asymp tomatic,normotensive patients with diabetes mellitus[J].Am J Cardiol,2004,93(7)∶870-5.
[3]Singal PK,Bello Klein A,Farahmand F,et al.Oxidative stress and functional deficit in diabetic cardiomyopathy[J].Adv Exp Med Biol,2001,498(1)∶213-20.
[4]Hamblin M,Friedman DB,Hill S,et al.Alterations in the diabetic myocardialproteome coupled with increased myocardial oxidative stress underlies diabetic cardiomyopathy[J].Mol Cell Cardiol,2007,42(4)∶884-95.
[5]周庆峰,王洪新,王桂君,等.高糖对去甲肾上腺素诱导的心肌细胞肥大的促进作用 [J].中国药理学通报,2003,19(9):1054-7.
[6]张慧娜,林志彬.灵芝多糖对大鼠胰岛素细胞分泌胰岛素功能的影响 [J].中国临床药理学与治疗学,2003,8(3):265-8.
[7]Kakkar R,Kalra J,Mantha SV,et al.Lipid peroxidation and activity of antioxidant enzymes in diabetic rats[J].Mol Cell Biochem,1995,151(2)∶113-9.
[8]Cai L,Kang YJ.Oxidative stress and diabetic cardiomyopathy∶a briefreview [J].Cardiovasc Toxicol,2001,1(3)∶181-93.
[9]Johansen JS,Harris AK,Rychly DJ,et al.Oxidative stress and the use of antioxidants in diabetes:Linking basic science to clinical practice[J].Cardiovasc Diabetol,2005,4(1)∶5.
[10]赵洪涛.黄连素对实验性2型糖尿病大鼠心肌SOD活性、MDA含量水平的影响 [J].牡丹江医学院学报,2007,28(3):9-11.

