氟他胺大鼠在体肠吸收动力学研究
马露露 ,张广军 ,高保安 ,2,陈建明 ,2⋆
1第二军医大学药学院药剂教研室,上海 200433;2天津天士力制药股份有限公司,天津 300410
氟他胺是一种非类固醇雄性激素拮抗剂,属酰基苯胺类,是前列腺癌的一线治疗药物。目前氟他胺市售制剂为氟他胺片和胶囊,规格为250 mg/片(粒),每日服用3次。由于普通制剂的峰谷效应、服药次数多等因素,氟他胺的毒副作用和患者依从性差等问题很突出[1-2]。故研究开发氟他胺缓释片,解决现有制剂存在的问题、提高氟他胺片剂的疗效和用药安全非常必要。
本文采用大鼠在体灌注法建立了氟他胺大鼠小肠吸收模型,通过考察药物在不同肠段、不同药物浓度、不同聚山梨酯-80浓度的供试液中的吸收特征,研究药物的吸收部位、吸收机制及影响吸收的因素,以期为氟他胺缓控释制剂的研究提供依据。
1 材 料
1.1 仪器
JA5003N型电子天平(上海精密科学仪器有限公司);Agilent1100型高效液相色谱仪、G1314A型紫外检测器、Agilent化学工作站(Agilent,美国);UV1102Ⅱ型紫外分光光度计(上海天美科学仪器有限公司)。
1.2 试药
氟他胺原料药(Flutamide,FLU,江苏天士力帝益药业有限公司,批号20110808,纯度98.6%);氟他胺对照品(中国药品生物制品检定所);酚红、乌拉坦(国药集团化学试剂有限公司);Krebs-Ringer’s缓冲液(K-R缓冲液,自配,每1000 mL含NaCl 7.8 g、KCl 0.35 g、CaCl20.37 g、MgCl20.22 g、NaH2PO40.22 g、葡萄糖 1.4 g、NaHCO31.37 g);甲醇(色谱纯);其他试剂均为分析纯。
1.3 动物
雄性SD大鼠,体重200~220 g,动物合格证号:SCXK(沪)2012-0002,由第二军医大学动物试验中心提供。
2 方法与结果
2.1 溶液的配制
供试药液Ⅰ:精密称取适量氟他胺、聚山梨酯-80,用K-R缓冲液溶解并稀释成氟他胺浓度约为30 μg·mL-1含 1%聚山梨酯-80的溶液。
供试药液Ⅱ:精密称取适量酚红、氟他胺、聚山梨酯-80,用K-R缓冲液溶解并稀释成酚红浓度约为 20 μg·mL-1、氟他胺浓度约为 30 μg·mL-1含 1%聚山梨酯-80的溶液。
2.2 酚红与氟他胺含量测定法及测定波长的选择[3]酚红的吸收峰在558 nm波长处,氟他胺及聚
山梨酯-80均无吸收,而在氟他胺的吸收峰227 nm波长处,酚红和聚山梨酯-80对其测定有干扰。故以紫外可见分光光度法于558 nm波长处测定酚红的浓度,采用HPLC法于227nm处测定氟他胺的浓度。
2.3 肠循环液中酚红浓度的测定
2.3.1 酚红标准曲线的绘制 参考文献方法[4]绘制酚红标准曲线。以吸光度(A)对酚红质量浓度(C)进行线性回归,得标准曲线方程:A=0.017C-0.001(r=0.9997,n=6)。低、中、高(10、30、50 μg·mL-1)3 种浓度的方法回收率分别为100.2%、100.5%、99.8%,日内及日间RSD均小于2%。
2.3.2 酚红浓度的测定 在不同时间点取大鼠在体肠循环液,12000 r·min-1离心5 min,移取上清液0.5 mL,加入0.2 mol·L-1NaOH溶液5 mL中显色,立即在波长558 nm处测定吸光度,将其代入标准曲线方程,求得酚红浓度。
2.4 肠循环液中氟他胺浓度的测定
2.4.1 色谱条件[5]色谱柱:Diamonsil C18(250 mm×4.6mm,5μm);流动相:甲醇-水(60∶40);检测波长:227 nm;流速:1 mL·min-1;柱温:30℃;进样体积:20 μL。
分别取氟他胺对照品甲醇溶液、空白肠循环液及在体肠循环后氟他胺样品液,在上述色谱条件下测定。图1结果表明,氟他胺的保留时间约为25.6 min,样品液的主峰保留时间与氟他胺对照液一致,且空白液对药物的测定无干扰。药物的分离度和理论塔板数均符合要求。
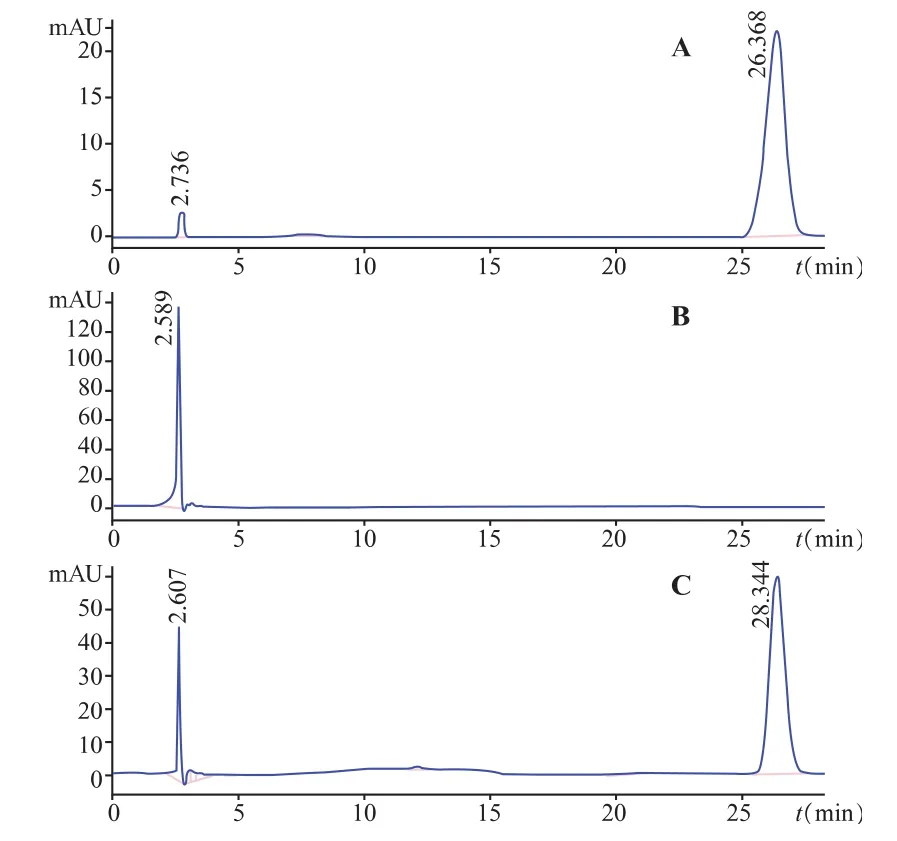
图1 氟他胺的HPLC图谱
2.4.2 氟他胺标准曲线的绘制 精密称取氟他胺对照品,用甲醇配成200 μg·mL-1的标准母液,然后准确吸取适量,用甲醇配成浓度分别为2.5、5、10、20、40、80 μg·mL-1的系列标准液,按“2.4.1”项下色谱条件取 20 μL 进样,以浓度(C,μg·mL-1)为横坐标,以峰面积(Y)为纵坐标,进行线性回归,得回归方程:Y=40.22C-7.098(r=0.9999,n=6)。用 K-R 缓冲液配制低、中、高(2.5、20、80 μg·mL-1)3 个浓度氟他胺溶液(均含1%聚山梨酯-80),取 20 μL进样,以测得浓度和理论浓度比较,计算方法回收率。低、中、高3个浓度氟他胺溶液的平均回收率为(99.98±1.09)%,相对标准偏差(RSD)为 1.09%,方法回收率较好。低、中、高3个浓度日内精密度的RSD值分别为2.77%、1.98%、1.23%(n=6);日间精密度的RSD值分别为2.74%、2.03%、1.77%(n=6);该方法的精密度较好。
2.4.3 肠循环液中氟他胺浓度的测定 在不同时间点取大鼠在体肠循环液,12000 r·min-1离心 5 min,取上清液20 μL进样,将得到的峰面积值代入标准曲线方程,计算氟他胺的浓度。
2.5 氟他胺大鼠在体肠道吸收实验
2.5.1 药物在空白K-R缓冲液中的稳定性考察用空白K-R缓冲液配制3份药液,浓度分别为58.39、28.91、14.52 μg·mL-1(均含 1%聚山梨酯-80),置(37±0.5)℃水浴中孵育,分别于 2 h、6 h 取样并测定孵育前后的药物浓度,考察药物在空白K-R缓冲液中的稳定性,结果基本没有变化,表明氟他胺在空白K-R缓冲液中具有良好的稳定性。
2.5.2 肠壁物理吸附的影响 剪取清洗后的大鼠肠段约10 cm(共4段,分别为十二指肠、空肠、回肠、结肠),用玻璃棒将黏膜层翻出,置50 mL已知浓度的供试药液Ⅰ(37±0.5)℃中孵育,分别于2 h、6 h取样并测定孵育前后的药物浓度,考察大鼠肠壁对药物的物理吸附,结果基本没有变化,表明大鼠肠壁对药物基本无物理吸附。
2.5.3 在体全肠段吸收实验 参照大鼠在体循环实验方法[6-7]。选实验前禁食16 h(自由饮水)的大鼠4只,腹腔注射20%乌拉坦溶液(0.6 mL/100 g)麻醉,然后固定在手术台板上,沿腹中线剪开腹部,结扎胆管。自十二指肠最上端及回肠最下端各插入一玻璃插管,扎紧,用37℃生理盐水洗净肠内容物,用空白K-R缓冲液以1 mL·min-1流速平衡30min,排空回流液,改用200 mL供试药液Ⅱ(含酚红20 μg·mL-1),以流速 1 mL·min-1回流,分别于 0.5、1、1.5、2、3、4、5、6 h 取样 2 mL(同时补加 2 mL 空白 K-R缓冲液)按“2.3.2”与“2.4.3”项下操作,计算得到酚红与氟他胺的浓度。在体小肠循环6 h后,4只大鼠分别约有40%的药物被肠道吸收。
测得循环药液中氟他胺的剩余量:X=C×V
C∶肠循环液中氟他胺浓度;V:利用酚红浓度计算得到的肠循环液体积。
初始药量为 X0,其吸收百分率[8](%)=(X0-X)/X0×100%
以小肠内剩余药量的对数(LnX)对取样时间t作图[9-10],得一直线 Y=-0.096X+8.875(r=0.9998,n=4),且剩余药量的对数值随时间线性下降,说明氟他胺在小肠中的吸收呈现一级动力学过程,求得吸收速率常数 Ka=(0.965±0.017)h-1。见表 1。
表1 氟他胺在大鼠小肠段的累积吸收百分率(±s,n=4)
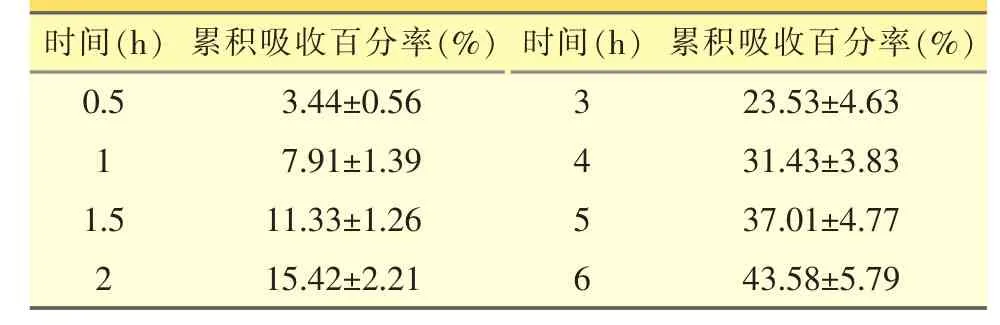
表1 氟他胺在大鼠小肠段的累积吸收百分率(±s,n=4)
2.5.4 在体分肠段循环实验 实验前禁食16 h(自由饮水)的大鼠16只,腹腔注射20%乌拉坦溶液(0.6 mL/100 g)麻醉后固定在手术台板上,沿腹中线剪开腹部,选择所要考察的肠段:自幽门向下取10 cm为十二指肠段;距幽门15 cm处向下取10 cm为空肠段;距盲肠20 cm处向上取10 cm为回肠段;从盲肠向下取10 cm为结肠段。在各肠段两端剪切后插管,结扎。
实验开始后先用37℃生理盐水冲洗肠道内容物,充分洗涤后,再送入空气使洗涤液尽量排尽。然后用37℃空白K-R缓冲液以1 mL·min-1平衡10~20 min,再用空气排出回流液,接着用50 mL供试药液Ⅱ回流2 h,流速1 mL·min-1。结束后,用空气排出药液,将所得回流液移入100 mL量瓶中,另用空白K-R缓冲液冲洗肠道5 min后,并入量瓶。用空白K-R缓冲液定容,混匀。样品溶液离心后,取上清液20 μL注入液相色谱仪,记录峰面积并代入标准曲线计算氟他胺浓度。
实验结束后,将肠段沿插管两端剪下,测量肠段长度L,求算单位吸收量和单位吸收率,以肠壁通透系数Ke表示肠壁通透性。
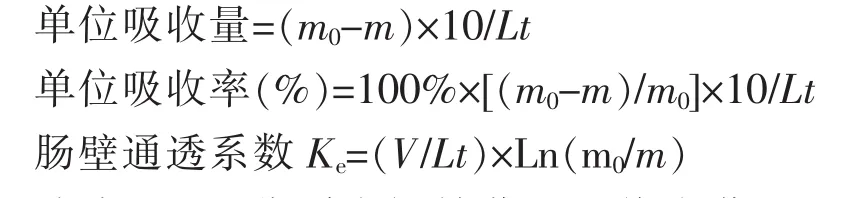
式中m0、m分别为初始药量和终末药量,L为肠段长度,t为循环时间,V为循环液体积。
药物在大鼠不同肠段的累积吸收量、吸收百分率和肠壁通透系数见表2。对氟他胺在大鼠各肠段的吸收结果进行方差分析,表明其在十二指肠、空肠、回肠以及结肠四个肠段的吸收百分率和肠壁通透系数均无显著性差异(α=0.05,P>0.05),说明氟他胺在整个肠段均有吸收。
表2 药物在不同肠段的累积吸收量、吸收百分率和肠壁通透系数(±s,n=4)
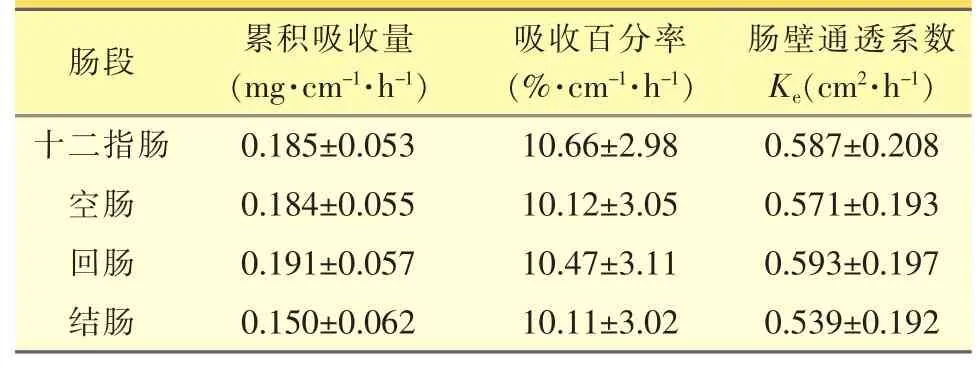
表2 药物在不同肠段的累积吸收量、吸收百分率和肠壁通透系数(±s,n=4)
肠壁通透系数Ke(cm2·h-1)0.587±0.2080.571±0.1930.593±0.1970.539±0.192
2.5.5 药物浓度对肠吸收影响的考察 分别选用浓度为 15.48、35.18、68.48 μg·mL-1的供试药液(KR缓冲液配制,均含1%聚山梨酯-80),进行回流实验,其它步骤同“2.5.3”项,考察药物浓度对吸收的影响。不同药物浓度(15.48~68.48 μg·mL-1)供试液在大鼠肠内的吸收速率常数(Ka,h-1)为(0.092±0.010)~(0.090±0.012);6h 的吸收百分率(%)为(38.07±1.76)~(42.80±3.37)。
对不同药物浓度的吸收速率常数和吸收百分率进行方差分析表明,不同药物浓度的吸收速率常数和吸收百分率均无显著性差异(α=0.05,P>0.05),说明药物的吸收速率常数和吸收百分率与浓度无关,药物吸收量与浓度呈正比关系,符合Ficks扩散原理。说明氟他胺的小肠吸收机制为被动扩散。
2.5.6 聚山梨酯-80浓度对肠吸收影响的考察 分别选用聚山梨酯-80为1%、2%、5%的供试药液(KR 缓冲液配制,氟他胺浓度为 30 μg·mL-1),进行回流实验,其它步骤同“2.5.3”项,考察聚山梨酯-80对吸收的影响。
药物在不同聚山梨酯-80浓度肠循环液中吸收速率常数(Ka)和6 h的吸收百分率见表3。由表3可知,不同聚山梨酯-80浓度条件下,小肠的吸收速率常数和吸收百分率无显著性差异(α=0.05,P>0.05)。
表3 不同聚山梨酯-80浓度肠循环液中氟他胺的吸收速率常数和吸收百分率(±s,n=4)
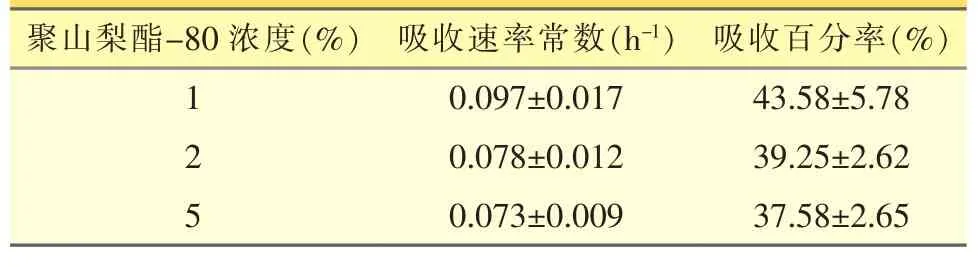
表3 不同聚山梨酯-80浓度肠循环液中氟他胺的吸收速率常数和吸收百分率(±s,n=4)
3 讨 论
评价药物肠吸收动力学的方法可分为3类:体外试验法、在体试验法、体内试验法[10]。其中在体试验法不切断血管与神经,且能够避免胃内容物排出及消化道固有运动的生理影响[11],较为真实地反映药物的吸收情况,药物在大鼠体内吸收与人体内吸收存在高度相关性[12]。故在体试验法是目前常用的一种方法。
氟他胺在肠道内无特定吸收部位,各肠段的吸收速率常数无显著性差异,提示氟他胺可以制成缓、控释制剂。不同药物浓度条件下,小肠的吸收速率常数Ka之间无显著性差异,实验范围内的聚山梨酯-80的浓度(1%~5%)对药物的吸收无影响。全肠段吸收实验中,剩余药量的自然对数与循环时间成线性关系,所得直线的相关系数r>0.9,表明吸收动力学为一级吸收,吸收机制为被动扩散。了解药物的小肠吸收特性,可以更好地指导药物的剂型设计,所以氟他胺的小肠吸收研究对于以后控缓释剂型的设计具有一定的指导意义。
[1]黄胜炎.氟他胺缓释片制备工艺 [J].化学医药工业信息,1993,3(8):16-7.
[2]谢 林,刘晓东,刘国卿.氟他胺胶囊(片)药代动力学及其生物等效性评价[J]. 中国药师,1999,2(2):59-61.
[3]张代美,高 媛,董晨东,等.阿替洛尔大鼠在体胃肠道吸收动力学研究 [J].药学与临床研究,2010,18(6):527-33.
[4]徐春明,郑广军.HPLC法测定氟他胺片的含量[J].药物研究,2008,5(24):46-9.
[5]Liu Y,Zhang P,Feng NP,et al.Optimization and in situ intestinal absorption of self-microemulsifying drug delivery system of oridonin[J].Int J Pharm,2009,36(1-2)∶136-42.
[6]王 娟,宋洪涛,周 欣,等.西罗莫司大鼠在体肠吸收动力学研究[J]. 中国药房,2009,20(1):27-30.
[7]Ling W,Rui LC,Hua JX.In situ intestinal absorption behaviors of tanshinoneⅡA from its inclusion complex with hydroxypropyl-bata-cyclodextrin [J].Biol Pharm Bull,2007,30(10)∶1918-22.
[8]冯 亮,蒋学华,周 静,等.三七皂苷R1和人参皂苷Rg1的大鼠在体肠吸收动力学研究 [J].中国药学杂志,2006,41(14):1097-102.
[9]Li HL,Zhao XB,Ma YK,et al.Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[J].J Control Release,2008,133(3)∶238-44.
[10]朱容慧,赵军宁,毕岳琦,等.中药肠吸收动力学的研究进展[J]. 药物评价研究,2010,33(1):25-9.
[11]沈 凯,王景田.药物肠吸收实验研究方法进展[J].中国新药杂志,2003,12(12):988-91.
[12]Zhao YH,Abraham MH,Le J,et al.Evaluation of rat intestinal absorption data and correlation with human intestinal absorption[J].Eur J Med Chem,2003,38(3)∶233-43.

