猪源多肽类抗生素PR-39真核表达及体外活性研究
范阔海,姜俊兵,于秀菊,尹伟,李宏全
(山西农业大学 动物科技学院,山西 太谷030801)
近年来,许多的研究已经证明多肽类抗生素(AMPs)是动物先天免疫应答的重要组成部分[1],它具有分子量小,热稳定性好,无免疫原性,抗菌谱广等特点。AMPs作用模式较复杂,大致可分为膜破裂型和非膜破裂型两类[2],它是通过改变细菌细胞膜的通透性而发挥抗菌作用,这不同于抗生素的作用机理,由于AMPs在病原体上缺少特定的靶分子,从而大大降低了耐药性产生的几率[3]。AMPs不仅作用于革兰氏阳性细菌,也作用于真菌、昆虫、某些病毒和肿瘤细胞,同时还能加速免疫和伤口的愈合过程,但对正常的真核细胞几乎没有作用。这些特点显示出它具有独特的研究和应用价值。
PR-39 (praline-argininerich 39-amino acid peptide)是cathelicidins家族中富含脯氨酸的小分子肽。PR-39主要在骨髓原代细胞中合成,然后以前肽形式储存在中性粒细胞中,在中性粒细胞脱粒时释放出成熟的抗菌肽[4]。近年许多研究证明PR-39具有多种生物学活性:通过抑制DNA和蛋白质的合成主要作用于革兰氏阴性菌和部分阳性菌[5];促进血管生成[6];通过诱导粘连蛋白聚糖在间充质细胞的表达和影响细胞的运动性,在伤口修复中发挥作用[7];通过抑制嗜中性粒细胞NADPH氧化酶和1κBα和HIF21α的降解在炎症过程中起作用;通过增加IAP-2的表达量抑制缺氧诱导凋亡、降低caspase-3的活性在缺血再灌注损伤中发挥作用[8];PR-39新的功能和作用机制不断被发现和证明[9~11]。甲醇利用型酵母作为表达异源蛋白的表达系统被广泛使用,许多种无脊椎动物和植物的抗菌肽已经在酵母表达系统得到成功的表达[12,13]。
从天然组织中分离的PR-39极其有限,如果从猪骨髓中分离提纯,不但成本高而且分离纯化困难;如果采用化学合成法,价格相当昂贵,难以满足生理学功能研究和临床应用的需要。因此,利用基因工程技术获得PR-39,具有重要的研究意义。但PR-39能够直接杀伤原核细菌,不宜在原核宿主菌中直接表达。本研究根据PR-39氨基酸序列和Pichia pastoris密码子偏好性,人工合成了PR-39基因,通过DNA重组技术将其整合到Pichia pastoris的染色体中,筛选Mut+,用甲醇进行诱导表达后,经Tricine-SDS-PAGE和琼脂扩散试验检测表达产物的大小和抗菌活性,从而获得能高效稳定地表达重组蛋白的基因工程菌,为PR-39的大规模生产提供理论和技术基础。
1 材料和方法
1.1 试验材料
基因工程菌 E.coli TOP10F′,用于质粒的扩增与转化。pHIL-S1载体、Pichia pastoris GS115菌株,购于INVITROGEN公司。大肠杆菌(Escheriehia coli)、金黄色葡萄球菌(Staphylococcus aureus)和沙门氏菌(salmonella)标准菌株由山西农业大学预防兽医实验室保存。
Gel Extraction Kit及 Plasmid Mini Kit购自OMEGA公司;限制性内切酶BamH I、EcoR I、Sal I和T4DNA连接酶购自TaKaRa公司;酵母基因组提取试剂盒购自索莱宝有限公司。
1.2 方法
1.2.1 目的基因的获得
根据Genbank登录的PR-39氨基酸序列和Pichia pastoris对密码子的偏好性[14],人工合成PR-39基因。合成序列为:AGAAGAAGACCAA GACCACCATACTTGCCAAGACCAAGACCAC CACCATTCTTCCCACCAAGATTGCCACCAA GAATCCCACCAGGTTTCCCACCAAGATTCC CACCAAGATTCCCA。依据该基因序列设计一对含有酶切位点的特异性引物:F:5′-CGGAAT TCATGAGAAGAAGACCAAGACCA-3′;R:5′-GTGGATCCTTATGGGAATCTTGGTGGGAA-3′。有下划线的序列是其在两端分别引入EcoRⅠ(GAATTC)和BamH I(GGATCC)限制性酶切位点、CG和GT为保护性碱基。以合成的基因为模板,使用特异性引物,进行PCR扩增。
1.2.2 pHIL-S1-PR39表达载体的构建
PCR产物和pHIL-S1用EcoRⅠ和BamH I进行双酶切,酶切产物经琼脂糖凝胶电泳分离后用Gel extraction kit回 收 141bp 的 PR-39 片 段 和8250bp的载体条带,然后进行连接反应。连接产物转化到大肠杆菌TOP10F′感受态细胞中,经Amp抗性筛选出阳性转化子,用Plasmid Mini Kit提取阳性转化子的质粒,进行双酶切和PCR鉴定,并将菌株送大连宝生物进行测序,确定其阅读框的正确性。
1.2.3 pHIL-S1-PR-39转化毕赤酵母
重组质粒经SalⅠ线性化后,采用电转化的方法导入毕赤酵母GS115的感受态细胞中,用MD培养基筛选出重组阳性表达菌株。MD和MM对重组阳性菌株的表型进行筛选。PCR检测PR-39基因与毕赤酵母GS115染色体基因组的整合,载体pHIL-S1转化的毕赤酵母(pHIL-S1/GS115)作为阴性对照。同时用重组质粒 pHIL-S1-PR-39 DNA作为阳性对照。
1.2.4 重组酵母的诱导表达
接种PCR鉴定阳性的单菌落于BMGY培养基,30℃,220~250r·min-1振荡培养至 OD600=2.0~6.0,4000r·min-1离心5min,弃去培养基,用100mL BMMY培养基重悬菌体,使菌体浓度约OD600=1.0,30℃,220~250r·min-1振荡诱导培养,分别在诱导0h、12h、24h、36h、48h、60h、72h、84h和96h后取样,每次取样1mL;所取样品10 000r·min-1离心2min,将上清和菌体分别置-80℃保存,每24h补充甲醇一次,使其终浓度始终维持为0.5%。
1.2.5 重组蛋白的 Tricine-SDS-PAGE[15]分析
分离胶和浓缩胶浓度分别为16.5%和5%,20V·cm-1恒压电泳3h。然后用考马斯亮蓝染色1h后脱色,对目的条带进行分析。
1.2.6 PR-39生物活性检测
采用琼脂扩散试验,将大肠杆菌、沙门氏菌和金黄色葡萄球菌在LB平板上划线,37℃培养过夜,挑取单菌落接种到5mL LB液体培养基中,37℃培养6h,取200μL涂布于LB平板上,将经过灭菌处理的0.5cm直径的滤纸片置于培养基表面,滴加15 μL待测样品,37℃过夜培养,进行观察。
2 结果与分析
2.1 获得目的基因
以人工合成的PR-39基因为模板用特异性引物进行PCR扩增后,1%琼脂糖凝胶电泳结果显示在141bp处有1条清晰的条带,与预计大小相符(图1)。

图1 PCR扩增产物的琼脂糖凝胶电泳Fig.1 Electrophoresis pattern of PCR product
2.2 重组质粒pHIL-S1-PR-39的鉴定
挑取转化的大肠杆菌TOP10F′阳性克隆菌株为模板,PCR扩增,1%琼脂糖凝胶电泳结果显示在403bp处有1条清晰的条带(图2),与理论值相符。空pHIL-S1作为阴性对照。
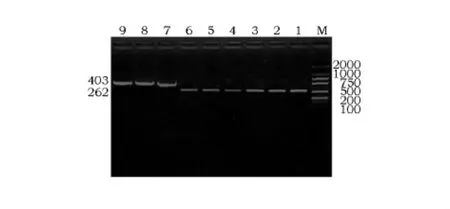
图2 重组质粒pHIL-S1-PR-39的PCR鉴定Fig.2 Identification of recombinant plasmid pHIL-S1-PR-39by PCR
重组质粒 pHIL-S1-PR-39用限制性内切酶EcoRⅠ和BamH I双酶切,1%琼脂糖凝胶电泳结果显示在141bp处有1条清晰的条带(图3)。测序结果表明pHIL-S1载体中插入的PR-39基因序列与合成的序列一致,且阅读框方向正确。
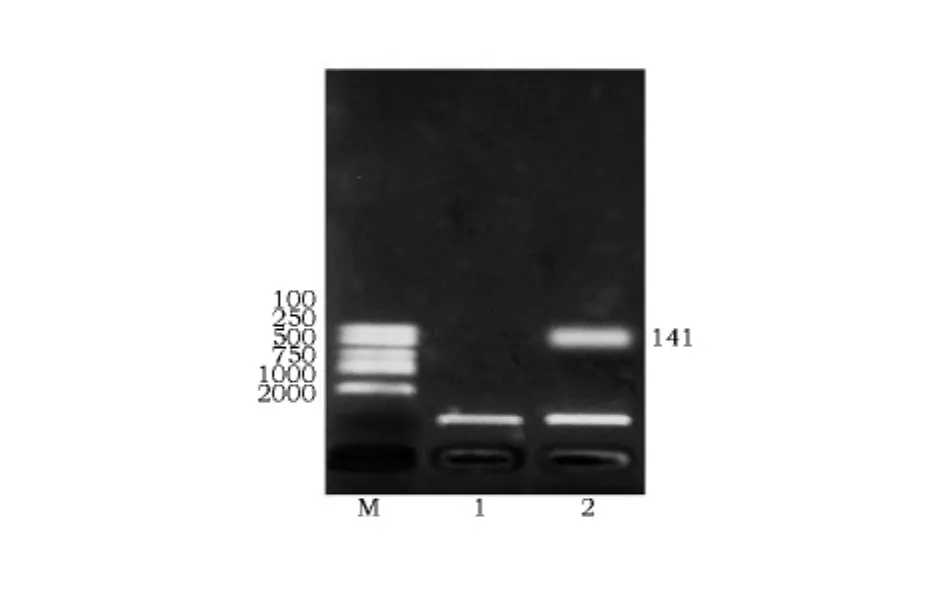
图3 重组质粒pHIL-S1-PR-39的双酶切鉴定Fig.3 Double enzyme digestion identification of recombinant plasmid pHIL-S1-PR-39
2.3 重组酵母的筛选和鉴定
利用电转化的方法将线性化的重组质粒pHIL-S1-PR-39导入到Pichia pastoris GS115中,经MD平板筛选得到重组酵母菌落(图4)。

图4 重组酵母的MD鉴定Fig.4 Identification of recombinant yeast by MD
重组酵母GS115接种到MD和MM平板上,30℃培养2d后,MD与MM菌落的生长速度一致,且大小均一,得到了表型为Mut+的转化子(图5)。
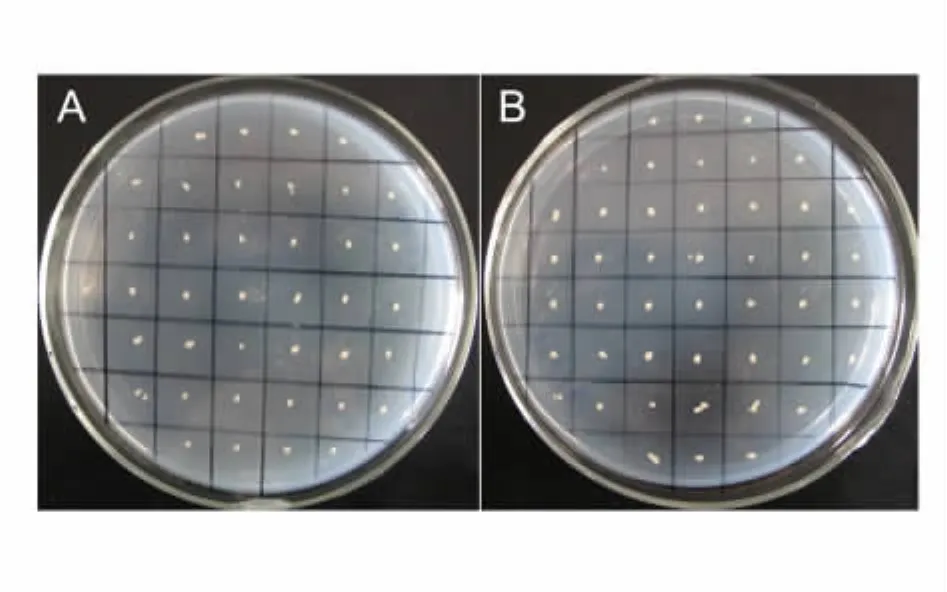
图5 利用MD和MM对Mut+转化子的筛选Fig.5 Identification of Mut+transformants by MD and MM
用5′AOXl和3′AOXl通用引物对酵母基因组进行PCR鉴定,重组酵母 GS115/pHIL-S1-PR-39可扩增出约403bp条带,重组酵母GS115/pHIL-S1可扩增出约262bp条带,质粒pHIL-S1可扩增出约262bp条带(图6)。证明pHIL-S1-PR-39已成功整合到酵母基因组上。

图6 重组酵母基因组的PCR结果Fig.6 The PCR result of yeast genome
2.4 重组蛋白的 Tricine-SDS-PAGE电泳
诱导表达后的培养液上清进行Tricine-SDSPAGE,在4KD处出现分辨率较好的特异性条带(图7),与PR-39的理论大小一致。
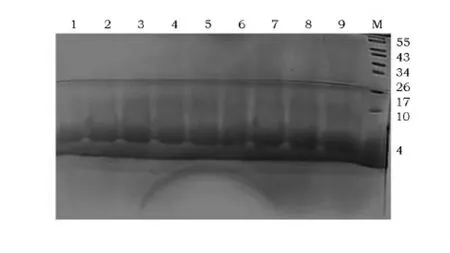
图7 PR-39的 Tricine-SDS-PAGE结果Fig.7 Tricine-SDS-PAGE of PR-39
2.5 重组表达的PR-39抑菌试验结果
用琼脂扩散试验检测发现,滴加有氨苄青霉素的滤纸片周围有明显的抑菌圈,在滴加有表达上清的滤纸片周围也出现明显的抑菌圈(图8),检测结果显示:重组PR-39对大肠杆菌、沙门氏菌和金黄色葡萄球菌都有抑菌效果。
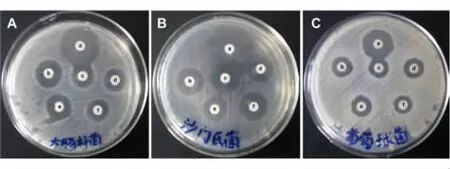
图8 重组PR-39抑菌活性的测定Fig.8 Detection of antibacterial activity of recombinant PR-39
3 讨论
3.1 AMPs PR-39基因密码子优化及合成
目的基因的特性是决定表达成败的首要因素。许多高A+T含量的基因由于成熟前终止而不能有效转录。特定的A+T富含区可作为多腺苷酸或转录终止信号,导致仅产生低水平或截短的mRNA[16]。某些稀有密码子,尤其是稀有密码子密集区往往成为制约翻译速率的因素。目的基因特性对表达的影响被认为是一种具有种属特异性的现象。在某些情况下,可通过定点突变去除成熟前终止结构域和替换稀有密码子。但在更极端的情况下,即基因中存在大量A+T富含区和稀有密码子密集区时,往往需要进行全基因合成,使编码序列符合宿主菌偏爱性密码子用法和具有更高的G+C含量[17]。Zhao等[14]通过分析 Pichia pastoris的28个蛋白编码基因的同义密码子使用情况,并计算该酵母的密码子用法,首次确定出毕赤酵母的19个高表达优越密码子。本研究对AMPs PR-39原基因进行分析,发现其中存在在毕赤酵母中使用频率较低的密码子,为了实现PR-39在毕赤酵母中的高效表达,采用了基因密码子优化和全基因合成的方法,以PR-39氨基酸序列为基础,兼顾毕赤酵母密码子使用的偏好性,合成了PR-39新基因,来去除一些稀有密码子的影响。
3.2 获得能够稳定遗传的重组酵母
和细菌转化不同,毕赤酵母转化较为复杂。毕赤酵母中的表达载体均不含酵母复制原点,导入酵母体内的重组表达载体只有和酵母染色体上的同源区发生重组,整合到染色体上,外源蛋白才能得到稳定表达。如果转化后的重组载体未能整合到染色体上,那么这种转化子是不稳定的,重组载体极易丢失。研究表明,线形化的重组载体有更高的转化效率。因此,在重组载体构建完成后,在转化毕赤酵母之前常用不同的单酶切使其线性化,整合于酵母基因组中的AOX1或GAP或HIS4基因位置。与染色体进行同源重组,将整个载体连同外源基因整合入宿主染色体。
目前,已发展成熟的基因导入法有多种,常用的有原生质体法、锂盐法、PEG法和电转法等。一般地,原生质体法和电转法效率较高(约103~104转化子/μg DNA)。电转法比较简单,原生质体法较复杂。PEG方法和锂盐法方法很简单,这两种方法转化效率较低,且不易形成多拷贝。在进行酵母转化时,主要采用电转法和锂盐法,对于几种外源基因的转化效率比较可以看出,电转法的转化效率明显高于锂盐法转化法。
本研究利用前期构建好的Pichia pastoris胞外表达载体pHIL-S1-PR-39,以限制性内切酶SalI酶切线性化,采用电转化的方法使其整合到宿主菌GSll5染色体上,得到了较多的转化子。本研究选用分泌型毕赤酵母表达系统,外源蛋白的表达受甲醇诱导表达,可以在短时间内表达大量蛋白,同时还可以通过定位信号将外源蛋白定位在过氧化物酶体中表达或分泌至胞外。由于酵母本身仅分泌少量蛋白至培养基中,而且在酵母培养中也无须外加蛋白,因此外源蛋白占培养基中总蛋白的绝大部分,可获得较纯的目的蛋白,基本可以排除酵母自身产生蛋白的影响。这为进一步纯化外源蛋白提供了极大的方便,同时也省却了对酵母菌进行破壁等繁琐的步骤。
3.3 重组表达PR-39的生物学意义
抗菌肽是生物体抵御外源性病原微生物入侵而产生的一类多肽,从细菌到高等哺乳动物都普遍存在。具有分子量小,热稳定性好,无免疫原性,抗菌谱等特点,通过改变细菌细胞膜的通透性而发挥抗菌作用,这不同于抗生素通过阻断大分子生物合成的作用机理,因而致病菌不易对其产生耐药性。抗菌肽对正常的真核细胞几乎没有作用,仅仅作用于原核细胞和发生病变的真核细胞,抗菌肽具有广谱的杀菌活性,不仅作用于革兰氏阳性细菌,而且也作用于真菌、昆虫、某些病毒和肿瘤细胞,同时还能加速免疫和伤口的愈合过程,显示出它具有独特的研究和应用价值。
PR-39是cathelicidins家族中富含脯氨酸的小分子肽。主要在骨髓原代细胞中合成,然后以前肽形式储存在中性粒细胞中,在中性粒细胞脱粒时释放出成熟的抗菌。PR-39通过非穿孔形式抑制DNA和蛋白质的合成,从而对革兰氏阴性菌和阳性菌具有抗菌活性。此外,PR-39在诱导粘连蛋白聚糖在间充质细胞的表达,抑制嗜中性粒细胞NADPH氧化酶,抑制1κBα和HIF21α的降解等方面具有重要作用,这些发现表明PR-39在伤口修复、炎症、缺血再灌注损伤以及诱导血管生成等方面也发挥着重要的生物学功能。
本研究应用酵母表达系统,成功表达出目的蛋白PR-39,并对其活性进行检测,但由于缺乏特异性抗体,不能进行 Western blot检测,对表达蛋白进行了琼脂扩散试验,结果表明重组PR-39对大肠杆菌、沙门氏菌和金黄色葡萄球菌都有明显的抑菌效果。
4 结论
本研究根据PR-39氨基酸序列和毕赤酵母密码子偏好性,在不改变其氨基酸序列的条件下,设计、合成了适合于在毕赤酵母中表达的PR-39编码序列。
利用基因重组技术构建了表达载体pHIL-S1-PR-39,将表达载体pHIL-S1-PR-39电击转入毕赤酵母GSll5,目的基因重组入酵母基因组中,成功获得了具有高效稳定地表达重组蛋白的基因工程菌。
本研究获得的基因工程菌所表达的重组PR-39具有很高的生物学活性。
[1]Yount NY,Bayer AS,Xiong YQ,et al.Advances in antimicrobial peptide immunobiology[J].Biopolymers,2006,84(5):435-458.
[2]Brogden KA.Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria[J].Nat Rev Microbiol,2005,3(3):238-250.
[3]Marshall SH.Antimicrobial peptides:A natural alternative to chemical antibiotics and a potential for applied biotechnology[J].Electronic Journal of Biotechnology,2003,6(3):25-30.
[4]Guolong Zhang,Christopher R Ross,Frank Blecha.Porcine antimicrobial peptides:New prospects for ancient molecules of host defense[J].Vet.Res,2000,31(3):277-296.
[5]Boman HG,Agerberth B,Boman A.Mechanisms of action on Escherichia coli of cecropin P1and PR-39,two antibacterial peptides from pig intestine[J].Infect Immun,1993,61(7):2978-2984.
[6]Li J,Post M,Volk R,et al.PR39,apeptide regulator of angiogenesis[J].Nat Med,2000,6(1):49-55.
[7]Gallo RL,Ono M,Povsic T,et al.Cell surface heparan sulfate proteoglycans are induced by aproline-rich antimicrobial peptide from wounds[J].Proc Natl Acad Sci USA,1994,91(23):11035-11039.
[8]Wu J,Parungo C,Wu G,et al.PR39inhibits apoptosis in hypoxic endothelial cells:role oinhibitor apoptosis protein-2[J].Circulation,2004,109(13):1660-1667.
[9]Michaelar,Hoffmeyer,Rosario Scalia,et al.PR-39,apotent neutrophil inhibitor,attenuates myocardial ischemia-reperfusion injury in mice[J].Am J Physiol Heart Circ Physiol,2000,279(6):H2824-H2828.
[10]Mark J Post,Kaori Sato,Masahiro Murakami,et al.Adenoviral PR39improves blood?flow and myocardial function in a pig model of chronic myocardial ischemia by enhancing collateral formation[J].Am J Physiol Regul Integr Comp Physiol,2006,290:R494-R500.
[11]Angela Djanani,Birgit Mosheimer,Nicole C Kaneider,et al.Heparan sulfate proteoglycan-dependent neutrophil chemotaxis toward PR-39cathelicidin[J].Journal of Inflammation,2006,2(3):14-18.
[12]Burrowers OJ,Diamond G,Lee TC.Recombinant expression of Pleurocidin cDNA using the Pichia pastoris expression system[J].J Biomed Biotechnol,2005,2005(4):374-384.
[13]Li L,Wang JX,Zhao XF,et al.High level expression,purification,and characterization of the shrimp antimicrobial peptide,Ch-penaeidin,in Pichia pastoris[J].Protein Exp Purif,2005,39(2):144-151.
[14]Zhao X,Huo K K,Li Y Y.Synonymous codon usage in Pichia pastoris[J].Chiense Jounal of Biotechnology,2000,16(3):308-311.
[15]Hermann Schägger.Tricine-SDS-PAGE[J].Nature Protocols,2006,1(1):16-22.
[16]Sreekfishna K,Brankamp R G,Kropp K E,et al.St rategies for optimal synthesis and secretion of heterologous proteins in the methylot rophic yeast Pichia pastoris[J].Gene,1997,190(1):55-62.
[17]Withers-Mainez C,Carpenter E P,Hackett F.et al.PCR-based gene synthesis as an efficient approach for expression of the A+T-rich malaria genome[J].Protein Eng,1999,12(12):1113-1120.

