谷氨酰胺对肉鸡小肠组织结构和吸收能力的影响
路 静 李文立 姜建阳 李方正 任慧英
(青岛农业大学动物科技学院,青岛 266109)
家禽是热应激(heat stress)敏感动物,热应激是家禽生产中普遍存在的问题,对家禽生产具有重要影响,随着集约化、高密度饲养方式的发展和全球性气候变暖,热应激对家禽的危害越来越严重。研究表明,高温应激使肉鸡空肠绒毛高度、绒毛表面积和绒毛体积均显著降低[1]。高温应激时家禽摄入的营养物质不能满足需要,肠黏膜绒毛高度降低,而绒毛高度的下降则降低了小肠的吸收能力[2]。谷氨酰胺(glutamine,Gln)是动物在应激条件下所需要的一种重要调控因子,具有抗应激、抗感染、抗氧化、增强免疫力等功能。一般情况下,Gln为非必需氨基酸,但当动物处于应激或病理状态时,内源合成的Gln不能满足需要,这时Gln就变成了必需氨基酸,必须从外界摄取才可防止机体代谢的失衡[3]。众多研究表明,Gln是小肠黏膜代谢的必需营养物质,Gln缺乏可导致小肠黏膜萎缩、绒毛变稀变矮,屏障功能下降。补充Gln能显著增加大鼠和仔鸡肠黏膜的重量、DNA和RNA含量,恢复绒毛高度、黏膜表面积和隐窝深度,加快肠上皮细胞更新速度等,从而恢复并维持黏膜形态和功能的完整性[4-5]。Gln是机体的一种重要原料来源,也是一些快速分裂细胞的主要能量来源,可以抵抗外来的毒害作用,特别在维持小肠和免疫系统的正常形态和功能方面有着重要的作用[6-7]。但关于Gln在家禽热应激时对小肠组织结构和吸收能力影响的报道不多。为此,本试验以对热应激特别敏感的肉鸡为研究对象,探讨外源性Gln对热应激条件下肉鸡的小肠组织结构和吸收能力的影响,为Gln作为抗热应激添加剂在畜禽生产中的应用提供一定依据。
1 材料与方法
1.1 试验材料与基础饲粮
试验用Gln购自保龄宝生物股份有限公司,食品级,有效成分含量为99%。基础饲粮采用玉米-豆粕型饲粮,参照美国NRC(1994)家禽营养需要量中推荐的肉鸡饲粮营养水平设计配方,基础饲粮组成及营养水平见表1。
1.2 试验动物及设计
选择1日龄科宝-500肉鸡240只,按体重相近的原则分为6个处理,每个处理4个重复,每个重复10只。Ⅰ组为对照组,饲喂玉米-豆粕型基础饲粮,Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组为试验组,分别饲喂在基础饲粮中添加0.4%、0.8%、1.2%、1.6%和2.0%Gln的试验饲粮,试验于2009年7月14日至2009年8月24日进行,预试期2周(1~14日龄),正试期4周(15~42日龄)。
1.3 饲养管理
试验采用笼养方式,自由采食和饮水,定期清理粪便,24 h光照。正试期的热应激模型[8]如下:每天07:00开始升温,到09:00升至35℃左右,09:00—17:00维持(35±2)℃ 8 h,17:00开始降温,到19:00降至30℃左右,直至次日07:00,温度维持在(30±2)℃12 h。采用电热管加热的升温方式,用温控仪控制温度。采用加湿器和喷水的方法控制鸡舍湿度在70%~80%。用最高最低温度表和干湿球温度计记录全天的温度和湿度。
鸡的免疫接种按常规进行,其他管理按照《肉鸡饲养管理手册》进行。随时观察记录试验鸡的生长状况。
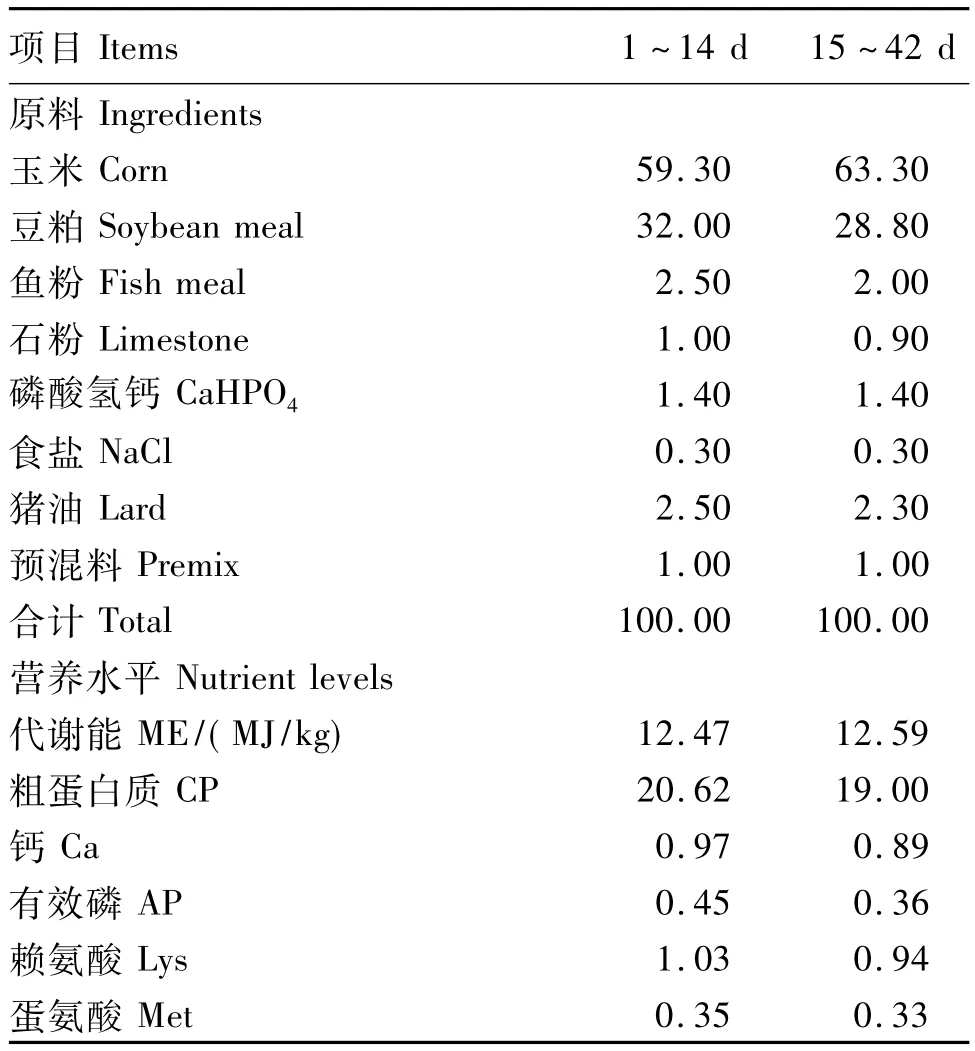
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.4 测定指标及方法
1.4.1 生长性能指标
分别于28、42日龄以重复为单位进行空腹称重,计算15~28日龄、29~42日龄、15~42日龄的平均日增重。按照“清箱底法”统计饲料消耗,并计算平均日采食量和料重比。
1.4.2 小肠组织结构观察
分别于28、42日龄清晨喂料前,每个重复按平均体重选3只鸡,颈静脉放血法处死。打开腹腔,分别截取十二指肠、空肠、回肠各1段,迅速放入10%甲醛固定液中,待制作组织切片。组织切片的制作过程如下:按常规组织切片制作要求,将固定的标本经水洗、脱水、透明、浸蜡、包埋等处理后,在室温下切成约10 μm厚的切片,用苏木精-伊红染色法染色后制成组织切片。在各组织切片中选出典型视野,采用荧光倒置显微镜及显微图像分析系统(日本Nikon TE-2000),测量出各段小肠的绒毛高度、绒毛宽度、固有层厚度和隐窝深度。
1.4.3 小肠吸收能力——木糖吸收试验
分别在28和42日龄进行试验,各组分别取4只鸡禁食禁水2 h,准确称重,然后在5 min内按每千克体重口服10%的D-木糖溶液1 mL,1 h后采血5 mL,肝素钠抗凝。血样3 000 r/min离心15 min,取血浆于-20℃保存,采用间苯三酚比色法测定血浆中D-木糖浓度。
1.5 统计分析
采用SPSS 17.0软件中单因素方差分析(One-way ANOVA)进行显著性分析,LSD法进行多重比较。试验数据以“平均值±标准差”表示。
2 结果
2.1 Gln对热应激肉鸡生长性能的影响
由表2可见,15~28日龄,各试验组的平均日增重、平均日采食量、料重比均与对照组差异不显著(P>0.05);29~42日龄,平均日增重各试验组均显著高于对照组(P<0.05),其中2.0%Gln组极显著高于对照组(P<0.01);平均日采食量各试验组均在一定程度上高于对照组,其中2.0%Gln组极显著高于对照组(P<0.01),0.4%、0.8%、1.6%Gln组显著高于对照组(P<0.05);料重比各试验组均在一定程度上低于对照组,其中1.2%Gln组显著低于对照组(P<0.05),其余各试验组与对照组差异不显著(P>0.05)。
在整个试验期(15~42日龄),各试验组的平均日增重均显著高于对照组(P<0.05),其中2.0%Gln组极显著高于对照组(P<0.01);各试验组的平均日采食量均在一定程度上高于对照组,其中2.0%Gln组极显著高于对照组(P<0.01),0.4%、1.6%Gln组显著高于对照组(P<0.05);各试验组的料重比均在一定程度上低于对照组,但差异不显著(P>0.05)。
2.2 Gln对热应激肉鸡小肠组织结构的影响
2.2.1 Gln对热应激肉鸡十二指肠组织结构的影响
由表3可见,28日龄时,绒毛高度各试验组均高于对照组,0.4%Gln组显著高于对照组(P<0.05),0.8%、1.2%、1.6%、2.0%Gln 组极显著高于对照组(P<0.01),其中2.0%Gln组最高,比对照组提高了51.7%;绒毛宽度、固有层厚度、隐窝深度各试验组均在一定程度上低于对照组,但差异不显著(P>0.05)。
42日龄时,绒毛高度各试验组均在一定程度上高于对照组,但仅1.2%Gln组极显著高于对照组(P<0.01),比对照组提高了24.7%,其余各试验组与对照组差异不显著(P>0.05);绒毛宽度各试验组均极显著低于对照组(P<0.01),其中1.6%Gln组最低,比对照组降低了21.6%,其次为0.4%、1.2%Gln组;固有层厚度各试验组均在一定程度上低于对照组,但差异不显著(P>0.05);隐窝深度各试验组均低于对照组,其中0.8%、1.2%Gln组极显著低于对照组(P<0.01),0.4%、1.6%、2.0%Gln组显著低于对照组(P<0.05)。以上可知,42日龄时Gln以添加量为1.2%时效果较好,Ⅰ组(对照组)和Ⅳ组(1.2%Gln组)42日龄肉鸡十二指肠形态结构见图1。
2.2.2 Gln对热应激肉鸡空肠组织结构的影响
由表4可见,28日龄时,绒毛高度各试验组均在一定程度上高于对照组,0.8%、1.2%、1.6%、2.0%Gln组极显著高于对照组(P<0.01),其中2.0%Gln组最高,比对照组提高了53.6%,但0.4%Gln组与对照组差异不显著(P>0.05);绒毛宽度和固有层厚度各试验组均在一定程度上低于对照组,但差异不显著(P>0.05);隐窝深度各试验组均在一定程度上低于对照组,但仅有0.4%Gln组极显著低于对照组(P<0.01),比对照组降低了33.3%,其余各试验组与对照组差异不显著(P>0.05)。
42日龄时,绒毛高度各试验组均在一定程度上高于对照组,其中1.2%、1.6%Gln组极显著高于对照组(P<0.01),2.0%Gln组显著高于对照组(P<0.05),但0.4%、0.8%Gln组与对照组差异不显著(P>0.05);绒毛宽度各试验组均在一定程度上低于对照组,0.4%、1.2%、1.6%、2.0%Gln组极显著低于对照组(P<0.01),其中1.2%Gln组最低,比对照组降低了19.6%,但0.8%Gln组与对照组差异不显著(P>0.05);固有层厚度各试验组均在一定程度上低于对照组,但仅0.4%、1.2%Gln组显著低于对照组(P<0.05),其余各试验组与对照组差异不显著(P>0.05);隐窝深度各试验组均在一定程度上低于对照组,但仅1.6%Gln组极显著低于对照组(P<0.01),比对照组降低了27.6%,其余各试验组与对照组差异不显著(P>0.05)。以上可知,42日龄时Gln以添加量为1.2%时效果较好,Ⅰ组和Ⅳ组42日龄肉鸡空肠形态结构见图2。

表2 Gln对热应激肉鸡生长性能的影响Table 2 Effects of Gln on growth performance of broilers under heat stress
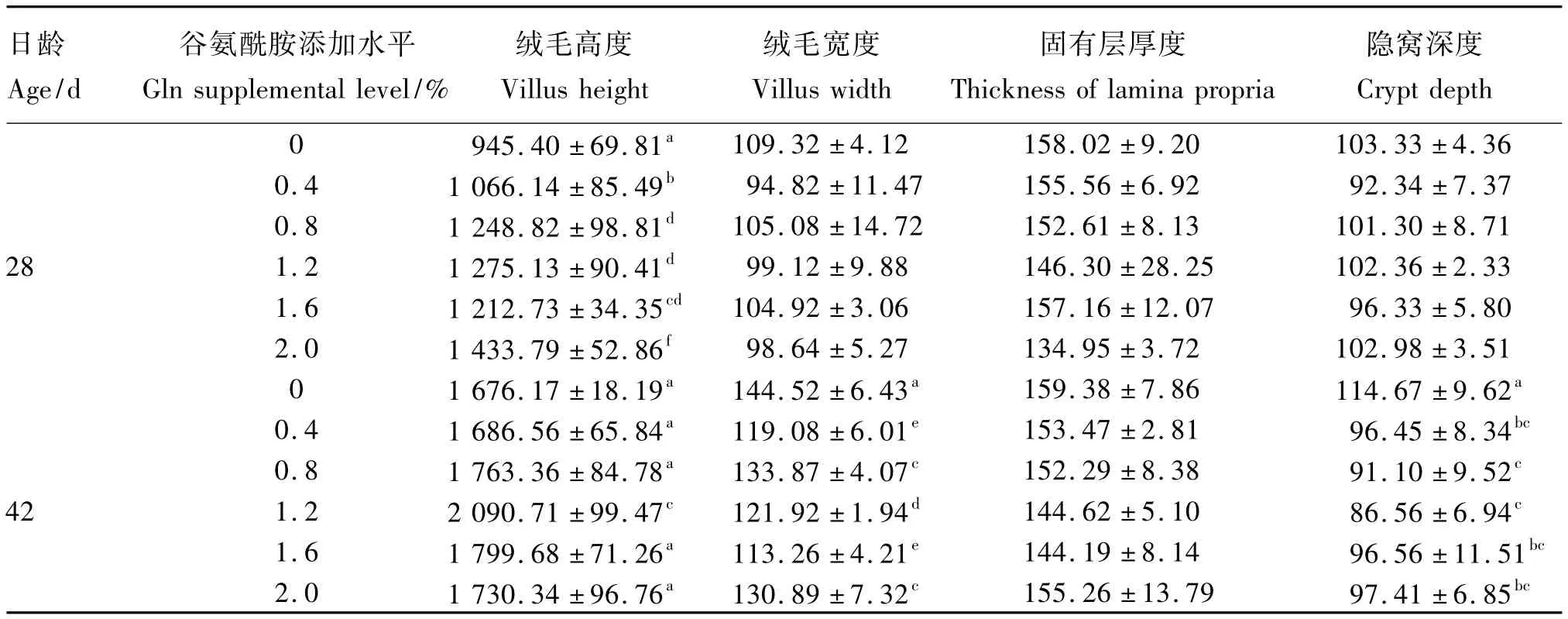
表3 Gln对热应激肉鸡十二指肠组织结构的影响Table 3 Effects of Gln on duodenum morphological structure of broilers under heat stress μm
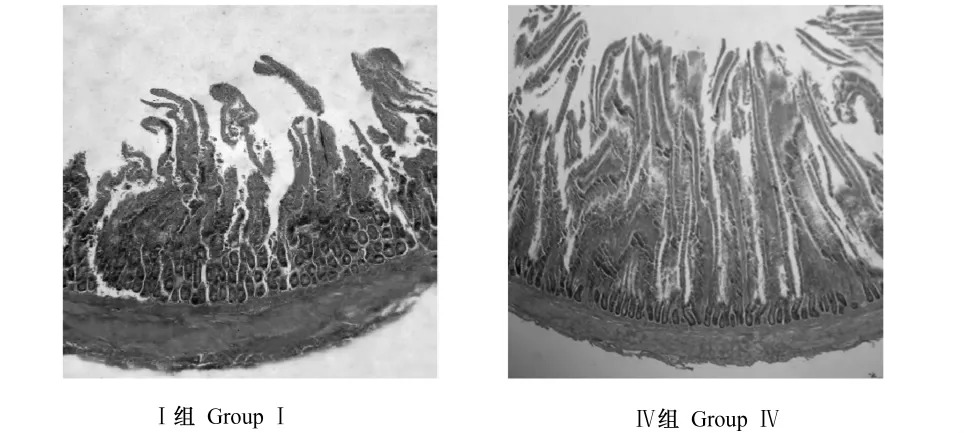
图1 Ⅰ组和Ⅳ组42日龄肉鸡十二指肠形态结构Fig.1 Duodenum morphological structure of 42-day-old broilers in groupsⅠ and Ⅳ (40 ×)
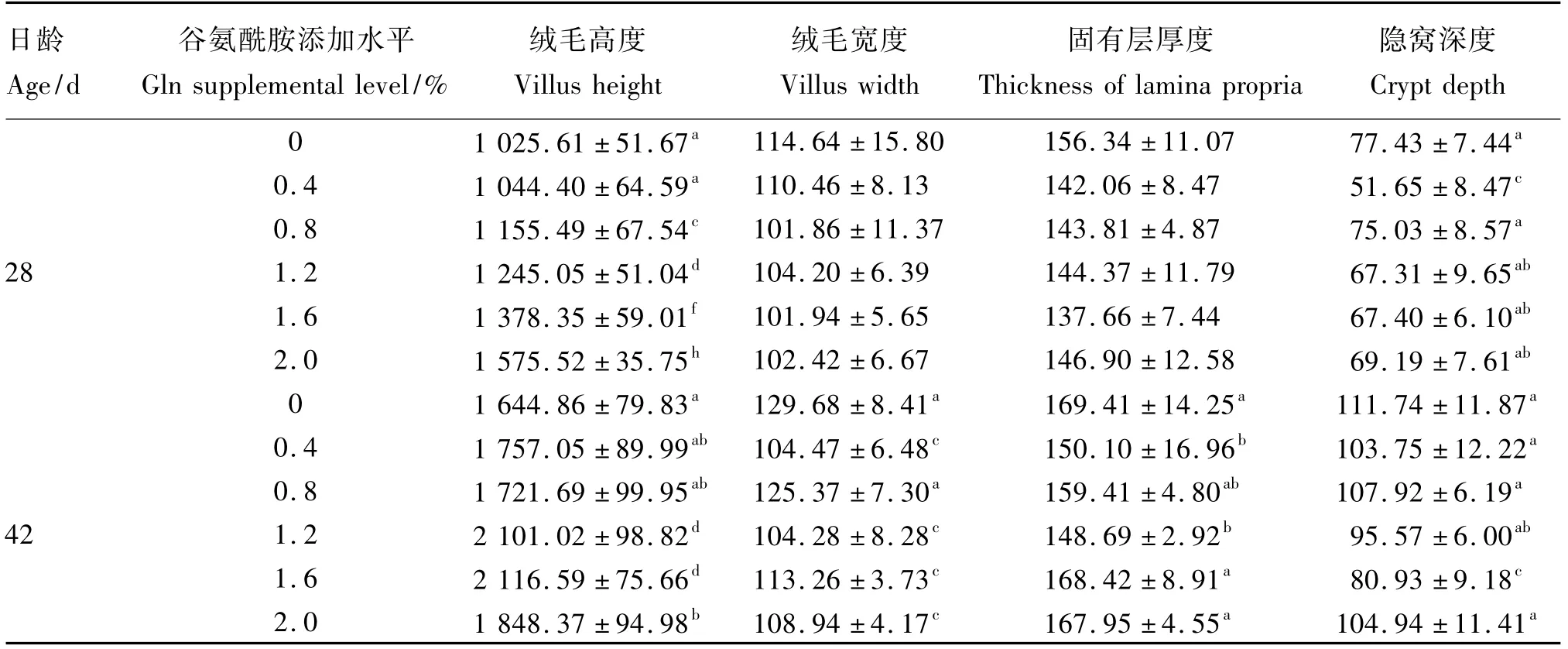
表4 Gln对热应激肉鸡空肠组织结构的影响Table 4 Effects of Gln on jejunum morphological structure of broilers under heat stress μm
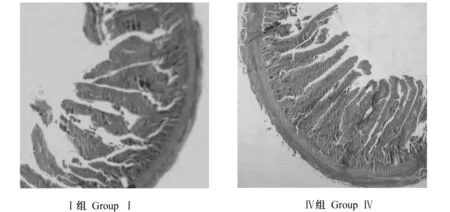
图2 Ⅰ组和Ⅳ组42日龄肉鸡空肠形态结构Fig.2 Jejunum morphological structure of 42-day-old broilers in groupsⅠ and Ⅳ (40 ×)
2.2.3 Gln对热应激肉鸡回肠组织结构的影响
由表5可见,28日龄时,绒毛高度各试验组均在一定程度上高于对照组,0.4%、1.2%Gln组极显著高于对照组(P<0.01),其中1.2%Gln组最高,比对照组提高了56.3%,2.0%Gln组显著高于对照组(P<0.05),0.8%、1.6%Gln组与对照组差异不显著(P>0.05);绒毛宽度各试验组均在一定程度上低于对照组,其中0.8%、1.2%、1.6%Gln组显著低于对照组(P<0.05),但0.4%、2.0%Gln组与对照组差异不显著(P>0.05);固有层厚度和隐窝深度各试验组均在一定程度上低于对照组,但差异不显著(P>0.05)。
42日龄时,绒毛高度各试验组均在一定程度上高于对照组,其中0.8%、1.2%、1.6%、2.0%Gln组极显著高于对照组(P<0.01),但0.4%Gln组与对照组差异不显著(P>0.05);绒毛宽度各试验组均在一定程度上低于对照组,其中1.2%、1.6%、2.0%Gln组极显著低于对照组(P<0.01),但0.4%、0.8%Gln组与对照组差异不显著(P>0.05);固有层厚度各试验组均在一定程度上低于对照组,但仅有0.8%、1.2%Gln组极显著低于对照组(P<0.01),其余各试验组与对照组差异不显著(P>0.05);隐窝深度各试验组均在一定程度上低于对照组,0.8%、1.2%、1.6%、2.0%Gln组极显著低于对照组(P<0.01),其中1.6%Gln组最低,比对照组降低了43.5%,但0.4%Gln组与对照组差异不显著(P>0.05)。以上可知,42日龄时Gln以添加量为1.2%时效果较好,Ⅰ组和Ⅳ组42日龄肉鸡回肠形态结构见图3。
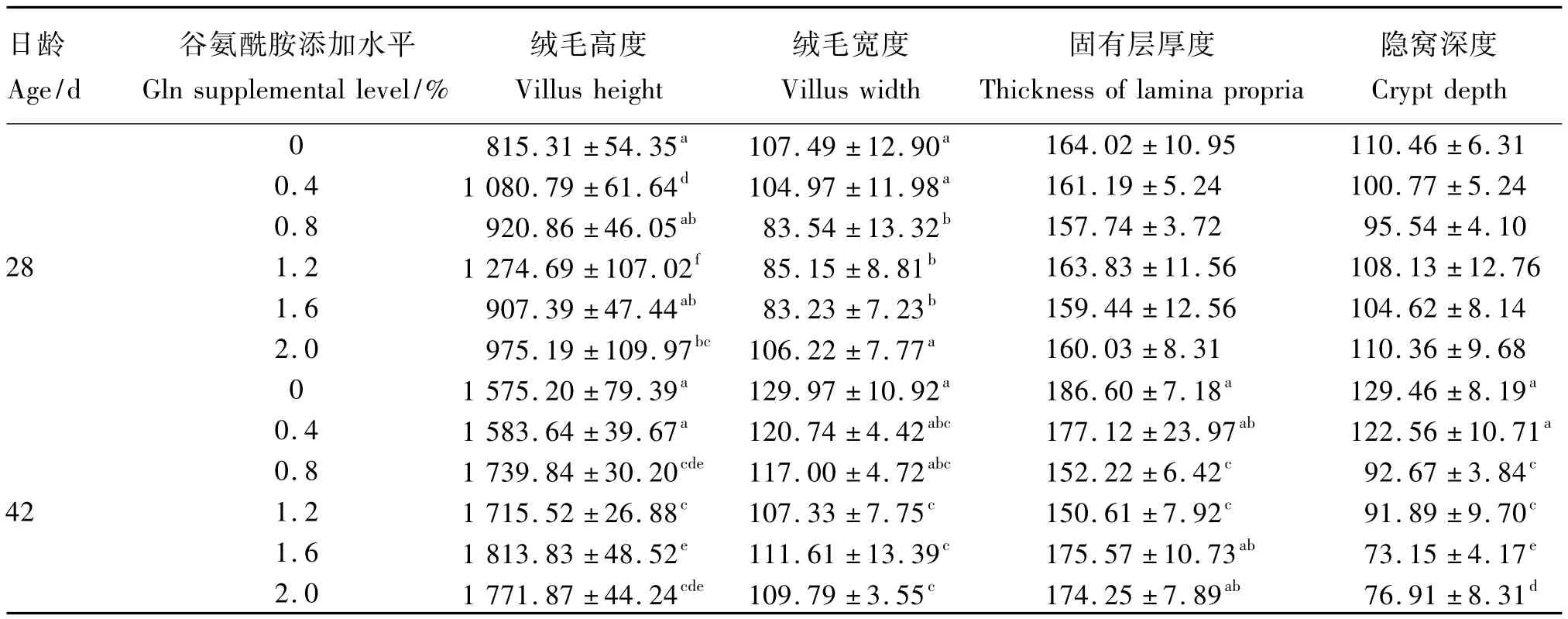
表5 Gln对热应激肉鸡回肠组织结构的影响Table 5 Effects of Gln on ileum morphological structure of broilers under heat stress μm

图3 Ⅰ组和Ⅳ组42日龄肉鸡回肠形态结构Fig.3 Ileum morphological structure of 42-day-old broilers in groupsⅠ and Ⅳ (40 ×)
2.3 Gln对热应激肉鸡小肠吸收能力的影响
由表6可见,28日龄时,各试验组血浆D-木糖浓度均在一定程度上高于对照组,但仅2.0%Gln组极显著高于对照组(P<0.01),其余各试验组与对照组差异不显著(P>0.05)。42日龄时,各试验组血浆D-木糖浓度均在一定程度上高于对照组,但仅1.2%Gln组显著高于对照组(P<0.05),其余各试验组与对照组差异不显著(P>0.05)。

表6 Gln对热应激肉鸡血浆D-木糖浓度的影响Table 6 Effects of Gln on plasma D-xylose concentration of broilers under heat stress mmol/L
3 讨论
3.1 Gln对热应激肉鸡生长性能的影响
在高温环境中肉鸡的采食量降低,饲料转化率变差,生长速度减慢[9]。诸多研究表明饲粮中添加Gln能提高热应激动物的生长性能。黄冠庆等[10]研究表明,高温下在黄羽肉鸡饲粮中添加Gln能不同程度地提高其平均日增重。戴四发等[11]试验表明,饲粮中添加外源性Gln可以有效缓解热应激给肉鸡生产带来的对生长性能、部分消化酶活性和小肠形态结构的负面影响,并使绝大部分指标接近无热应激环境下的对照组,且不存在统计学差异。Gln能缓解热应激可能与其特殊的生理功能有关,肉鸡在热应激状态下对Gln的需要量可能增加,而机体合成量不能满足其需要,这时补充外源Gln可满足其需要,从而维持肉鸡在高温下的小肠功能和免疫机能的正常,使肉鸡健康生长。本试验结果表明,热应激条件下在饲粮中添加一定水平的Gln有利于提高肉鸡后期(29~42日龄)的平均日采食量和平均日增重,降低料重比,且以1.2%Gln的添加效果最佳,但对前期(15~28日龄)的生长性能影响不显著;从整个试验期来看,饲粮中添加Gln提高了热应激肉鸡平均日增重和平均日采食量。Gln在前期的促生长作用不如后期的可能原因是,在试验前期,肉鸡刚进入热应激阶段,对热应激比较敏感,机体的各种机能产生了较大的变化,尤其是小肠的结构和功能。Mecormack等[12]研究表明由Gln代谢产生的鸟氨酸是多胺合成的重要前体,多胺在小肠细胞的增殖分化、受损肠上皮的修复等过程中都有重要的作用,这时大部分的外源性Gln被用于抵抗应激作用和修复自身的损伤或用于补充一些快速分裂细胞的能量等,而不是用于促进生长性能,所以早期的促生长效果不佳。本试验中由于前期的修复作用而使Gln在后期的促生长效果较显著。由整个试验期可以看出,当Gln添加水平在0.4%、0.8%、1.2%、1.6%时各试验组的平均日增重和平均日采食量相差不大,但当添加水平达到2.0%时平均日增重和平均日采食量急剧增加,可能是因为一部分Gln用于修复热应激造成的损伤,多余的Gln通过参加体内营养物质代谢而被转化为机体的物质组成部分,或参与机体的能量代谢,为机体生长提供能量,使生长性能显著增加。
3.2 Gln对热应激肉鸡小肠组织结构的影响
小肠结构的正常与否是影响营养物质吸收和动物生长的重要因素。营养物质的吸收主要依靠小肠绒毛。绒毛宽度与绒毛密度成反比,绒毛越细越高,单位面积内的绒毛数量越多,小肠的有效吸收面积越大,对营养物质的吸收越有利。固有膜构成绒毛的中轴,并填充在肠腺之间。当小肠受到刺激时,小肠绒毛常发生萎缩、脱落,隐窝深度增加,固有膜变厚,营养物质的吸收受到影响。因此,小肠的绒毛高度、绒毛宽度、隐窝深度及绒毛表面积是衡量小肠吸收功能的重要指标。在指状绒毛中,绒毛的长度与肠上皮细胞数量呈显著正相关。绒毛变短时,肠上皮细胞数量减少,对营养物质的吸收能力降低。李可洲等[13]研究表明,绒毛越长,吸收面积越大;绒毛越短,吸收面积越小,对营养物质的吸收能力越低。另外,受到高温应激的动物十二指肠、空肠、回肠均有明显的病理损伤性变化,主要表现为黏膜上皮细胞脱落、黏膜固有层水肿、肠绒毛断裂等器质性病变[14]。Mitchell等[1]研究发现,高温应激使小母鸡空肠绒毛高度、绒毛表面积和绒毛体积(高度×表面积)均显著降低。胡艳欣等[15]研究报道,热应激使猪十二指肠、空肠、回肠的绒毛高度、绒毛宽度、隐窝深度、绒毛高度/隐窝深度(V/C)均呈下降趋势(其中绒毛宽度均显著变窄),导致试验猪小肠吸收面积减少、功能下降,以致猪增重率显著下降。Gln是体内含量最为丰富的氨基酸,是快速分裂细胞(如肠黏膜上皮细胞、淋巴细胞、血管内皮细胞等)的主要能源物质。动物小肠是利用Gln最多的器官,Gln也是小肠黏膜上皮细胞的主要能源物质[16-17]。当机体出现病理状态时,机体对 Gln的需要量增加,超过了体内的合成能力,此时,需要从外界补充Gln。有关仔猪氨基酸营养的研究表明,仔猪在21~28日龄时,母乳中Gln的分泌达到高峰,若在此时断奶极易造成Gln的严重匮乏,导致断奶后小肠绒毛缩短和隐窝加深,小肠结构的完整性受到破坏,直接影响其吸收功能,造成生长性能下降[18-20]。戴四发等[11,21]研究表明,适宜水平的Gln可以有效增大肉鸡空肠绒毛的表面积,以增加其与消化道内容物的接触面积,利于吸收;添加Gln能够有效缓解热应激对肉鸡生长性能、部分消化酶活和小肠形态结构的不利影响。本试验结果表明,在热应激条件下,28日龄时,饲粮中添加0.8%~2.0%Gln极显著提高了十二指肠和空肠绒毛高度;添加0.4%、1.2%、2.0%Gln显著或极显著提高了回肠绒毛高度。42日龄时,饲粮中添加Gln显著或极显著降低了十二指肠绒毛宽度和隐窝深度,但仅添加1.2%Gln极显著提高了十二指肠绒毛高度;添加1.2% ~2.0%Gln显著或极显著提高了空肠和回肠绒毛高度、降低了绒毛宽度,且添加1.2%Gln显著或极显著降低了空肠和回肠固有层厚度。由此可见,热应激条件下饲粮中添加Gln可显著改善小肠的组织结构,增强小肠的吸收能力,进而缓解高温应激对肉鸡的危害,而且对后期的影响明显优于前期。
3.3 Gln对热应激肉鸡小肠吸收能力的影响
小肠是消化道内营养物质吸收和转运的主要部位,小肠结构与功能的正常是营养物质充分消化与吸收的基本保证。小肠黏膜细胞间紧密连接的结构能够选择性地让某些水溶性物质和大分子通过,而限制细菌、毒素等通过。在评价小肠吸收功能时,D-木糖吸收试验是较经典的方法。研究发现小肠黏膜绒毛高度降低、隐窝深度增加及消化酶活性下降往往伴随着断奶仔猪对标准剂量D - 木糖吸收能力的下降[22],潘俊福等[23]研究表明,饲粮中添加不同水平的Gln能在一定程度上改善肉鸡小肠吸收功能。刘艳芬等[24]研究表明,饲粮中添加Gln能明显改善肉鸡小肠的吸收能力,其中添加0.2%Gln的作用效果最好。此外,肉鸡的吸收功能随着日龄的增加而加强,与其小肠发育规律是一致的。本试验研究表明,28日龄时,随着饲粮中Gln添加水平的增加,应激肉鸡小肠的吸收能力增强,添加水平达到2.0%时小肠的吸收能力最佳,与对照组呈现显著性差异。42日龄时,添加水平为1.2%时小肠吸收能力最佳,显著高于对照组。小肠吸收能力的变化和上述小肠组织结构的变化是基本一致的。由此可见,小肠组织结构的好坏对小肠的吸收能力起着决定性的作用。
4 结论
在热应激条件下,饲粮中添加Gln有利于改善肉鸡的生长性能和小肠组织结构,并提高小肠的吸收能力,缓解热应激对肉鸡造成的危害,且对后期的影响优于前期,综合考虑可知前期添加2.0%较好,后期添加1.2%较好。
[1]MITCHELL M A,CARLISLE A J.The effects of chronic exposure to elevated environmental temperature on intestinal morphology and nutrient absorption in the domestic fowl(Gullus domestics)[J].Comparative Biochemistry Physiology,1992,101:137-142.
[2]UNI Z,GAL-GARBER O,GEYRA A,et al.Change in growth and function of chick small intestine epithelium due to early thermal conditioning[J].Poultry Science,2001,80:438-445.
[3]李建华,刘东文,高春生.谷氨酰胺的营养作用及其在饲料中的应用[J].安徽农业科学,2007,35(11):3282-3448.
[4]JIANG Z M,CAO J D,ZHU X G,et al.The impact of alany-glutamine on clinical safety,nitrogen balance,intestinal permeability,and clinical outcome in postoperative patients: a randomized,double blind,controlled study of 120 patients[J].Journal of Parenter Enteral Nutrition,1999(6):S62.
[5]刘涛,彭健,周诗其,等.外源性谷氨酰胺和谷氨酸对早期断奶仔猪肠黏膜形态、结构和小肠吸收功能及骨骼肌中DNA、RNA浓度的影响[J].中国兽医学报,2003(1):62-65.
[6]WU G.Intestinal mucosal amino acid catabolism[J].The Journal of Nutrition,1998,128:1249 -1252.
[7]REEDS P J,DOUGLAS G B,BARBABAS G P,et al.Eternal glutamine is the preferential source for mucosal glutamine synthesis[J]. American Journal Physiology,1997,273:E408-E415.
[8]张彩虹,李文立,任慧英,等.酵母铬对热应激肉鸡生长性能和血清生化指标的影响[J].动物营养学报,2008,20(6):668 -673.
[9]高增兵,傅伟龙,蒋宗勇,等.高温环境对肉鸡生产性能和血浆甲状腺素、胰岛素水平的影响[J].华南农业大学学报,1999,20(1):26 -31.
[10]黄冠庆,林红英,黄晓亮.谷氨酰胺对高温下黄羽肉鸡增重及血液生化指标的影响[J].中国畜牧兽医,2006,33(2):3 -5.
[11]戴四发,王立克,王立新,等.谷氨酰胺对热应激条件下肉鸡生产性能、小肠消化酶活和形态结构的保护作用[J].中国粮油学报,2009,24(4):103-107.
[12]MECORMACK S A,JONSON L R.Role of polyamines in gastrointestinal mucosal growth[J].World Journal Gastroenterology,1991,260:795-806.
[13]李可洲,李宁,黎介寿,等.短链脂肪酸对大鼠移植小肠形态及功能的作用研究[J].世界华人杂志,2002,10(6):720 -722.
[14]宁章勇,刘思当,赵德明,等.热应激对肉仔鸡呼吸、消化和内分泌器官的形态和超微结构的影响[J].畜牧兽医学报,2003,34(6):558 -561.
[15]胡艳欣,肖冲,佘锐萍,等.热应激对猪小肠结构及功能的影响[J].科学技术与工程,2009,9(3):1671-1819.
[16]SOUBA W W,HERSKOWITZ K,AUSTQEN T R,et al.Glutamine nutrition:theoretical considerations and therapeutic impact[J].The American Society for Parenteral and Enteral Nutrition,1990,14(5):237S-243S.
[17]WINDMUELLER H G.Glutamine utilization by the small intestine[J].Advance Enzyme,1982,52:201.
[18]张军民.谷氨酰胺对早期断奶仔猪肠道的保护作用及其机理研究[D].博士学位论文.北京:中国农业科学院,2000.
[19]KENWORTHY R.Observations on the effects of weaning in the young pig:clinical and to pathological studies of intestinal function and morphology[J].Research in Veterinary Science,1976,21:69-75.
[20]LI D F,MELSSEN J L,REDDY P G,et al.Interrelationship between hypersensitivity to soybean proteins and growth performance in early weaned pigs[J].Journal of Animal Science,1997,69:4062-4065.
[21]戴四发,李有志,李如兰,等.外源性谷氨酰胺对肉仔鸡空肠形态结构的影响[J].畜牧兽医学报,2005,36(1):100 -104.
[22]HAMPSON D J,SMITH W C.Influence of creep feeding and dietary intake after weaning on malabsorption and occurrence of diarrhea in the newly weaned pigs[J].Research of Veterinary Science,1986,41(1):63-69.
[23]潘俊福,徐春厚,刘艳芬.谷氨酰胺对艾维茵肉仔鸡空肠结构和消化吸收能力的影响[J].饲料工业,2006,27(17):24 -26.
[24]刘艳芬,马建升,黄晓亮.谷氨酰胺对肉仔鸡小肠发育及吸收功能的影响[J].中国农学通报,2006,22(8):39-43.

