猪白细胞介素6基因的克隆及其作为核酸免疫佐剂的研究
杨 恒,李华春*,文心田,曹三杰
(1.云南省畜牧兽医科学院,云南昆明650224;2.四川农业大学动物医学院,四川雅安625014)
白细胞介素6(Interleukin-6,IL-6)由多种淋巴样细胞和某些非淋巴样细胞产生,分子量为19ku~28ku,具有多种生物学效应,在调节免疫应答、诱导急性期蛋白、神经系统的发育与维持和造血干细胞的增殖中均起着重要作用[1]。在调节免疫应答方面,IL-6作为B淋巴细胞刺激因子,能够促进B淋巴细胞增殖分化,从而增加Ig类抗体(IgM、IgG、IgA)的分泌[2];IL-6也能够诱导T淋巴细胞的活化增殖,促进T淋巴细胞产生IL-2以及表达IL-2受体[3-4]。目前,IL-6已广泛应用于疫苗佐剂、肿瘤治疗、疾病诊断等领域研究,具有良好的应用前景。
Richards等首次从猪滑膜成纤维样细胞中克隆了猪 IL-6(p IL-6)的 cDNA[5],Nuntaprasert等在杆状病毒、大肠杆菌与动物细胞中表达了具有生物学活性的rp IL-6蛋白[6]。严琳等将原核表达的rpIL-6作为疫苗佐剂,有效提高了伪狂犬病基因缺失疫苗的免疫效力[7];Wu等的研究表明p IL-6重组真核表达质粒作为佐剂可以提高猪丹毒、猪肺疫、猪霍乱三价灭活苗的特异性抗体水平[8],这提示p IL-6是一种较有潜力的的疫苗佐剂。目前对于将p IL-6作为DNA疫苗佐剂对免疫应答的调节尚未见系统报道,因此本研究克隆p IL-6并构建其重组真核表达质粒,分析p IL-6作为核酸免疫佐剂对猪传染性胃肠炎病毒(TGEV)核酸免疫的免疫增强效果,为将p IL-6作为DNA疫苗佐剂的研究奠定了良好的基础。
1 材料和方法
1.1 质粒、菌株、细胞及实验动物 pMD19-T载体购自宝生物工程(大连)有限公司;真核表达载体pVAX、TGEV S基因重组真核表达质粒pVAX-S(含有S基因5'端约2.1kb的主要抗原位点编码区)[9]、大肠杆菌DH5α、COS-7细胞由本实验室保存。6周龄NIH小鼠(雌雄各半,清洁级)购自成都生物制品研究所。
1.2 主要试剂 限制性内切酶、Taq DNA聚合酶、T4DNA连接酶、BcaBEST RNA反转录试剂盒购自宝生物工程(大连)有限公司;蛋白质Marker、动物细胞RNA提取试剂盒、DNA胶回收试剂盒购自天根生化科技(北京)有限公司;去内毒素质粒提取试剂盒购自美国OMEGA公司;Lipofectamine 2000购自美国Invitrogen公司;淋巴细胞分离液购自天津TBD公司;兔抗rpIL-6蛋白多克隆抗体由本实验室制备保存;羊抗鼠HRP-IgG、羊抗兔HRP-IgG酶标抗体购自北京博奥森生物技术有限公司;FITC标记羊抗鼠CD4+、PE标记羊抗鼠CD8+、SPRD标记羊抗鼠 CD3+单克隆抗体(MAb)购自美国 Southern-Biotech公司。
1.3 引物设计与合成 参照GenBank中登录的pIL-6cDNA序列(NM_214399)设计引物L1:5'-GCG GATCCGCTATGAACTCCCTCTCCACAA-3'(Bam HⅠ)和 L2:5'-GCGAATTCCTACATTATCCGAATGGCCC TC-3'(EcoRⅠ)用于扩增p IL-6基因的完整编码区,引物由上海英骏生物技术有限公司合成。
1.4 p IL-6基因的克隆 参照文献[10]的方法从3月龄猪(DIY三元杂交)采血分离外周血单核细胞(PBMCs),加入适量的含10%小牛血清的 RPM I-1640培养基(含10μg/m L的ConA),刺激培养12h~18h后离心收集细胞。按动物细胞RNA提取试剂盒说明提取细胞总RNA作为模板,以oligo dT为引物,按BcaBEST RNA反转录试剂盒说明进行反转录反应。以合成的cDNA为模板进行PCR扩增,体系如下:cDNA 5μL、L1和L2引物各1μL(25pmol/μL)、10×PCR Buffer 5μL、dNTP(2.5mmol/L)4μL、Taq DNA聚合酶(2.5U/μL)1μL,加入H2O补齐总体积至50μL。PCR扩增条件为:94℃ 4min;94℃45s、53℃ 40s、72℃ 40s,30个循环;72℃10min。PCR产物经电泳胶回收后与pMD19-T载体连接。将获得的重组质粒进行PCR与酶切鉴定,并由上海英骏生物技术有限公司测序,将获得的重组质粒命名为pMD-IL6。
1.5 p IL-6基因重组真核表达质粒的构建及在COS-7细胞中的表达检测 将pMD-IL6以EcoRⅠ和Bam HⅠ进行双酶切,电泳胶回收纯化目的DNA片段,将其连入真核表达载体pVAX中,转化DH5α感受态细胞,培养后提取重组质粒,进行PCR与酶切鉴定,将鉴定正确的重组质粒命名为pVAX-IL6。
使用去内毒素质粒提取试剂盒提取pVAX-IL6重组质粒,按脂质体转染试剂操作说明,转染生长达80%的单层COS-7细胞。于转染后的48h收集细胞培养上清浓缩后进行SDS-PAGE电泳。将PAGE胶上的蛋白转印至硝酸纤维素膜上,2%BSA封闭2h,以兔抗rp IL-6蛋白多克隆抗体(1∶500)作为一抗,以羊抗兔 HRP-IgG(1∶2000)为二抗,DAB显色,进行western blot鉴定。
1.6 小鼠分组与免疫 采用SDS碱裂解法制备质粒DNA(大量制备)与聚乙二醇纯化质粒的方法,分别进行pVAX-S、pVAX-IL6、pVAX质粒的提取与纯化。将NIH小鼠随机分为4组,每组8只,分别设为pVAX-S+pVAX-IL6质粒混合免疫组pVAX-S(100μg)+pVAX-IL6(100μg)/只、pVAX-S+pVAX质粒混合对照组pVAX-S(100μg)+pVAX(100μg)/只、pVAX空载体质粒对照组pVAX(100μg/只)、PBS阴性对照组(PBS 100μL/只)。腿部肌肉注射免疫小鼠,共免疫3次。分别于免疫前以及免疫后的14d、35d、42d,每组随机取3只小鼠断尾采血,分离血清,-20℃保存备用。
1.7 免疫小鼠血清特异性TGEV IgG抗体的ELISA检测 以蔗糖密度梯度离心纯化TGEV作为包被抗原,4℃包被96孔板过夜。待检血清1∶40倍稀释,以1∶3000倍稀释的羊抗鼠HRP-IgG作为二抗,通过TMB显色,2mol/L硫酸终止反应,读取OD450nm值,所得数据用SPSS12.0软件的One-Way ANVOA方法进行统计学分析。
1.8 免疫小鼠外周血T淋巴细胞亚群数量的检测在小鼠免疫后的42d迫杀小鼠,眼球采血。取抗凝血0.1m L,加入4m L红细胞裂解液,室温作用10min,1500r/min离心10m in,弃上清,加入5m L PBS重悬,1500r/m in离心10m in,重复两次。加入荧光标记的的抗鼠CD4+、CD8+与CD3+MAb,4℃避光作用30min,荧光洗液洗两遍,于流式细胞仪上测定外周血细胞中CD4+、CD8+、CD3+阳性细胞百分率,所得数据用SPSS12.0软件的One-Way ANVOA方法进行统计学分析。
2 结 果
2.1 p IL-6基因的克隆、序列测定与分析 提取经刺激培养PMBCs总RNA为模板,采用引物L1和L2通过RT-PCR扩增出与预期大小相符,约600bp大小的片段(图1)。将目的DNA片段连入pMD19-T载体,经酶切鉴定显示重组质粒构建正确。进一步序列测定表明,扩增的p IL-6基因编码区长度为639bp,编码212个氨基酸残基。获得的pIL-6编码区核苷酸序列与GenBank中登录的p IL-6参考序列(NM-214399)比较显示,核酸序列在3处发生了变异,分别是103位(A→T),291位(A→C),589位(G→A);导致对应氨基酸序列34位(Asp→Val),97位(Lys→Cys),196位(Ser→Asn)氨基酸的改变。
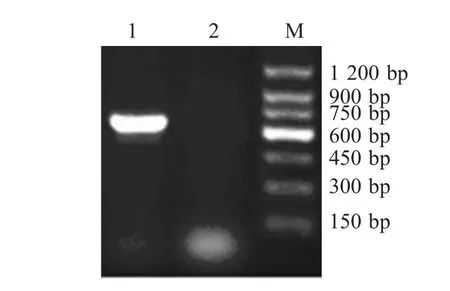
图1 pIL-6基因的RT-PCR扩增Fig.1Amplification of p IL-6gene by RT-PCR
2.2 p IL-6基因真核表达质粒的鉴定与体外表达将pVAX-IL6质粒以EcoRⅠ和Bam HⅠ进行双酶切鉴定,分别得到与预期pIL-6大小相符约600bp的DNA片段以及约3000bp的pVAX载体DNA片段,表明pVAX-IL6重组质粒构建正确。将pVAX-IL6转染COS-7细胞的培养液上清浓缩处理后进行SDS-PAGE电泳,以兔抗rp IL-6蛋白多克隆抗体为一抗,western blot结果显示:pVAX-IL6转染后的COS-7细胞上清中出现大小约33ku的特异性蛋白条带,而pVAX空载体未见特异性条带。结果表明pVAX-IL6在细胞中获得表达,并且表达的p IL-6蛋白分泌至胞外(图2)。
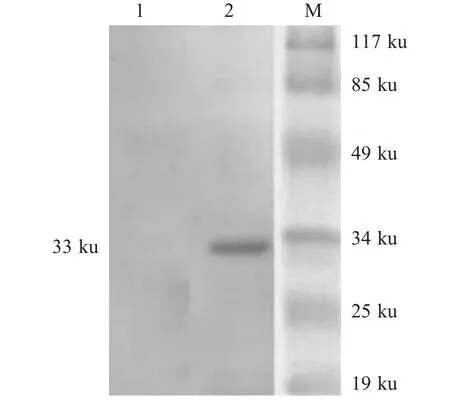
图2 重组质粒pVAX-IL6在COS-7细胞中表达产物的western blot检测Fig.2Western blot detection of pVAX-IL6expression product in COS-7cells
2.3 p IL-6真核表达质粒对TGEV核酸免疫特异性免疫应答的提高作用 将pVAX-IL6与pVAX-S混合后肌肉注射免疫小鼠,结果显示:pVAX-S+pVAX-IL6免疫组TGEV抗体水平在免疫后的第14d略高于pVAX-S+pVAX对照组,但差异不显著(p>0.05);在 免疫后的第 35d、42d,pVAX-S+pVAX-IL6组抗体水平表现了较高的增长水平,显著高于(p<0.05)pVAX-S+pVAX组(图3)。在免疫后的42d采集免疫组小鼠外周血,进行T淋巴细胞亚类测定,结果表明:pVAX-S+pVAX-IL6免疫组CD3+T淋巴细胞亚类高于pVAX-S+pVAX对照组差异显著(p<0.05);在CD8+、CD4+T细胞亚类数量方面,pVAX-S+pVAX-IL6免疫组均高于pVAX-S+pVAX对照组,并且差异显著(p<0.05)(图4)。以上结果表明,pIL-6可以有效促进TGEV核酸免疫的特异性体液与细胞免疫应答。
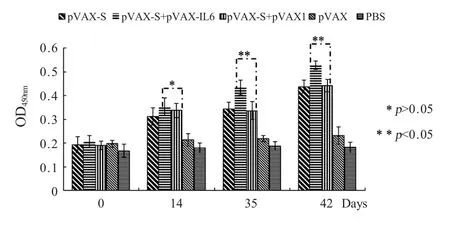
图3 免疫小鼠血清中TGEV特异性IgG抗体的间接ELISA测定Fig.3Indirect ELISA analysis of anti-TGEV IgG antibody in serum ofm ice inoculated with different combinations of recombinant plasm ids

图4 免疫小鼠外周血T淋巴细胞亚类数量测定Fig.4The proliferation of T-lymphocytes subgroups in peripheral blood ofmice after inoculated with different combinations of recombinant plasm ids
3 讨论
细胞因子基因通常处于沉默状态,其表达具有时空性,只有当受到刺激原致敏后才进行转录和表达,同时细胞内的mRNA在完成翻译后很快降解,因此克隆存在一定难度。为有效扩增pIL-6基因,本研究在加入ConA对PBMCs进行刺激培养后的不同时间提取RNA,并采用两步法进行RT-PCR,结果表明PBMCs刺激培养12h获取的RNA为模板,扩增出p IL-6基因。
本实验中选用western blot方法对pVAX-IL6在COS-7细胞中的表达情况进行了检测。由于分泌到培养基中的细胞因子蛋白浓度可能较低,培养上清液难于直接用于检测,因此实验中通过冻干的方法对转染细胞的上清液进行了浓缩,提高培养上清中细胞因子蛋白的浓度从而便于检测。除去信号肽的pIL-6蛋白的预测分子量为21ku,而western blot结果显示,pVAX-IL6在COS-7细胞中表达的pIL-6重组蛋白大小为25ku~30ku。通过对p IL-6蛋白糖基化的预测表明,其中存在N糖基化位点与O糖基化位点,因此推测可能是糖基化以及翻译后的修饰导致了COS-7细胞中表达与pIL-6蛋白分子量大于推导值。
IL-6为Th2型细胞因子,该类细胞因子以增强体液免疫为主,降低免疫球蛋白亚类IgG2a/IgG1的比例,提升IgE的表达,弱化CD8+细胞免疫[11]。考虑到体液免疫在抗TGEV感染中起着关键性作用,本研究中选取了可以提升体液免疫Th2型细胞因子IL-6作为TGEV DNA疫苗佐剂。pIL-6的生物学活性可用小鼠杂交瘤细胞B9或7DT1进行测定,这提示IL-6在不同物种间的交叉活性很可能具有“向下兼容性”[12],因此实验中我们选取了小鼠作为实验动物进行p IL-6对DNA疫苗的佐剂效应分析。实验结果显示,细胞因子佐剂pIL-6对TGEV DNA疫苗免疫效力有较强的提升作用。pVAX-S+pVAX-IL6免疫组小鼠CD3+、CD4+T淋巴细胞亚群数量、抗体水平显著高于pVAX-S+pVAX对照组,一方面证明了IL-6在不同物种间的交叉活性的“向下兼容性”,另一方面也显示了p IL-6作为猪DNA疫苗佐剂的良好应用前景。前期研究中我们以减毒沙门氏菌传递TGEV S基因DNA疫苗取得了良好的免疫效果[13],在进一步的研究中,我们将考虑进一步构建pIL-6与S基因的真核双表达质粒,从而便于使用减毒沙门氏菌同时传递细胞因子佐剂与抗原编码基因,从而进一步提高口服TGEV DNA疫苗的免疫效果。
[1]Van Snick J.Interleukin-6:an overview[J].Annu Rev Immunol,1990,8:253-278.
[2]Ramsay A J,Husband A J,Ramshaw I A,et al.The role of interleukin-6in mucosal IgA antibody responses in vivo[J].Science,1994,264(5158):561-563.
[3]Mule J J,Custer M C,Travis W D,et al.Cellular mechanisms of the antitumor activity of recombinant IL-6in mice[J].J Immunol,1992,148(8):2622-2629.
[4]Murtaugh M P,Baarsch M J,Zhou Ya-ling,et al.Inflammatory cytokines in animal health and disease[J].Vet Immunol Immunopathol,1996,54(1-4):45-55.
[5]Richards C D,Saklatvala J.Molecular cloning and sequence of porcine interleukin 6cDNA and expression of mRNA in synovial fibroblasts in vitro[J].Cytokine,1991,3(4):269-276.
[6]Nuntaprasert A,Mori Y,Fujita K,et al.Expression and characterization of the recombinant swine interleukin-6[J].Comp Immunol M icrobiol Infect Dis,2005,28(2):103-120.
[7]严琳,何启盖,陈焕春,等.猪IL-2与IL6的原核表达及其对伪狂犬病基因缺失疫苗的佐剂效应研究[J].中国农业科学,2003,36(10):1213-1218.
[8]Wu Mei,Gao Rong,Meng M ing-Jie,et al.Regulating effects of porcine interleukin-6gene and CpG motifs on immune responses to porcine trivalent vaccines in mice[J].Res Vet Sci,2004,77(1):49-57.
[9]杨恒,曹三杰,黄小波,等.TGEV双基因嵌合表达质粒pVAX-S-N的构建及体外表达[J].中国兽医学报,2009,29(3):254-257.
[10]杨恒,黄小波,文心田,等.猪粒细胞-巨噬细胞集落刺激因子(pGM-CSF)基因的克隆与原核表达研究[J].农业生物技术学报,2009,17(2):206-211.
[11]Egan M A,Israel Z R.The use of cytokines and chemokines as genetic adjuvants for plasmid DNA vaccines[J].Clin Appl Immunol Rev,2002,2:255-287.
[12]Schwager J,Schulze J.Maturation of the mitogen responsiveness,and IL2and IL6production by neonatal swine leukocytes[J].Vet Immunol Immunopathol,1997,57(1-2):105-119.
[13]Yang Heng,Chao San-jie,Wen Xin-tian,et al.Intragastric adm inistration of attenuated Salmonella typhimurium harbouring transmissible gastroentritis coronavirus(TGEV)DNA vaccine induced specific antibody production[J].Vaccine,2009,27(37):5035-5040.

