JAB1对缺氧环境肺癌A549细胞化疗敏感性调控的研究*
胡明冬,徐剑铖△,杨 昱,徐 静,周长喜,毛 梅,王 艺
(1.第三军医大学新桥医院全军呼吸内科研究所,重庆400037;2.解放军总医院南楼呼吸内科,北京100039;3.广州军区武汉总医院呼吸内科,武汉430061)
JAB1对缺氧环境肺癌A549细胞化疗敏感性调控的研究*
胡明冬1,徐剑铖1△,杨 昱1,徐 静1,周长喜2,毛 梅3,王 艺1
(1.第三军医大学新桥医院全军呼吸内科研究所,重庆400037;2.解放军总医院南楼呼吸内科,北京100039;3.广州军区武汉总医院呼吸内科,武汉430061)
目的 观察导入pcDNA3.1-HRE-JAB1真核表达质粒的肺癌A549细胞,在低氧环境下对健择(Gemzar)的化疗敏感性,以期找到一种提高肺癌化疗敏感性的方法。方法 首先构建缺氧反应元件启动的pcDNA3.1-HRE-JAB1真核表达质粒,鉴定后将该质粒导入肺癌A549细胞。在低氧环境培养过程中加入化疗药物Gemzar,观察空白组(A549)、空载体组(A549+pcDNA3.1-HRE)和质粒组(A549+pcDNA3.1-HRE-JAB1)肺癌A549细胞对Gemzar的敏感性。采用Real-time PCR和Western blot分别检测各组肺癌A549细胞中JAB1的mRNA和蛋白表达水平;流式细胞术检测各组肺癌A549细胞周期分布和凋亡情况。结果 通过双酶切鉴定,确定构建获得了pcDNA3.1-HRE-JAB1质粒。在有化疗药物Gemzar的情况下,质粒组分别与空白组或空载体组比较,质粒组肺癌A549细胞中JAB1mRNA和蛋白表达水平明显增加(P<0.01),细胞凋亡率明显增加(P<0.01),而细胞周期被明显阻滞于G1期(P<0.01)。结论 JAB1在低氧环境下高表达提高了药物Gemzar化疗的敏感性,这将可能成为一种理想的提高肺癌或其他实体恶性肿瘤化疗敏感性的手段。
A549细胞;JAB1;耐药;健择;化疗敏感性
在肿瘤中肺癌的发病率最高,尽管采用了许多方法进行治疗,患者的5年生存率仍只有14%左右[1]。通常情况下,肺癌细胞受到化疗药物作用后,绝大部分细胞死亡或凋亡,而小部分细胞由于缺氧,无法启动细胞内部正常的凋亡程序,仅出现亚致死损伤或潜在致死性损伤,最终导致化疗不彻底并出现对化疗药物的抗性[2],所以,采用各种方法促使这部分缺氧肺癌细胞的死亡是克服化疗耐药甚至彻底治愈肿瘤的重要策略。近年来,随着对肿瘤乏氧区细胞特性的深入研究,为改善乏氧细胞的耐药提供了可能的途径。在诸多方法中,促凋亡基因的应用对促进肿瘤细胞的凋亡是一个极有前景的方法[3]。因此,本实验拟在低氧环境下培养肺癌A549细胞(模拟乏氧区癌细胞),导入含JAB1凋亡基因的质粒,观察在化疗药物作用下化疗敏感性的变化,以找到更好的治疗肺癌甚至其他肿瘤的方法。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 肺腺癌细胞株A549,由本实验室保存。
1.1.2 主要试剂 Taq酶、DNaseI(RNase free,TaKaRa公司);PCR引物(上海英骏生物技术公司合成);胎牛血清、胰蛋白酶、RNA提取试剂Tripure reagent(Roche公司,美国);MMLV Reverse Transcriptase(Promega公司);Gemzar(F.H.Faulding公司,澳大利亚);阳离子脂质体LipofectamineTM2000(上海英骏生物技术公司)。
1.1.3 主要仪器 Bio-Rad核酸蛋白测定仪;192型Sub-Cell电泳槽和全自动凝胶成像系统(Bio-Rad公司,美国);2720型PCR仪(ABI公司,美国);FACScan型流式细胞仪(Becton Dickinson公司,美国)。
1.2 实验方法
1.2.1 构建人pcDNA3.1-HRE-JAB1真核表达质粒 从基因库获得人JAB1基因序列,利用生物软件Premier5.0设计引物,通过RT-PCR获得人完整JAB1基因片断,利用酶切方法合成真核表达质粒pcDNA3.1-JAB1,并经过测序鉴定,人工合成缺氧反应元件启动子(HIF-1/HRE)串联重复序列,利用酶切方法将串联重复系列插入到pcDNA3.0质粒CMV启动子上端,获得重组质粒pcDNA3.1-HRE-JAB1,通过双酶切法进行鉴定。
1.2.2 pcDNA3.1-HRE-JAB1质粒转染、A549细胞的厌氧培养[4]及其JAB1基因mRNA表达水平的检测 细胞转染采用阳离子脂质体LipofectamineTM2000。在转染前1d,将A549细胞置于6孔培养板中,当细胞铺满培养板的面积达70%~80%时,即可进行转染。具体操作过程:首先,将A549细胞在含有质粒pcDNA3.1-HRE-JAB1(1ng)培养基中培养10h(质粒组);然后,将培养基更换为普通培养基培养48h。加入400 μg/mL遗传霉素G418(Roche公司,美国)培养14d筛选阳性细胞。相应地,对照组细胞转染pcDNA3.1-HRE空载体(空载体组)。在一个缺氧手套盒(Coylab,Grass Lake,美国)中,将A549细胞暴露于缺氧环境(0.3%O2)24h。同时,采用15 μg/mL健择(Gemzar)处理转染的细胞。另外,缺氧暴露后如需要更换培养液,需在用前将其在缺氧环境中平衡24h。低氧环境下培养后A549细胞中JAB1基因mRNA表达水平的变化通过2-△△CT方法[5]进行计算。
1.2.3 低氧培养后A549细胞JAB1蛋白表达水平的检测
收集A549细胞,立即加入150μL预冷去污剂裂解液,随后剧烈振荡15s,冰浴10min。随后以超声破碎细胞,100W,3次,每次约5s。接着12 000×g、4℃离心10min。按PIERCE蛋白测定试剂盒说明进行蛋白质定量检测,样本分装于-80℃冰箱中保存备用。将提取液的蛋白浓度调整一致,各取30μg蛋白经12%十二烷基磺酸钠聚丙烯酰胺凝胶电泳后,干法转膜至PVDF膜上,参数为15V,20min。
转膜结束后用含5%脱脂奶粉封闭4h,TBS洗膜3次,每次5min。随后分别加入鼠抗JAB1,Caspase-3单克隆抗体(BD Biosciences,美国)(1∶500),4℃过夜孵育。随后加入辣根过氧化物(HRP)标记兔抗鼠IgG(中山金桥生物科技有限公司,北京)(1∶3 000),4℃孵育2h。TBS洗膜2次,每次5 min。采用ECL着色,温育2min。进入暗室,将X光胶片压在PVDF膜上,依照发光的强度选择不同的曝光时间。将胶片放入显影液中,出现条带后,立即放入定影液中,流水冲洗胶片后晾干。对胶片进行扫描,然后用Bio-Rad成像系统分析目的条带的灰度值。结果判断,以JAB1的灰度值与β-actin的灰度值的比值表示JAB1蛋白相对表达水平。
1.2.4 A549细胞周期及凋亡检测 将1.0×104对数生长期细胞接种于96孔培养板中(100μL/well),按以下分组:A549+Gemzar(空白组),A549+pcDNA3.1-HRE+Gemzar(空载体组),A549+pcDNA3.1-HRE-JAB1+Gemzar(质粒组),每孔中加入浓度为15μg/mL的Gemzar进行试验观察。
各组厌氧培养48h后去上清液,收集细胞,PBS洗涤3次。采用70%乙醇固定,Annexin-V、PI双着色,用FACScan流式细胞仪进行检测。
2 结 果
2.1 pUC57-HRE-JAB1质粒的构建,双酶切鉴定 见图1。
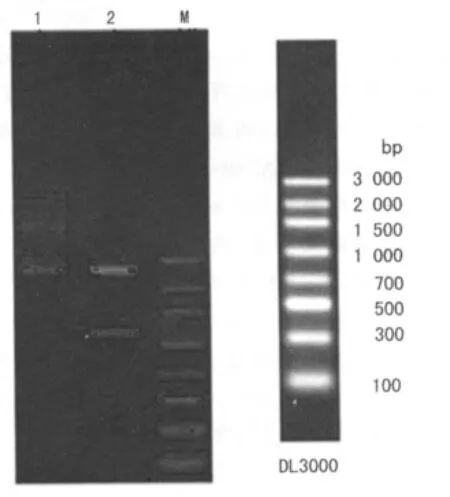
图1 pUC57-HRE-JAB1质粒的鉴定
2.2 pcDNA3.1-HRE-JAB1质粒导入对A549细胞中JAB1 mRNA表达水平的影响 pcDNA3.1-HRE-JAB1质粒导入后,与空白组或空载体组比较,质粒组JAB1mRNA表达水平明显升高(P<0.01),见表1。
表1 pcDNA3.1-HRE-JAB1导入对A549细胞中JAB1mRNA水平的影响±s,n=8)

表1 pcDNA3.1-HRE-JAB1导入对A549细胞中JAB1mRNA水平的影响±s,n=8)
*:P<0.01与空白组比较;#:P<0.01,与空载体组比较。
组别Fold change2-△△CT空白组1.3±0.3空载体组1.5±0.2质粒组2.9±0.4*#
2.3 pcDNA3.1-HRE-JAB1质粒导入对A549细胞中JAB1蛋白水平的影响 pcDNA3.1-HRE-JAB1质粒导入后,与空白组或空载体组比较,质粒组JAB1蛋白水平明显升高(P<0.01),见表2、图2。

图2 各组JAB1蛋白的表达
2.4 pcDNA3.1-HRE-JAB1导入对A549细胞周期与凋亡的影响 流式细胞仪检测结果提示在Gemzar存在的情况下,经pcDNA3.1-HRE-JAB1转染后,质粒组与空白组和空载体组比较,G0/G1期细胞数量明显增多(P<0.01),而G2/M期细胞数量明显减少(P<0.01),增殖指数(PI)明显降低(P<0.01),见表3、图3。
表2 pcDNA3.1-HRE-JAB1导入对A549细胞中JAB1蛋白水平的影响±s,n=8)

表2 pcDNA3.1-HRE-JAB1导入对A549细胞中JAB1蛋白水平的影响±s,n=8)
*:P<0.01,与空白组比较;#:P<0.01与空载体组比较。
组别JAB1蛋白水平空白组0.6±0.1空载体组0.7±0.2质粒组2.3±0.4*#
表3 pcDNA3.1-HRE-JAB1质粒导入对A549细胞周期分布的影响±s,%,n=8)

表3 pcDNA3.1-HRE-JAB1质粒导入对A549细胞周期分布的影响±s,%,n=8)
*:P<0.01与空白组比较;#:P<0.01与空载体组比较。PI=(S+G2M)/(G0/G1+S+G2M)。
组别G0/G1期S期G2/M期PI期空白组62.3±5.3 35.9±3.4 2.8±0.6 38.7±4.2空载体组62.1±5.5 35.7±3.6 3.2±0.7 38.9±4.8质粒组72.9±5.6*#26.0±2.5*#1.1±0.4*#27.1±2.4*#
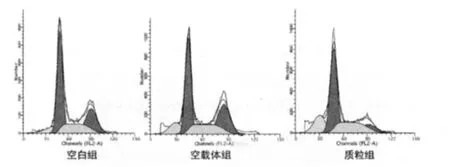
图3 pcDNA3.1-HRE-JAB1导入对A549细胞周期与凋亡的影响
3 讨 论
化疗是肺癌治疗最常采用的一种方法。通常情况下,化疗药物将使大多数肿瘤细胞发生致死性杀伤或凋亡,然而少数仍会存活,研究发现它们主要位于肿瘤缺氧区[6]。因缺氧导致化疗药物细胞毒所需的氧供不足而导致肿瘤细胞耐药;同时,由于肿瘤细胞增殖活跃,氧供与氧耗的失衡也将导致耐药发生[7]。有研究者通过转染化疗敏感基因,使其表达增强来降低化疗耐药,实验过程中发现在阳离子脂质体介导的p16INK4a和p14ARF基因转染导入A549细胞后,细胞凋亡和化疗的敏感性有所增加,但未取得预想的效果[8]。其原因可能是由于它们低的转染效率及靶向特异性差,且它们在细胞周期调控路径中具有双重作用,既诱导细胞凋亡,也可阻滞细胞周期,因此,虽然它们在一定程度上发挥了作用,但难以取得令人满意的效果。
而近年来发现的抑癌基因JAB1,是目前所发现的惟一专职促进癌细胞凋亡的基因[9]。一系列的研究发现,将JAB1基因导入乳腺癌细胞中可明显降低p27kip1的表达水平;同样鼻咽癌组织中p27kip1表达与其增殖活性与侵袭能力密切相关[10];Liu等[11]发现JAB1与BclGs(Bcl-Gonad short form)的共表达可协同诱导HeLa细胞的凋亡,JAB1能够与Bcl-XL/Bcl-2竞争结合到BclGs上,从而促进细胞凋亡。相反,当通过RNAi技术沉默JAB1基因时,BclGs的前凋亡效应明显减弱。因此,以上实验均表明,当机体组织中JAB1高表达时,癌细胞往往能发生有效的凋亡。
研究发现机体肺癌乏氧区JAB1基因表达往往很低,因此,必须找到JAB1在低氧条件下高表达的方法。本实验设想如果能构建出在厌氧环境下能高表达JAB1的质粒,将其导入肺癌乏氧区细胞,那么,它们对化疗药物敏感性就可能提高。有研究表明,缺氧诱导因子-1(HIF-1)是哺乳动物中的一种转录因子,于1993年在缺氧诱导的细胞中被确认[12]。在缺氧条件下,HIF-1的表达受缺氧反应元件启动子(HIF-1/HRE)的调控[13],而HIF-1/HRE可明显促进目的基因在缺氧环境中表达[5]。因此,本研究首先扩增人类JAB1全长片段,随后将其插入pcDNA3.1载体构建pcDNA3.1-HRE-JAB1真核表达质粒,并将该质粒导入在低氧环境培养下的A549细胞中,通过qRT-PCR与Western blot检测质粒转染后的细胞表达JAB1基因情况,与空白组或空载体组比较,质粒组JAB1的mRNA和蛋白水平均明显升高,表明pcDNA3.1-HRE-JAB1质粒可在缺氧环境中高表达JAB1。
本实验证实高表达的JAB1基因能在厌氧环境下提高A549细胞的化疗敏感性。导入pcDNA3.1-HRE-JAB1质粒转染的A549细胞在厌氧环境培养下,使用化疗药物Gemzar后,发现较空白组和空载体组G0/G1期细胞数量明显增多,而G2/M期细胞数量明显减少,增殖指数(PI)明显降低,也就是A549细胞周期明显阻滞于G1期以前,细胞的分裂减少,A549细胞凋亡增多。与Tomoda等[14]研究结果在某种程度上基本一致,他发现JAB1-/-小鼠的胚胎细胞增殖缓慢,且细胞周期延迟于G0和S期之间。因此,JAB1具有通过调节细胞周期信号通路发挥控制细胞周期进程和促进细胞凋亡的作用。
综上所述,本实验发现在A549细胞中导入含JAB1凋亡基因的质粒能在低氧环境下高表达JAB1,且比单独使用化疗药A549细胞凋亡明显增多,实现了低氧环境下JAB1基因增强A549细胞对化疗药物的敏感性,因此,可能找到了一种克服肺癌化疗耐药的方法。
[1]Toh CK.The changing epidemiology of lung cancer[J].Methods Mol Biol,2009,472(5):397-411.
[2]Harrison L,Blackwell K.Hypoxia and anemia:factors in decreased sensitivity to radiation therapy and chemotherapy?[J].Oncologist,2004,56(1):31-40.
[3]Yang QC,Zeng BF,Shi ZM,et al.Inhibition of hypoxiainduced angiogenesis by trichostatin A via suppression of HIF-1aactivity in human osteosarcoma[J].J Exp Clin Cancer Res,2006,25(10):593-599.
[4]Maher JC,Wangpaichitr M,Savaraj N,et al.Hypoxia-inducible factor-1confers resistance to the glycolytic inhibitor 2-deoxy-D-glucose[J].Mol Cancer Ther,2007,6(12):732-741.
[5]Semenza GL.HIF-1:mediator of physiological and pathophysiological responses to hypoxia[J].J Appl Physiol,2000,88(10):1474-1480.
[6]Bell EN,Tse MY,Frederiksen LJ,et al.Atrial natriuretic peptide attenuates hypoxia induced chemoresistance in prostate cancer cells[J].J Urol,2007,177(2):751-756.
[7]Yasuda H.Solid tumor physiology and hypoxia-induced chemo/radio-resistance:novel strategy for cancer therapy:nitric oxide donor as a therapeutic enhancer[J].Nitric Oxide,2008,19(6):205-216.
[8]Xie QC,Hu YD,Wang LL,et al.The co-transfection of p16(INK4a)and p14(ARF)genes intohuman lung cancer cell line A549and the effects on cell growth and chemosensitivity[J].Colloids Surf B Biointerfaces,2005,46(3):188-196.
[9]Park CM,Park MJ,Kwak HJ,et al.Induction of p53-mediated apoptosis and recovery of chemosensitivity through p53transduction in human glioblastoma cells by cisplatin[J].Int J Oncol,2006,28(1):119-125.
[10]Kouvaraki MA,Rassidakis GZ,Tian L,et al.Jun activation domain-binding protein 1expression in breast cancer inversely correlates with the cell cycle inhibitor p27Kip1[J].Cancer Res,2003,63(11):2977-2981.
[11]Liu X,Pan Z,Zhang L,et al.JAB1accelerates mitochondrial apoptosis by interaction with proapoptotic BclGs[J].Cell Signal,2008,20(3):230-240.
[12]Wang GL,Semenza GL.General involvement of hypoxiainducible factor 1in transcriptional response to hypoxia[J].Proc Natl Acad Sci USA,1993,90(11):4304-4308.
[13]Post DE,Van Meir EG.Generation of bidirectional hypoxia/HIF2responsive expression vectors to target gene expression to hypoxia cells[J].Gene Ther,2001,56(8):1801-1807.
[14]Tomoda K,Yoneda-Kato N,Fukumoto A,et al.Multiple functions of JAB1are required for early embryonic development and growth potential in mice[J].J Biol Chem,2004,279(8):43013-43018.
Investigation on human lung cancer cell A549 chemotherapeutic sensitivity regulated by JAB1 in anaerobic condition*
Hu Mingdong1,Xu Jiancheng1△,Yang Yu1,Xu Jing1,Zhou Changxi2,Mao Mei3,Wang Yi1
(1.Institute of Respiratory Diseases of PLA,Xinqiao Hospital,Third Military Medical University,Chongqing400037,China;2.Department of Respiratory Diseases,General Hospital of PLA,Beijing100039,China;3.Department of Respiratory Diseases,Wuhan General Hospital of Guangzhou Military Command,Wuhan 430061,China)
ObjectiveTo find the way of improving the lung cancer chemotherapeutic sensitivity,we investigated whether the lung cancer A549cells introduced eukaryotic expression plasmid pcDNA3.1-HRE-JAB1plasmid have the chemotherapeutic sensibility to Gemzar in anaerobic condition.MethodsWe first constructed an eukaryotic expression plasmid pcDNA3.1-HRE-JAB1 driven by hypoxia response elements promoter.Then,the plasmid was introduced into lung cancer cell line A549.After that,chemotherapeutic drug such as Gemzar was used to treat the A549cells in anaerobic condition,and investigated that the normal control(A549),the empty vector group(A549+pcDNA3.1-HRE)and the plasmid group(A549+pcDNA3.1-HRE-JAB1)A549cells had chemotherapeutic sensitivity.qRT-PCR and Western blot was used to assay the mRNA and protein level of JAB1.Cell cycle and apoptosis of A549cells were also assayed according to flow cytometry.ResultsAccording to bi-enzyme digestion evaluation,obtained plasmid was pcDNA3.1-HRE-JAB1plasmid.The results showed that JAB1in the A549was overexpressed after the transfection of pcDNA3.1-HRE-JAB1compared with the normal control and the empty vector(P<0.01).The cell proliferation was arrested at G1phase and the cell apoptosis was significantly enhanced after the transfection(P<0.01).ConclusionJAB1overexpression significantly increase sensitivity of lung cancer cells to the chemotherapeutic drug Gemzar in anaerobic condition,which might provide an efficient strategy of improving the chemotherapeutic sensitivity of lung cancer or the other cancers.
A549cell;JAB1;drug resistance;Gemzar;chemotherapeutic sensitivity
book=2345,ebook=24
10.3969/j.issn.1671-8348.2012.23.001
A
1671-8348(2012)23-2345-03
国家自然科学基金资助项目(30801366)。△
,Tel:(023)68755003;E-mail:xu822036@sohu.com。
2011-10-09
2012-01-06)
△通讯作者,Tel:15825902443;E-mail:yaoyeye1987@163.com。

