中药中速灭威残留量的酶联免疫检测方法
张曙光,王俊平,生 威,张 燕,王 硕
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
中药中速灭威残留量的酶联免疫检测方法
张曙光,王俊平,生 威,张 燕,王 硕
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
建立了直接竞争酶联免疫法(ELISA)测定金银花、枸杞、人参、板蓝根、大青叶和圆弧止痛片为代表的中药中速灭威的残留量.金银花等经过粉碎,加入甲醇提取、旋蒸、PBS复溶等简单前处理之后,再经过适度的稀释可以达到消除基质影响,用ELISA进行测定.中药样品添加回收率为64.00%~91.30%,变异系数均小于30.12%.结果表明,该方法可以简单、快速、灵敏、准确地检测出金银花、枸杞、人参、板蓝根、大青叶和圆弧止痛片等中药中速灭威的残留量.关键词:ELISA;中药;速灭威;检测
1 材料与方法
1.1 药材、试剂及仪器
金银花(Lonicera chrysantha)、枸杞(Lycium chinense)、人参(Radix Ginseng)、板蓝根(Radix Isatidis)、大青叶(Folium Isatidis)、元胡止痛片(Yuanhu painkillers),天津市塘沽区某药店;速灭威标准品、吐温20、3,3',5,5'–四甲基联苯胺(TMB),美国Sigma公司;小牛血清蛋白(BSA),Merck 公司;速灭威抗体、辣根过氧化物酶(HRP)酶标抗原,天津市食品营养与安全重点实验室.
酶标仪,Thermo 公司;单道、8道微量可调移液器,Gilson 公司;涡旋混合器,北方同正公司;离心机,德国Eppendorf公司;旋转蒸发仪,上海亚荣生化仪器厂;442404酶标板,NUNC公司.
1.2 直接竞争酶联免疫法的建立
包被:抗体每孔1,μg包被在酶标板上,室温孵育过夜或37,℃孵育3,h,PBST洗板3次.
封闭:用封闭液(每孔200, μL,1%BSA)室温封闭1,h,然后弃去封闭液,PBST洗板3次.
酶标抗原和标样(或样品提取液):每孔先加入100,μL速灭威标准品溶液或样品提取稀释液,再加入100,μL适当稀释度的酶标抗原,以不加速灭威标样的孔为对照.室温孵育1,h,PBST洗板4次.
显色:在每个孔中加入150,μL显色液3,3',5,5'–四甲基联苯胺(TMB)进行显色,加入底物溶液后,底物在酶作用下水解成色,室温下反应20,min,颜色反应的深浅与标本中相应抗原(抗体)的量成正比.
终止反应:在每孔中加入50,μL终止液,终止反应.
测定吸光度:在双波长方式(450,nm为测定波长,650,nm为参考波长)下,用酶标仪测定吸光度(A).
计算不同浓度的速灭威对抗体与酶标抗原结合的抑制率.

以抑制率为纵坐标,速灭威标品质量浓度(ρ,单位为ng/mL)的对数为横坐标绘制标准曲线,求出灵敏度即抑制终浓度(IC50)和最低检出限(IC15).
1.3 样品的前处理
对6种样品进行样品基质影响和消除的研究,经检测不含有速灭威农药.加标实验中,向各样品中分别添加50、100、200,µg/kg的速灭威标准品,将加标样品充分混匀,称取1,g样品,用10,mL有机溶剂提取,涡旋振荡5,min后,5,000,r/min离心5,min,吸取上清液,过0.22,µm的有机膜.将上述过膜后的液体用PBS稀释不同的倍数,并添加吐温20或BSA 或明胶作为掩蔽剂,消除基质影响.
1.4 样品的添加回收
所有样品经岛津高效液相色谱仪检测,结果均为阴性. 在这些阴性样品中分别添加50、100、200,µg/kg的速灭威标准品,每个水平作 3次平行实验,添加后振荡混匀,处理后进行直接竞争酶联免疫检测.
2 结果与分析
2.1 标准曲线的绘制
确定了速灭威直接竞争ELISA检测中抗体包被浓度为每孔1.0,µg,酶标抗原稀释度为1﹕8,000.标准品用PBS缓冲溶液从2,000,μg/L开始5倍梯度稀释得到6个浓度,以直接竞争ELISA法,得到不同速灭威浓度的450~650,nm吸光度,根据吸光度值计算抑制率,绘出速灭威标准曲线,如图1所示.本法测定的速灭威灵敏度IC50为(32.9±0.50)μg/L,检测限为(2.5±0.09)μg/L.
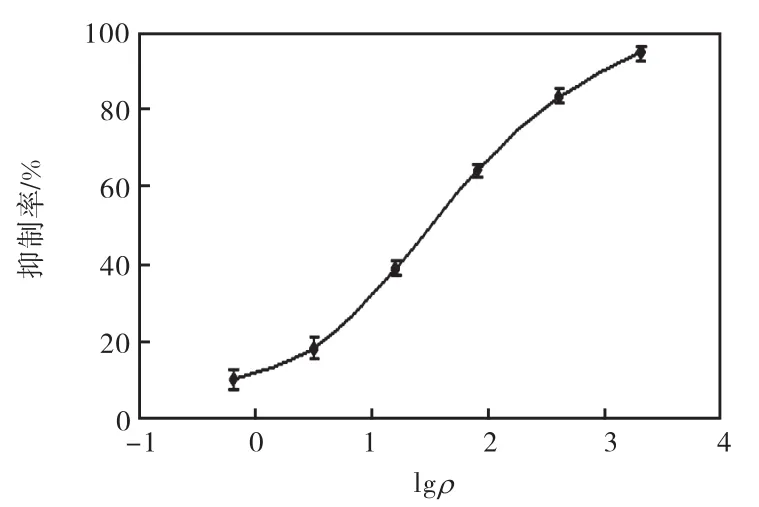
图1 速灭威直接竞争ELISA标准曲线Fig. 1 Standard curve of Metolcarb competitive direct ELISA
2.2 提取溶剂的选择
提取是农药残留分析步骤中很关键的一步.提取溶剂的选择与待测农药性质、检测方法及样本种类有关[9].根据“相似相溶”原理,应选择与待测农药极性相似的溶剂,并要求提取溶剂的沸点应为40~50,℃,既能溶解待测农药,又不能与待测农药发生反应.同时要考虑检测器检测时的要求[10].为提高提取效率也可以使用两种或两种以上的混合溶剂提取,但这无疑增多了实验步骤,对快速检测方法无益.因此,在保证提取效率的前提下,最好选用单种有机溶剂提取.对含水量高的样本,要选择与水能相混溶的溶剂,还应考虑溶剂对样本的渗透能力等,以便将样本组织中的待测农药充分提取出来[11].在农药残留分析中,根据农药极性、样本性质等选择不同极性的提取剂[12],目前应用最广泛的溶剂是甲醇或丙酮,它们能很好地溶解大多数农药.但丙酮会大量提取植物组织中的油脂和色素[7,13],对下一步的检测带来困难,并且会降低方法灵敏度.甲醇对氨基甲酸酯类农药提取率较高、效果好,本实验用甲醇作为提取溶剂.
2.3 基质影响的消除
酶联免疫技术之所以能够在快速检测中得到发展,主要是因为酶联免疫检测方法检测线灵敏,而且其前处理相对简单.提取后只需经适度稀释,必要的时候还需加合适的掩蔽剂(明胶、BSA、乳粉等)[14-15].中药成分复杂,提取液中含有的色素、糖、植物蛋白、脂肪及提取溶剂等均能对抗原抗体的结合产生干扰,这种基质效应会降低标准曲线的灵敏度和方法的可靠性.本实验发现,在稀释的基础上适当地加一些掩蔽剂即可以消除基质影响,使基质曲线与标准曲线重合.
以板蓝根为例,将上清液在旋转蒸发仪上蒸干后,用总体积为1,mL的不同比例甲醇和PBS复溶,过膜后再用PBS稀释20、50、100、200、300倍,基质影响的消除结果如图2所示.

图2 不同稀释倍数的板蓝根样品中基质影响的消除Fig. 2 Different dilution to remove the matrix effect of Radix Isatidis
由图2可知,稀释300倍后基质曲线和标准曲线基本重合.在稀释300倍的基础上,以0.1%BSA和0.05% 吐温20作掩蔽剂,能达到很好的基质消除效果,如图3所示.

图3 速灭威直接竞争ELISA抑制率曲线与吸光度曲线(n=10)Fig. 3 Inhibition ratio curve and absorbance curve of competitive direct ELISA Metolcarb(n=10)
板蓝根的基质与标准品的抑制率曲线和吸光度值曲线几乎完全重合,基质影响基本消除.其他中药同上述方法,金银花、枸杞、人参、大青叶和元胡止痛片的稀释倍数分别是200、100、300、400、400倍;其中金银花、枸杞用0.5%的明胶和0.05%的吐温,大青叶、人参用0.1%的BSA和0.05%的吐温,元胡止痛片用0.3%的BSA和0.05%的吐温分别作为掩蔽剂,可以使标准曲线和吸光度值曲线完全重合.由于没有太多相关的限定标准,稀释后的灵敏度仍能满足检测的要求.
2.4 添加回收实验
在不同中药样品中分别添加不同含量的速灭威,用酶联免疫法检测计算回收率,每个水平作 3次平行实验,结果见表1.由表1可知,直接竞争酶联免疫法的回收率在64.00%~91.30%之间,变异系数小于30.12%.

表1 直接竞争ELISA添加回收实验(n=3)Tab. 1 Recovery test in ELISA(n=,3)
3 结 语
本研究建立了对中药中速灭威残留量的直接竞争酶联免疫分析方法.该方法样品处理简单,只需经适度稀释就能达到消除基质的目的,并且与国内及日本肯定列表规定的其他食品的限定标准相一致,灵敏度仍能满足检测要求.此法有开发成商品试剂盒的潜力.
[1] 祝贺,宋爱华,田杨,等. GC-MS 法同时测定中药材中29种农药残留量[J]. 沈阳药科大学学报,2007,24(6):342-343.
[2] 赵燕燕,孙启时. 中药中重金属和农药残留的研究[J].药学实践杂志,2000,18(5):272-274.
[3] 李艳霞. 中药中有机农药残留量检测方法的研究[D].南昌:南昌大学,2005.
[4] 吴伯平. 德国中药检测标准[J]. 中国中医药信息杂志,1995,2(9):38-39.
[5] 李萍,王绪卿. 肉及蛋类食品中氨基甲酸酯类农药多组分残留高效液相色谱分析[J]. 卫生研究,2002,31(6):466-468.
[6] 向增旭,赵维佳,郭巧生. 金银花中18种有机磷农药残留量分析方法的研究[J]. 中国中药杂志,2006,31(16):1321-1323.
[7] 郭金生. 速灭威–辛硫磷乳油反相高效液相色谱法同柱分析[J]. 河北北方学院学报:自然科学版,1996,12(2):36-38.
[8] Sun J W,Dong T T,Zhang Y,et al. Development of enzyme linked immunoassay for the simultaneous detection of carbaryl and metolcarb in different agricultural products[J]. Analytica Chimica Acta,2010,666 (1/2):76-82.
[9] 薛健,金红宇,田金改,等. 中药农药残留问题研究与思考[J]. 中草药,2007,38(10):1578-1581.
[10] 张艳. 农药残留分析中不同提取溶剂的评价[J]. 甘肃农业科技,2006(9):28-29.
[11] 冯秀琼,汤庆勇. 中草药中14种有机磷农药残留量同时测定:微波辅助提取法[J]. 农药学学报,2001,3(3):45-52.
[12] 张奇. 速灭威等化学农药免疫速测技术研究[D]. 南京:南京农业大学,2004.
[13] 白青云,刘长武,买光熙,等. 化学衍生气相色谱法测定速灭威在水稻组织中的残留[J]. 农药,1984(6):38-39.
[14] Sun J W,Liu B,Zhang Y,et al. Development of an enzyme-linked immunosorbent assay for metolcarb residue analysis and investigation of matrix effects from different agricultural products[J]. Analytical and Bioanalytical Chemistry,2009,394(8):2223-2230.
[15] Iijima M,Matsuzaki T,Kadoya H,et al. Bionanocapsulebased enzyme-antibody conjugates for enzyme-linked immunosorbent assay[J]. Analytical Biochemistry,2010,396(2):257–261.
责任编辑:郎婧
Metolcarb Residue Analysis Using ELISA in Chinese Herbal Medicines
ZHANG Shuguang,WANG Junping,SHENG Wei,ZHANG Yan,WANG Shuo
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
A direct competitive ELISA was established in detecting Metolcarb residues in Chinese herbal medicines,such as Lonicera chrysantha,Lycium chinense,Radix Ginseng,Radix Isatidis,Folium Isatidis and Yuanhu painkillers. After Lonicera chrysantha and so on were mashed and homogenized,methanolextraction, rotary steaming,and PBS were used to make up to volume. Moderate dilution then could eliminate the influence of matrix,which was detected by ELISA. In Chinese herbal medicines,the recovery rate was 66%-91%,with variation coefficient less than 30%. The method is simple,quick,sensitive and accurate in detecting the Metolcarb residues in Chinese herbal medicines.
ELISA;Chinese herbal medicines;Metolcarb;determination
R932
A
1672-6510(2012)03-0021-04
随着中医药事业的发展,中医药在世界范围内的防病和治病作用受到越来越多的关注,但中药却不为国际承认,主要原因在于中国的中药及其制剂缺乏完备合理的质量控制标准,包括中药及其制剂有效成分质与量的控制以及中药材及其制剂中有毒、有害成分(杂质)的种类和量值控制[1].而且野生药材资源日渐枯竭,人们将许多中药进行人工种植.在种植过程中为了提高产量而广泛使用农药,随之带来中药材农药残留问题,使药材质量受到影响[2].
现有国内外对农产品及环境中化学农药的残留分析大多采用仪器分析法、生物测定和生化测定法[3–4],我国目前进行农药残留检测最常用的手段有高效液相色谱法(HPLC)[5–6]、气相色谱法(GC)[7]、液–质联用(HPLC/MS)和气–质联用(GC/MS)等[2].液相色谱法检测多种农药易出现某些待测组分因分离效果不佳而可能导致的定性困难的缺点,气相色谱质谱法则成本较高[8],而且仪器分析因其繁复的前处理使现场检测受到限制.酶联免疫学法检测灵敏度高、重复性好、成本低廉、简便快捷、样品容量大、时间短.国内外用酶联免疫学法或酶免技术与其他技术相结合的检测方法检测食品中的速灭威残留的相关报道甚多,而对中药材的检测分析却未有文献报道.因此,本研究建立了直接竞争酶联免疫法(ELISA),测定金银花、枸杞、人参、板蓝根、大青叶和圆弧止痛片为代表的中药中农药速灭威的残留量.
2011-12-25;
2012-03-13
国家科技重大专项课题(2009ZX09502-027)
张曙光(1986—),女,河北人,硕士研究生;通信作者:王 硕,教授,s.wang@tust.edu.cn.

