亚氯酸盐对大鼠仔鼠的运动神经毒理学影响
吴明松,张玉玲,李绍峰,冉治霖,李百祥,黄君礼
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.东北大学秦皇岛分校,066004河北秦皇岛;3.华北电力大学环境科学与工程学院,071003河北保定;4.深圳职业技术学院建筑与环境工程学院,518055广东深圳;5.哈尔滨医科大学公共卫生学院,150006哈尔滨)
二氧化氯(ClO2)因其广谱消毒且不生成三卤甲烷的优良特性,作为液氯的替代消毒剂在饮用水消毒中广泛使用[1-2].ClO2在饮用水消毒中的主要副产物为亚氯酸盐(ClO2-),其毒理学特性一直备受关注.已有报道表明:200mg/L的亚氯酸钠(NaClO2)溶液实际无毒,也无明显蓄积毒性[3-4];800mg/L的NaClO2水溶液也无致癌作用[5].但ClO2-会降低新生大鼠的探索能力,使大脑皮层树突脊计数和突触形成发生改变[6],对神经发育行为有潜在影响[7].美国化学品制造协会进行的一项两代大鼠繁殖发育实验表明:接触300mg/L剂量的大鼠出生时至哺乳期体重较轻,绝对脑重略低,且对于听觉惊吓刺激反应明显下降[8-9].基于此,美国环保署规定饮用水中ClO2-的最大污染水平LMC(maximun contaminant level)为1.0mg/L,最大污染水平目标值GMCL(maximun contaminant level goal)为0.8mg/L[10],为 ClO2在饮用水中的应用提供了理论依据.现有报道主要集中在ClO2-的生殖发育、血液学等毒理效应,关于神经发育毒性的研究尚不充分.本文首次揭示ClO-2对运动神经发育的影响,对于扩大ClO2的应用具有理论意义.
1 实验
1.1 实验材料
亚氯酸钠购于天津津亚化工有限公司,质量分数为99.7%,主要杂质为氯酸钠、氢氧化钠和氯化钠.用蒸馏水配制成质量浓度30、120和360 mg/L的ClO2-溶液作为受试物.每周配制1次并标定,以确保其质量浓度的均一、稳定.
1.2 实验动物及饲养条件
选用出生5周龄的SPF级wistar大鼠雌120只、雄60只作为F0代(购于北京维通利华实验动物技术有限公司).动物置于不锈钢笼具,饲养于SPF级屏障系统中[11-12],温度为20~23℃,湿度为50%~70%,明暗控制为12h明/12h暗,换气次数为12次/h.所有动物喂饲常规基础饲料(购于哈药集团制药总厂,各组分质量分数为玉米73.5%,麦麸20%,鱼粉5%,骨粉1%,食盐0.5%),通过带吸管的聚丙烯瓶随意饮用纯水或受试物.
1.3 实验方法
1.3.1 分组及繁殖
动物购入后于实验室适应性饲养1周,确认正常后开始试验.大鼠按体重随机分为4组,每组均有雌鼠30只、雄鼠15只.4组动物分别设为对照组、低、中、高剂量组.摄入剂量依次为30、120和360mg/L,哺乳期剂量减半.
试验组大鼠出生第6周后通过自由摄水方式连续染毒,6周后雌雄合笼交配,得a窝.在a窝断乳10d后进行第2次交配,得b窝,共繁殖3代.F1a、F2a和F3a用于各项毒理学指标的测试,F1b和F2b作为下一代的亲代.雌雄亲代大鼠染毒期分别持续至泌乳期结束和交配结束.
1.3.2 前后肢肌力测定
前肢握力:将仔鼠平放在一50cm×40cm、网孔为1cm2的金属网格上,然后翻转180°使其倒挂在网格上,同时秒表计时,如超过2min,则记为2min.每只测3次,每次间隔5min,取均值.后肢撑力指数:后肢用墨水标记,手抓背部,使其水平方向位于光滑平台上方32cm,松手后,准确记录双侧后肢爪尖滑开的最远距离,每只测4次,每次间隔5min,取均值.
1.3.3 脏器系数及病理组织学检查
取雌雄仔鼠各10只于PND11和PND64检查.先用体积分数10%的水合氯醛溶液麻醉断头处死,对PND11仔鼠总脑称重;对PND64仔鼠总脑、海马和小脑称重,并计算脏器系数.另取部分PND11和PND64仔鼠处死后,于3min内取出整脑于体积分数10%甲醛中固定.包埋、切片、H&E染色后镜下观察大脑、海马和小脑的病理组织学变化.
1.4 数据处理
数据采用SPSS17.0统计软件包进行统计学处理,多组样本均数的比较采用单因素方差分析[13].若资料符合正态分布,且各组方差齐性,选用LSD检验,若方差不齐选用Tamhane'sT2检验.
2 结果与讨论
2.1 亚氯酸盐对运动能力的影响
F1a仔鼠无异常现象.F2a仔鼠在PND21时,高剂量组2只雄鼠、7只雌鼠和中剂量的1只雌鼠、1只雄鼠行走异常,表现为后肢不能完全站立,严重者双后肢拖拉无法正常行走.F3a仔鼠在PND13时,高剂量组有1只雌鼠、2只雄鼠眼睑半睁并有分泌物,4、5 d 后恢复正常.其余未见异常.F2a及F3a的行走异常现象说明通过乳汁摄入ClO2-可引起后肢肌力减弱,甚至导致自行觅食困难而死亡,部分未死仔鼠恢复正常又表明此现象可逆.
各代仔鼠PND21和PND63时前后肢肌力结果见表1.可以看出,F2a、F3a雌鼠高剂量组握力时间远小于对照组,F1a和F2a代仔鼠在PND21和PND63时,对照组后肢撑力结果与3个剂量组间差异无统计学意义.F3a仔鼠雄性PND21时,中剂量组后肢撑力距离比对照组稍有增加,差异有统计学意义,但高剂量组与对照组之间无统计学意义.上述结果说明ClO2-对仔鼠(特别是雌鼠)的四肢肌力有影响.但并没有确定的剂量效应关系.
2.2 亚氯酸盐对运动神经系统影响
各代仔鼠脏体比见表2.可以看出,各剂量组与对照组在PND11时总脑质量和PND64时仔鼠总脑、海马和小脑的脏体比之间差异均无统计学意义,说明亚氯酸盐对脑部的总体发育没有明显影响.
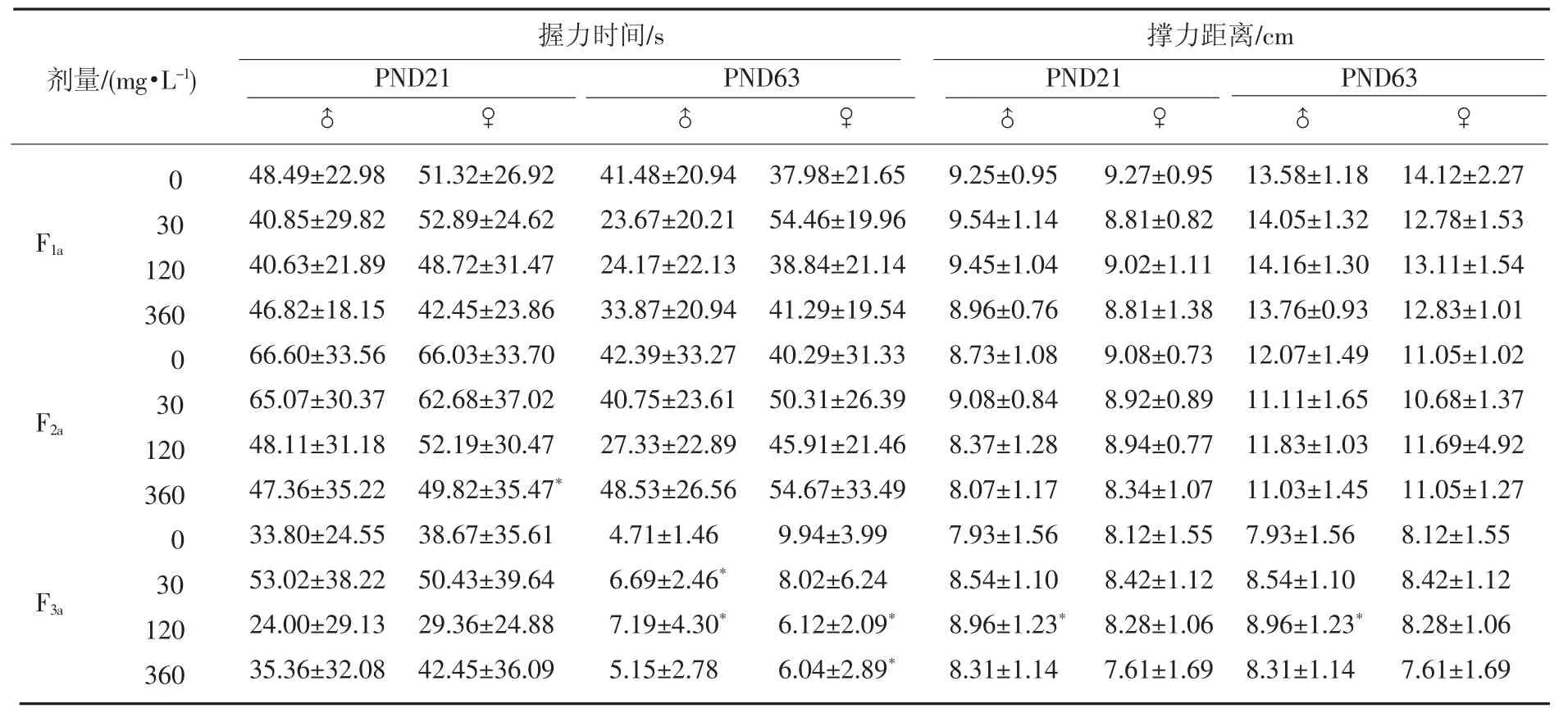
表1 各试验组仔鼠前肢握力时间和后肢撑力距离

表2 脑脏体比(×100)
2.3 脑病理组织学检查
仔鼠在PND11时,高、中、低剂量组与对照组相似,无病理变化.但F2a及 F3a高剂量组 PND63的多张脑组织病理图可见小脑局灶性白质脱髓(图1(a))、小脑白质血管周脱髓(图1(b))、小脑白质疏松出血(图 1(c))、浦氏细胞固缩(图1(d)).中剂量、低剂量和对照组未发现改变.
2.4 亚氯酸盐对人运动神经影响评价
综上并结合其他ClO2-对3代大鼠繁殖发育的影响研究(数据略),ClO2-对仔鼠神经发育的无明显副作用剂量为30 mg/L,约为4 mg/(kg·d);最低可观察副作用水平为 120 mg/L,约为15 mg/(kg·d).根据美国环保署的推导方法,取种内及种间差异系数为100,典型成人体重取70 kg,每日饮水量为2 L,设从饮水中摄取的
ClO2-占总量的80%,则可得

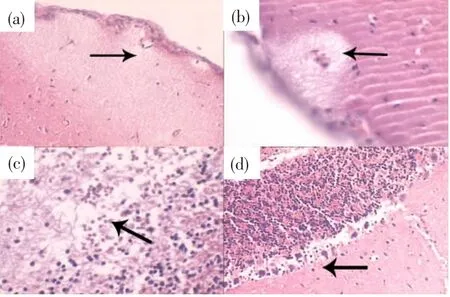
图1 部分患病仔鼠脑组织H&E染色照片
3 结论
1)长期接触360 mg/L的亚氯酸盐可引起个别第2代、第3代仔鼠小脑产生病变,造成运动神经伤,从而影响后肢肌力.
2)长期接触120和30 mg/L剂量的ClO-2并未对各代仔鼠表现出明显的运动神经毒性和明确的剂量效应关系.对于Wistar大鼠仔鼠运动神经发育的无明显副作用剂量为30 mg/L,经此推算而得的GMCL为1.1 mg/L.
[1] BLOCK S S.Disinfection,sterilization,and preservation[M]. Philadelphia:LippincottWilliams &Wilkins,2001.
[2]黄君礼.水消毒剂和处理剂——二氧化氯[M].北京:化工出版社,2010.
[3]王丽,黄君礼,李百祥.水中二氧化氯及副产物亚氯酸盐和氯酸盐一般毒性研究[J].化工标准计量质量,2001(3):33-37.
[4]WANG L,CHANG A,HUANG J.Ordinary toxicity of chlorine dioxide and by-products chlorite and chlorate in water[J].Journal of Donghua University,2003,20(3):108-112.
[5]王丽,黄君礼,李百祥.二氧化氯、亚氯酸盐和氯酸盐水溶液小鼠微核试验研究[J].哈尔滨建筑大学学报,2002,35(1):58-60.
[6]TOTH G P,LONG R E,MILLS T S,et al.Effects of chlorine dioxide on the developing rat brain[J].Journal of Toxicology and Environmental Health,1990,31(1):29-44.
[7] JOLLEY R L.Chlorination:chemistry,environmental impact and health effects[M].Chelsea:Lewis Publications,1990:347 -358.
[8]Chemical Manufacturers Association.Sodium chlorite:drinking water rat two-generation reproductive toxicity study[R].Washington D C:CMA,1996.
[9]GILL M W,SWANSON M S,MURPHY S R,et al.Two-generation reproduction and developmental neurotoxicity study with sodium chlorite in the rat[J].Journal of Applied Toxicology,2000,20:291-303.
[10]USEPA.National primary drinking water regulations:disinfectants and disinfection byproducts[S].Washington D C:USEPA,2009.
[11]中华人民共和国科技部.实验动物环境及设施[S].北京:中国标准出版社,2001.
[12]HEDRICH H J,BULLOCK G R.The laboratory mouse[M].San Diego:Elsevier Academic Press,2004.
[13]JONES D S.Pharmaceutical statistics[M].London:Pharmaceutical Press,2002.

