甘蓝型油菜ACCase、DGAT2和PEPC基因对氮素用量的应答
闫贵欣,陈碧云,许鲲,高桂珍,吕培军,伍晓明,李锋,李俊
(中国农业科学院油料作物研究所,农业部油料作物生物学与遗传育种重点实验室,湖北武汉 430062)
油菜是世界第二大油料作物,在世界油料作物中产量仅次于大豆位居第二,我国约57%的国产食用植物油来源于油菜籽[1]。因此,通过各种有效途径,如合理施肥等措施确保高水平菜籽油生产意义重大。由于油脂是油菜生产的目标产物,产油量较种子产量更能反映实际生产成效。单位面积产油量是由种子含油量与单位面积种子产量决定的,因此,生产中产油的多少不仅取决于收获种子的产量,还取决于收获种子的含油量。氮肥是保障油菜生长发育和种子高产的最重要营养元素[2],然而,研究显示单施氮肥特别是在抽蔓后施用氮肥会增加菜籽粗蛋白含量,降低脂肪含量[3]。赵合句等发现优质油菜的含油量随施肥水平的提高而降低,且差异显著[4]。增施氮肥不仅显著降低油菜籽粒含油量,而且施氮越多,降低越明显;而籽粒蛋白质含量随施氮量的增加而增加[5-6]。这表明增施氮肥尽管可以提升种子产量,但不一定能相应比例地提高产油量,如以产油量评估,增施氮肥的效益可能随含油量的下降而下降。因此很有必要了解增施氮肥后油菜种子含油量下降的分子生理学基础。
植物油脂和蛋白的合成是一个极其复杂的生物过程,涉及上百个基因及其编码的酶类,其中任何一个关键基因的改变,都可能使种子含油量和蛋白含量发生变化[7],例如,乙酰辅酶 A羧化酶(acetyl-CoA carboxylase,ACCase)催化乙酰CoA羧化生成丙二酰CoA,其中,ACCase催化的这一步不仅是脂肪酸合成途径的第一步,同时也是种子含油量形成的限速步骤和关键调控步骤,将拟南芥的ACCase在马铃薯块茎的造粉体中过量表达,使三酰甘油(TAG)的含量提高5倍[8];Roesler等人将ACCase在油菜中过量表达,使ACCase活性比野生型对照提高了10~20倍,使种子的含油量提高了5%[9]。二酰基甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)催化二酰甘油(DAG)合成三酰甘油(TAG),是TAG合成的最后一步,也是限速步骤。过量表达DGAT可以明显提高油菜的含油量[10],DGAT2是种子特异表达的基因,DGAT2基因的表达与油桐籽粒中油脂积累的趋势密切相符,表明DGAT2对植物种子油脂的合成具有直接作用,它的活性可能对碳流转向种子油脂合成具有实质影响[11-13]。磷酸烯醇式丙酮酸羧化酶(phosphoenol pyruvate carboxylase,PEPC)催化丙酮酸合成草酰乙酸进入蛋白质代谢,是控制蛋白质/油脂含量比例的一个关键酶[14],PEPC在植物种子中参与种子贮藏蛋白和脂肪酸代谢的调控[15-16],当PEPC的表达受到抑制时,PEPC通过改变代谢模式使碳流从糖类的合成转向脂肪酸的合成[17-18]。张占琴等[19]研究发现,PEPC 的活性与油脂含量/蛋白含量比值呈极显著负相关;PEPC的过表达使大豆干种子中蛋白质含量的增加超过 20%[20]。
我们推测在信号分子氮的诱导下,油脂和蛋白合成关键酶基因的表达水平发生改变,致使油脂含量下降而蛋白含量提高。因此,本文拟通过研究不同施氮水平下,不同含油量甘蓝型油菜品种种子发育过程中ACCase,DGAT2和PEPC表达的变化,探讨增施氮肥后油菜种子含油量下降蛋白含量提高的分子生理学基础,为高效合理施肥和耐氮高油品种的分子育种提供理论依据。
1 材料与方法
1.1 试验设计
试验于2009年在中国农业科学院油料作物研究所试验地进行。每个处理(小区)面积4.8 m2,种植密度每平方米15株。设4个氮肥水平,分别为N 0、90、180和270 kg/hm2,每个处理重复3次,随机区组排列。氮肥为尿素(含N 46%),施于苗期;磷肥为过磷酸钙 (含P2O516%),钾肥为氯化钾(含K2O 60%),磷、钾肥均作为基肥,各处理磷肥施用量均为P2O590 kg/hm2,钾肥施用量均为K2O 180 kg/hm2,田间管理按优质油菜的生产技术措施实施。
1.2 植物材料
供试油菜品种为甘蓝型油菜(Brassica napusL.),为德国品种Parter和中国品种中双11,于盛花期自交,取授粉后不同时期的荚果,取授粉后7、13、19、25、31和37 d的种子,于液氮中速冻后保存在-70℃冰箱,防止RNA降解,备作RNA提取。
将收获的自交种子自然晾干,采用 Foss NIRSystems 5000近红外分析仪分析测定自交油菜籽的含油量和蛋白含量。
1.3 油料作物种子RNA的提取
取100 mg种子于碾钵,加液氮碾磨,用1.5 mL预冷的提取buffer(8 mol/L LiCl,2% β-巯基乙醇)的悬浮粉末并混匀,4℃放置过夜后离心4 s,取上清;将上清液于13000 r/min,4℃离心30 min后,弃上清,留沉淀,用4℃的70%乙醇洗沉淀,短暂风干。用 1mL的溶解缓冲液(0.5%SDS,100 mmol/L NaCl,25 mmol/L EDTA,10 mmol/L Tris-HCl,pH 7.6,2% β-巯基乙醇)溶解沉淀。用 pH 4.6的水饱和酚抽提1次,用酚∶氯仿∶异戊醇为25∶24∶1的混合液抽提1次,用氯仿∶异戊醇为24∶1的混合液抽提1次。每次抽提均以13000 r/min离心,4℃离心15 min。加入0.1倍体积的3 mol/L的醋酸钠和 1.5倍体积的乙醇沉淀 RNA,13000 r/min,4℃离心15 min后,70%乙醇洗沉淀,最后将RNA溶解在DEPC处理过的水中[21-22]。
取2μL RNA作BECKMAN DU650核酸/蛋白质分析仪检测,得到RNA的浓度和OD260/OD280比值。用1.0%琼脂糖凝胶电泳检测总RNA的28S和18S rRNA比例,以评估总RNA的完整性。
1.4 实时荧光定量PCR的检测
使用TOYOBO公司的ReverTra Ace-α-TM试剂盒进行第一链cDNA的合成,cDNA稀释10倍后分装,用于PCR扩增。
以油菜β-actin基因为内参对照,使用TOYOBO公司的2×Realtime PCR Master Mix,进行实时荧光定量PCR的检测,委托上海生工公司合成定量PCR引物(表1),退火温度均为56℃,使用 BIO-RAD iQ5荧光定量PCR仪分析结果。用2-ΔΔCt法分析定量 PCR 得到的数据[23]。

表1 所用到的引物及扩增长度大小Table 1 List of primer sequences and amplicon sizes
2 结果与分析
2.1 不同施氮条件下的油菜种子含油量与蛋白含量的基因型差异
研究表明,随着施氮量的增加,两个品种种子含油量均降低,而蛋白含量均提高。经方差分析表明,不同施氮量下含油量差异均达极显著水平(P<0.001);同一施氮量下,两品种的含油量差异极显著,品种与施氮量的互作间差异不显著(P>0.05)。不同施氮量对蛋白含量具有极显著的影响(P<0.001),同一施氮量下,品种间蛋白含量无显著差异(P>0.05),品种与施氮量的互作间差异亦不显著(P>0.05)(表2)。
由表2可以看出,油菜品种中双11,其施氮N 90 kg/hm2和180 kg/hm2处理与对照(N 0 kg/hm2)处理的含油量无显著差异,N 270 kg/hm2处理与对照间含油量差异极显著;施氮N180 kg/hm2和270 kg/hm2处理(两者之间无显著差异)与对照(N 0 kg/hm2)处理的蛋白含量差异达极显著水平。油菜品种Parter的含油量,施氮 N 180 kg/hm2和270 kg/hm2(两处理之间无显著差异)与N 0 kg/hm2和90 kg/hm2(两者之间无显著差异)差异达极显著水平;蛋白含量施氮的3个处理与对照处理间差异均达极显著水平。
由于在施氮N180 kg/hm2处理中双11的含油量与对照相比差异显著,Parter的含油量差异极显著,两者的蛋白含量与对照相比均达差异极显著水平,因此选择施氮N180 kg/hm2和未施氮(对照)处理的材料作基因表达分析,分析两组材料中蛋白和油脂合成相关基因的表达变化。
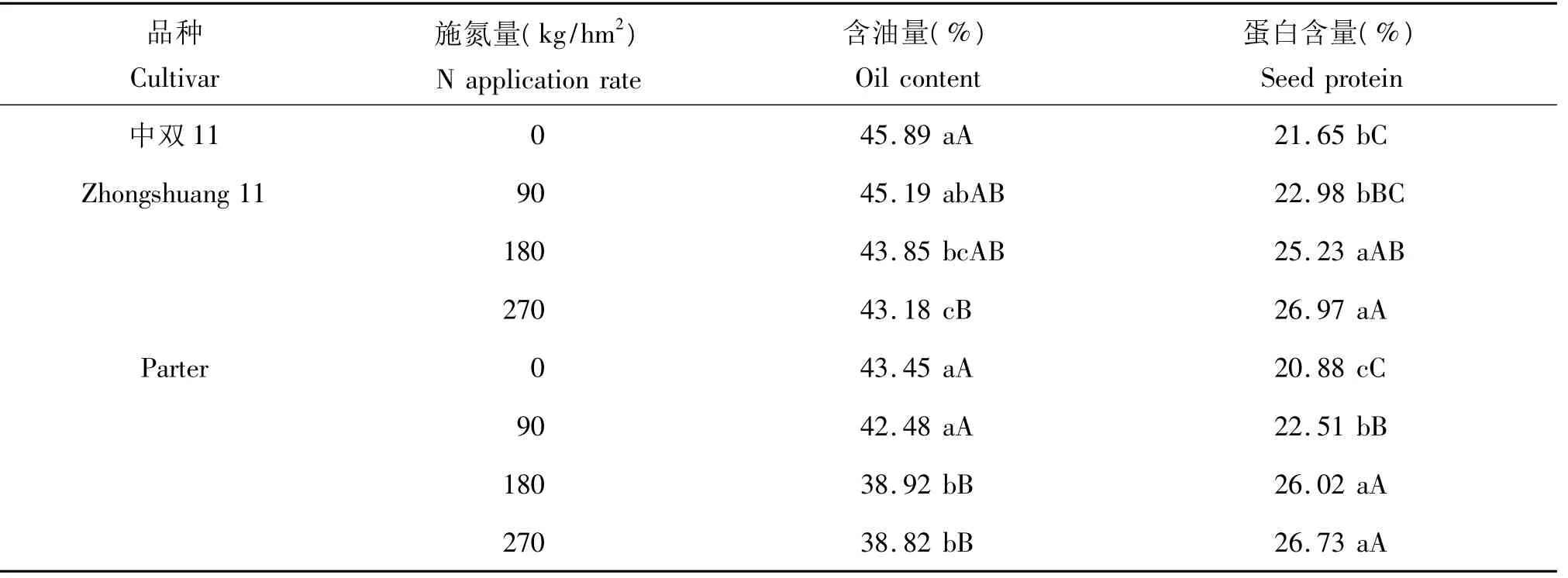
表2 不同施氮量对油菜含油量和蛋白含量的影响Table 2 The effect of different amounts of nitrogen application on oil content and seed protein of rapeseed
2.2 油菜总RNA的提取
取油菜授粉后7、13、19、25、31和37 d的种子提取总RNA,用1.0%琼脂糖非变性凝胶电泳鉴定,结果如图1所示。授粉后25 d的总RNA,28S RNA和18S RNA条带清晰,表明提取的RNA完整性较好。OD260/OD280的吸光度比值都在1.8~2.0之间,说明RNA的纯度比较高,RNA的质量可以用于后续的实验。
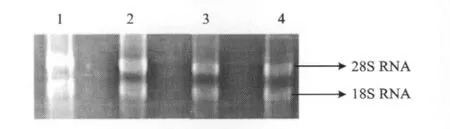
图1 油菜种子总RNA的电泳检测(授粉后25 d)Fig.1 Electrophoretic image of the total RNA for the rapeseed cultivars(25 day after the pollination)
2.3 施氮处理与对照中ACCase在种子不同发育时期的表达分析
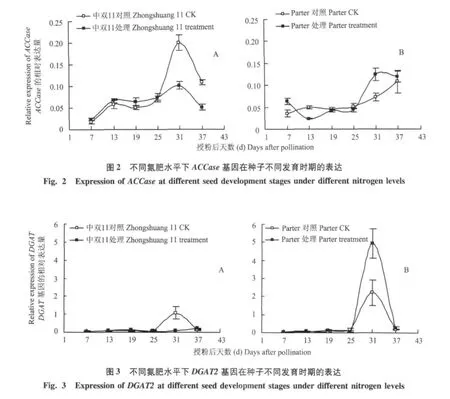
分析了两个品种施氮(N 180 kg/hm2)和对照处理的ACCase在种子不同发育时期的表达变化。图2结果显示,油菜中双11施氮处理与对照中ACCase基因的表达水平发现,授粉后7~25 d期间,ACCase基因在施氮处理中的表达水平比对照的略高,在授粉后25 d时两者表达水平基本一致,授粉后25 d后ACCase在施氮处理中表达缓慢上升,而在对照中迅速提高并超过施氮处理中的表达水平;授粉后31 d施氮处理和对照中ACCase的表达水平升至最高峰,然后逐渐下降。授粉后31 d和37 d两者的表达水平差异达最大值,施氮处理的ACCase表达量均为对照的50%。
从油菜品种Parter的施氮处理与对照中ACCase基因的表达变化(图2)可知,授粉后13~25 d期间,施氮处理中ACCase的表达水平一直低于对照,授粉后25 d后对照中的表达缓慢上升,而施氮处理中的表达水平迅速提高并超过对照,授粉后31 d,施氮处理中的表达水平达到最高峰,两者差异达到最大值,施氮处理中ACCase表达量为对照的1.7倍,并且其表达水平高峰推迟至授粉后31 d。
比较分析施氮肥与不施氮条件下两个品种ACCase基因表达水平的变化可知,中双11和Parter均在授粉后31 d时变化最大,但在施氮处理中中双11中的表达水平下降,而Parter的表达水平上升。
2.4 施氮处理(N 180 kg/hm2)与对照中DGAT2在种子不同发育时期的表达分析
由图3可知,授粉后7~25 d两个品种在施氮和未施氮条件下DGAT2均处于极低的表达水平,授粉后25 d后,中双11施氮处理中的表达水平一直低于对照,授粉后31 d时仅为对照表达量的7.69%;图3显示,授粉后25 d后,Parter的施氮处理的表达水平一直高于对照,授粉后31 d时两者的表达水平差异最大,施氮处理是对照的200%。
比较两个品种施氮处理和对照中DGAT2基因表达水平的变化可知,中双11和Parter均在授粉后31 d时表达水平差异最大,但在施氮处理中中双11的表达水平下降,而 Parter的表达水平上升,与ACCase基因的表达变化是一致的。两个品种的ACCase和DGAT2基因对氮肥的响应存在差异。
2.5 施氮处理(N 180 kg/hm2)与对照中PEPC在种子不同发育时期的表达分析
由图4可以看出,中双11施氮处理中的PEPC基因在授粉后7~25 d期间的表达水平一直比对照高,授粉后13 d时二者差异达到两倍,授粉后25~37 d后又显著低于对照的表达水平,授粉后31 d时施氮处理的PEPC基因表达量约是对照的30%,两者的表达水平差异达到最大;对照中的PEPC基因表达高峰在授粉后31 d,而施氮处理的基因表达高峰提前到授粉后13 d。
Parter在施氮处理中的PEPC基因表达水平在授粉后7 d时迅速下降,授粉后13 d降至最低点,随后缓慢上升,授粉后31 d达最高峰后缓慢下降;而对照中在授粉后7 d时该基因的表达量迅速上升,授粉后13 d至最高点,随后迅速下降,授粉后19 d达最低点后缓慢上升,授粉后31 d达到第二个小峰值。授粉后13 d时施氮处理的PEPC的表达量是对照的35%,两者的表达水平差异最大;授粉后19 d和25 d施氮处理的表达量是对照的两倍(图4)。对照中基因的表达高峰在授粉后13 d,施氮处理的基因表达高峰提前到授粉后7 d。
比较两个品种施氮处理和对照中的PEPC基因表达趋势的变化可知,施氮处理中双11中PEPC的表达水平为先升高后降低,而Parter中的表达水平是先下降再升高;中双11中PEPC在授粉后31 d表达水平差异最大,施氮处理的表达量约是对照的30%,而Parter在授粉后13 d表达水平差异最大,施氮处理的表达量是对照的35%;施氮后两个品种中PEPC基因的表达高峰均提前。两个品种的PEPC基因对氮肥的响应存在差异。
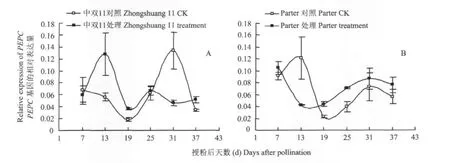
图4 不同氮肥水平下PEPC基因在种子不同发育时期的表达Fig.4 Expression of PEPC at different seed development stages under different nitrogen levels
3 讨论
氮是植株体内蛋白质的主要组成物质,占蛋白总量的16%~18%。油菜中氨基酸和蛋白质的形成及体内各种维生素和新陈代谢中不可缺少的酶,都是在氮素的参与下才能合成,因此施用氮肥对促进油菜的生长发育有重要作用[24]。本研究通过分析不同氮肥水平下两个油菜品种蛋白和油脂含量的变化发现,随着施氮量的增加,两个品种种子含油量均降低,而蛋白含量均提高。Brennan等[25]经过两年的重复试验,发现不同施氮量的油菜含油量和蛋白含量之和一般在62%左右,这意味着含油量的提高必然会引起蛋白含量的下降,反之亦然,因为氮是形成蛋白质的重要元素,供应充分的氮素增加蛋白质的合成,而蛋白质的形成先于脂肪的合成,在蛋白质形成时,消耗了较多的光合产物,从而影响了脂肪的合成[26-27]。本研究中发现在同一施氮量条件下,中双11和Parter两品种的含油量差异极显著。随着施氮量的增加,中双11品种的含油量下降的程度比Parter小,例如,在施氮处理(N 180 kg/hm2)的条件下,中双11的含油量与对照相比差异显著,而Parter的含油量与对照差异极显著。赵继献等[6,28]研究发现,随着施氮量的增加油研10号比油研9号的含油量显著下降,说明对氮肥的反应存在基因型的差异,这为筛选耐低氮、高产油量的品种奠定了理论基础。
氮素作为代谢途径中的重要调控因子,不仅调控氮代谢还影响碳代谢过程[29]。本研究分析了施氮和对照条件下ACCase、DGAT2和PEPC3个油脂和蛋白合成相关基因在种子不同发育时期的表达变化,以探索氮肥对它们表达的调控。结果表明,两个品种施氮处理(N 180 kg/hm2)和对照中ACCase和DGAT2的表达水平均在授粉后31 d差异最大,这说明两个基因对氮肥响应的关键时期是授粉后31 d。脂肪酸总量在授粉后10~30 d时迅速增加,该时期也正是脂肪酸脂累积高峰时期[19,21],周年年发现氮素在油菜开花37d左右开始影响油脂的形成[5],两者的时间基本吻合,说明这可能是氮肥影响油脂合成的重要时期。但是在授粉后31 d,中双11施氮处理中两个基因的表达水平显著低于对照,而Parter的两个基因的表达水平显著高于对照,推测两个品种中两个基因的表达对氮肥的响应存在基因型的差异。
前人研究表明,氮素作为信号分子可以诱导并调控PEPC基因的表达[30-32],氮胁迫下的玉米经施氮恢复后,叶片中PEPC基因的表达量立即提高[33];国外有学者研究了油脂和蛋白含量不同的13个大豆品种的PEPC活性,发现其活性与蛋白质含量呈高度正相关[15],由此推测,在增施氮肥条件下油菜种子中的PEPC基因的表达量应该是提高的,蛋白质的含量也将随之提高。然而我们的研究发现,施氮处理和对照相比,中双11中PEPC基因的表达水平在种子发育前期(授粉后7~25 d)提高,在发育后期(授粉后25~37 d)降低,授粉后31 d时表达水平差异最大;而Parter中的PEPC基因的表达水平在种子发育较后期(授粉后19~37 d)提高,在发育前期(授粉后7~19 d)降低,在授粉后13 d时差异最大;并且施氮处理中该基因在两个品种中的表达高峰均提前,在表达差异最大的时期,均是施氮处理中PEPC的表达量明显低于对照。由此可见,氮肥对两个品种中PEPC基因的表达模式产生了一定的影响,并且两个品种中PEPC对氮肥长期的应答亦存在一定的基因型差异,但是施氮处理和对照中PEPC的表达水平与我们的推测不完全相符,这可能与两个品种本身的差异有关,即一个是国外品种,一个为国内品种,两者本身的油脂和蛋白含量也不同,其中的确切原因还有待进一步解析。Junker等[34]通过标记监测氮肥处理下油菜发育的种子主要的代谢流向,并测定主要酶的活性,结果发现氮肥的使用量能够使与三羧酸循环相关的代谢流向发生改变,但是酶的活性和代谢流的方向并不一致,这说明代谢方向的改变是代谢网络中其它代谢补偿平衡的结果,这也提示我们,含油量和蛋白含量作为复杂性状与很多的因素有关,涉及到碳、氮代谢网络,仅用几个基因的变化来解释是远远不够的,需要在全基因组范围内进行表达谱分析,来进一步阐明各个代谢途径的变化。
4 结论
随着施氮量的增加,油菜品种中双11和Parter种子的含油量降低,蛋白质含量增加,且Parter的含油量下降程度明显高于中双11。研究发现,氮肥对ACCase和DGAT2基因表达水平影响最大的时期是授粉后31 d,但此时中双11中两个基因的表达水平下降,而Parter中的两个基因的表达水平上升;两个品种中PEPC基因对氮肥的响应也存在差异,施氮处理(N 180 kg/hm2)中该基因在两个品种中的表达高峰均提前。3个基因对氮肥的响应存在基因型差异,本研究结果为进一步筛选油菜氮肥敏感基因型、开展氮应答机理研究提供了有用的信息。
[1] USDA.Foreign Agricultural Service Oilseeds:World markets and trade monthly circular[OL].http://www.fas.usda.gov/oilseeds/circular/Current.asp,2010.5.11.
[2] Kang J M,Turano F J.The putative glutamate receptor 1.1(AtGLR1.1)functions as a regulator of carbon and nitrogen metabolism inArabidopsis thaliana[J].Proc.Natl.Acta.Sci.USA,2003,100:6872-6877.
[3] 刘昌智,蔡常被,陈仲西,等.氮磷钾对油菜子产量、蛋白质和含油量的影响[J].中国油料,1982,(3):25-29.
Liu C Z,Cai C B,Chen Z Xet al.Effects of nitrogen,phosphorus and potassium on yield protein and oil content of oilseed[J].Oil Crop Chin.,1982,(3):25-29.
[4] 赵合句,李培武,李光明,等.施肥水平对优质油菜种子生化品质影响的研究[J].作物学报,1991,17(4):255-259.
Zhao H J,Li P W,Li G Met al.Effects of fertilizer dressing on biochemical qualities in quality rape(Brassica napus)[J].Acta Agron.Sin.,1991,7(4):255-259.
[5] 周年年.氮素对油菜产量和品质的影响及相关分析研究[D].武汉:华中农业大学硕士学位论文,2005.
Zhou N N.The research on the nitorgen,s effect on rapeseed yield and quality and relevant analysis[D].Wuhan:MS thesis,Huazhong Agricultural University,2005.
[6] 赵继献,程国平,任廷波,等.不同氮水平对优质甘蓝型黄籽杂交油菜产量和品质性状的影响[J].植物营养与肥料学报,2007,13(5):882-889.
Zhao J X,Cheng G P,Ren T Bet al.Effect of different nitrogen rates on yield and quality parameters of high grade yellow seed hybrid rape [J].Plant Nutr.Fert.Sci.,2007,13(5):882-889.
[7] Beisson F,Koo A J,Ruuska Set al.Arabidopsis genes involved in acyl lipid metabolism.A 2003 census of the candidates,a study of the distribution of expressed sequence tags in organs,and a web-based database[J].Plant Physiol.,2003,132:681-697.
[8] Klaus D,Ohlrogge J B,Neuhaus H E,Dörrmann P.Increased fatty acid production in potato by engineering of acetyl-CoA carboxylase[J].Planta,2004,219:389-396.
[9] Roesler K R,Shorrosh B S,Ohlrogge J B.Structure and expression of an Arabidopsis acetyl-coenzyme A carboxylase gene[J].Plant Physiol.,1994,105:611-617.
[10] Weselake R J,Shah S,Tang Met al.Metabolic control analysis is helpful for informed genetic manipulation of oilseed rape(Brassicanapus)to increase seed oil content[J].J.Exp.Bot.,2008,59:3543-3549.
[11] Kroon J T,Wei W,Simon W J,Slabas A R.Identification and functional expression of a type 2 acyl-CoA: diacylglycerol acyltransferase(DGAT2)in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals[J].Photochemisty,2006,67(23):2541-2549.
[12] Shockey J M,Gidda S K,Chapital D Cet al.Tung tree DGAT1 and DGAT2 have nonredundantfunctionsin triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J].Plant Cell,2006,18:2294-2313.
[13] Cahoon E B,Shockey J M,Dietrich C Ret al.Engineering oilseeds for sustainable production of industrial and nutritional feedstocks:solving bottlenecks in fatty acid flux[J].Curr.Opin.Plant Biol.,2007,10:236-244.
[14] 张志刚.油菜种子含油量相关基因PEPC和DGAT的克隆及遗传转化研究[D].长沙:湖南农业大学博士学位论文,2006.
Zhang Z G.Cloning and transformation ofPEPCandDGATgene related to oilcontentofrapesee[D]. Changsha: PhD dissertation,Hunan Agricultural University,2006.
[15] Sugimoto T,Tanaka K,Monma Met al.Phosphoenolpyruvate carboxylase level in soybean seed highly correlates to its contents of protein and lipid[J].Agric.Biol.Chem.,1989,53(3):885-887.
[16] 潘昱名,刘风珍,万勇善.花生磷酸烯醇式丙酮酸羧化酶基因的克隆及反义表达载体的构建[J].华北农学报,2009,24(5):69-72.
Pan Y M,Liu F Z,Wan Y S.Cloning of peanut gene fragment encoding PEPCase and construction of its plant expression vector[J].Acta Agric.Boreali-Sin.,2009,24(5):69-72.
[17] Ruuska S A,Girke T,Benning Cet al.Contrapuntal networks of gene expression during Arabidopsis seed filling[J].Plant Cell,2002,14(6):1191-1206.
[18] Kubis S E,Pike M J,Everett C Jet al.The import of phosphoenolpyruvate by plastids from developing embryos of oilseed rape,Brassica napus(L.),and its potential as a substrate for fatty acid synthesis[J].J.Exp.Bot.,2004:55(402):1455-1462.
[19] 张占琴,王金梅,王学军,等.油菜籽粒发育过程中PEPCase活性与油脂、蛋白及亚基积累的特点[J].中国油料作物学报,2009,31(1):14-18.
Zhang Z Q,Wang J M,Wang X Jet al.The characteristics of PEPCase activity and accumulation of oil,protein and major protein subunits during seed development of rape(Brassica napus) [J].Chin.J.Oil Crop Sci.,2009,31(1):14-18.
[20] Rolletschek H,Borisjuk L,Radchuk Ret al.Seed-specific expression of a bacterial phosphoenolpyruvate carboxylase inVicia narbonensisincreasesprotein contentand improvescarbon economy[J].Plant Biotechnol.J.,2004,2(3):211-219.
[21] Hu Y,Wu G,Cao Yet al.Breeding response of transcript profiling in developing seeds ofBrassica napus[J].BMC Mol.Biol.,2009,10:49-65.
[22] Vicient C M,Delseny M.Isolation of total RNA fromArabidopsis thalianaseeds[J].Anal.Biochem.,1999,268:412-413.
[23] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25,402-408.
[24] 刘后利.实用油菜栽培学[M].上海:上海科学技术出版社,1987.
Liu H L.Practical cultivation of rapeseed[M].Shanghai:Scientific Technology Press,1987.
[25] Brennan R F,Mason M G,Walton G H.Effect of nitrogen fertilizer on the concentrations of oil and protein in canola(Brassica napus)seed[J].J.Plant Nutr.,2000,23:339-348.
[26] Wilcox J R.Increasing seed protein in soybean with eight cycles of recurrent selection [J].Crop Sci.,1998,38:1536-1540.
[27] Chung J,Babka H L,Graef G Let al.The seed protein,oil and yield QTL on soybean linkage group I[J].Crop Sci.,2003,43:1053-1067.
[28] 李志玉,郭庆元,廖星,等.不同氮水平对双低油菜中双9号产量和品质的影响[J].中国油料作物学报,2007,29(2):78-82.
Li Z Y,Guo Q Y,Liao Xet al.Effects of different amount of nitrogen on yield,quality and economics of Zhongshuang No.9[J].Chin.J.Oil Crop Sci.,2007,29(2):78-82.
[29] Stitt M,Müller C,Matt Pet al.Steps towards an integrated view of nitrogen metabolism [J].J.Exp.Bot.,2002,53(370):959-970.
[30] Scheible W R,Gonzales-Fontes A,Lauerer Met al.Nitrate acts as a signal to induce organic acid metabolism and repress starch metabolism in tobacco[J].Plant Cell,1997,9:783-798.
[31] Sugiharto B,Miyata K,Nakamoto Het al.Regulation of expression of carbon-assimilating enzymes by nitrogen in maize leaf[J].Plant Physiol.,1990,92:963-969.
[32] Yamazaki M,Watanabe A,Sugiyama T.Nitrogen-regulated accumulation of mRNA and protein for photosynthetic carbonassimilating enzymes in maize[J].Plant Cell Physiol.,1986,27:443-452.
[33] Sugiharto B,Sugiyama T.Effects of nitrate and ammonium on gene expression of phosphoenolpyruvate carboxylase and nitrogen metabolism in maize leaf tissue during recovery from nitrogen stress[J].Plant Physiol.,1992,98:1403-1408.
[34] Junker B H,Lonien J,Heady L Eet al.Parallel determination of enzyme activities and in vivo fluxes inBrassica napusembryos grown on organic or inorganic nitrogen source[J].Phytochemistry,2007,68:2232-2242.
- 植物营养与肥料学报的其它文章
- 长期施肥对土黑碳积累的影响
- 《植物营养与肥料学报》投稿须知

