H1和H3亚型禽流感病毒二重PCR 检测方法的建立
郭 捷,谢芝勋,彭 宜,刘加波,谢志勤,庞耀珊,邓显文,谢丽基
(1.广西大学动物科学技术学院,广西南宁530004;2.广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室,广西南宁530001)
禽流感(Avian influenza,AI)是由正黏病毒科(Orthomyxoviridae)A型流感病毒属中不同亚型病毒引起的禽类感染和疾病的总称。禽流感病毒(AIV)为单股负链RNA病毒,由8个独立的RNA节段组成,根据其表面血凝素(HA)和神经氨酸酶(NA)的抗原性差异,可分为16个HA亚型和9个NA亚型。其中H1和H3亚型AIV虽然属于低致病性AIV,在禽类中没有表现出明显症状,较少出现死亡,但在人类流感中H1和H3亚型流感病毒引起过世界性的大流行[2],20世纪全球发生过3次流感大流行都是由H1亚型或H3亚型流感病毒造成的,尚且不能证明这几次大流行流感的2种亚型病毒来自于禽类,但可以推断禽源H1和H3亚型AIV为人类流感病毒提供了基因片段,从而间接的威胁着人类的身体健康,具有重要的公共卫生意义[3-7]。所以,建立同时快速检测H1和H3亚型AIV的方法,对这两种亚型禽流感病毒感染的诊断和控制非常关键。
目前对H1和H3亚型AIV感染的鉴别诊断主要依靠传统的病原分离鉴定与血清学试验,这些方法有一定的局限性,不能同时检测出这两种亚型AIV。因此,本研究选择一种具有敏感性高、特异性好、快速、简便的PCR检测方法用于鉴别诊断H1和H3亚型禽流感病毒感染。相对于单项PCR技术,二重PCR技术能同时检测并鉴别出两种病原体,在临床上具有很高的应用价值。此方法已被广泛应用于一些病原微生物的检测中,并且具有良好的敏感性和特异性[8-12]。本试验的目的在于建立一次PCR反应就能同时检测和鉴别H1和H3两种亚型禽流感病毒的二重PCR方法。
1 材料与方法
1.1 材料
1.1.1 毒株 H1、H3、H6、H9亚型AIV由广西畜禽疫苗新技术重点实验室分离鉴定;H5N2、H7N2亚型AIV RNA由美国宾夕法尼亚州立大学禽病诊断研究室惠赠;新城疫病毒(NDV)F48、传染性支气管炎病毒(IBV)M41、传染性喉气管炎病毒(ILTV)北京株及鸡毒支原体(MG)86由广西畜禽疫苗新技术重点实验室保存提供。
1.1.2 试剂 RNA提取试剂Trizol LS Reagent为Invitrogen公司产品;AMV反转录酶、dNTP为宝生物工程(大连)有限公司产品;DU 800紫外分光光度计为Beckman Coulter公司产品;SPF鸡胚购自北京梅里亚公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank已发表的H1亚型和H3亚型AIV-HA基因的保守核苷酸序列,应用DNA Star软件和Primer 5.0生物软件设计针对H1亚型和H3亚型AIV基因序列的2对特异性引物,其中H1亚型AIV扩增302bp,H3亚型AIV为626bp,引物核酸序列见表1。引物由Invitrogen公司合成,储存液浓度为50pmol/μL,置-30℃保存备用。
1.2.2 病毒RNA抽提与反转录 参照Trizol LS Reagent使用说明书和文献[10]进行病毒RNA抽提,向抽提后的RNA中加入35μL DEPC水和1.5 μL反转录引物:70℃10min,冰浴5min;加入反转录体系:10μL 5×M-Mulv buffer、2μL dNTP、0.5 μL RNA酶抑制剂、1μL AMV,瞬时离心,42℃经90min。制备的cDNA置-30℃保存备用。
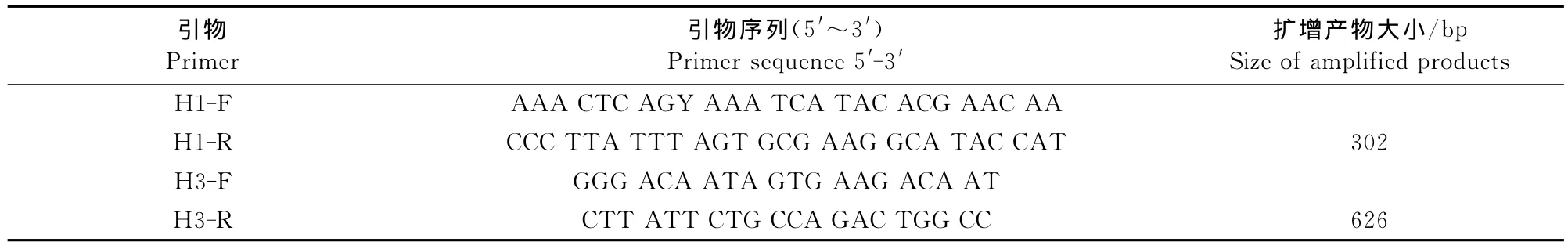
表1 H1和H3引物的核苷酸序列Table 1 Nucleotide sequences of H1and H3primers
1.2.3 二重PCR扩增条件的优化 总反应体积为25μL,其中2×PCR Master Mix 12.5μL,H1亚型AIV cDNA和H3亚型AIV cDNA共2μL作为混合模板,引物 H1-F、H1-R各加入0.4μL,H3-F、H3-R各加入0.6μL,最后用双蒸水补至25μL。对二重PCR的各引物浓度及PCR反应的各参数(温度、时间)进行优化,以筛选出二重PCR反应体系中最佳的反应模式。
1.2.4 二重PCR的特异性试验 利用本研究优化好的二重PCR反应体系,同时扩增H1、H3、H5、H6、H7、H9亚型 AIV、NDV、IBV、ILTV 及 MG的核苷酸进行检测,检验其特异性。
1.2.5 二重PCR的敏感性试验 将制备好的H1 AIV和H3AIV RNA按10倍倍比稀释,利用Beckman UV-800紫外分光光度计测定稀释后各个梯度的RNA浓度,反转录后采用最佳引物浓度和二重PCR反应模式,分别对上述模板进行二重PCR扩增以检测其敏感性。
1.2.6 临床样品检测 应用所建立的PCR方法,对17份从广西南宁市活禽市场采集的口腔和粪便拭子进行RNA提取,反转录后进行检测。
2 结果
2.1 二重PCR条件的优化
通过对H1亚型AIV、H3亚型AIV 2种引物浓度的测定及二重PCR扩增的温度、时间等的优化,最后确定二重PCR最佳反应体系:2×PCR Master Mix 12.5μL,H1亚型AIV上下引物(50 pmol/μL)各0.1μL,H3亚型 AIV 上下引物(50 pmol/μL)各0.4μL,混合模板2μL,加水至25μL。二重PCR的最佳反应模式为:94℃4min;94℃50 s,56℃50s,72℃ 1min,35个循环;72℃10min,4℃结束反应。其PCR反应产物用10g/L琼脂糖凝胶进行电泳,观察结果并拍照。
2.2 特异性试验结果
特异性试验结果显示,含有H1亚型AIV、H3亚型AIV的核酸样品均能扩增出与试验设计大小相符的302bp和626bp 2个明亮条带,与预期结果一致(图1);而其他亚型流感病毒和禽呼吸道疾病病原均未扩增出任何条带,说明该方法有较好的特异性。
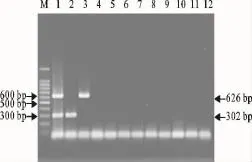
图1 二重PCR的特异性试验结果Fig.1 Specificity results of duplex PCR
2.3 敏感性试验结果
用Beckman UV-800紫外分光光度计测得H1亚型AIV和H3亚型AIV总RNA浓度分别为500 ng/μL、260ng/μL,应用优化后的二重PCR方法对10倍梯度稀释的H1亚型AIV、H3亚型AIV核酸模板进行检测,结果表明,该二重PCR最低能同时检测到50pg的H1亚型AIV和26pg的H3亚型AIV核酸模板(图2)。
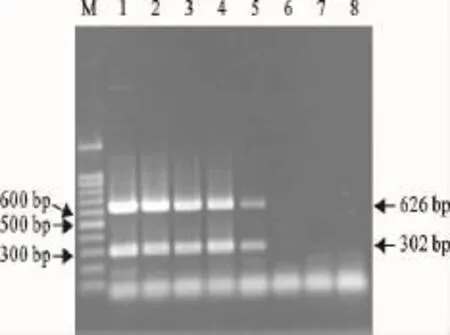
图2 二重PCR的敏感性试验结果Fig.2 Sensitivity results of duplex PCR
2.4 临床样品检测结果
在广西南宁市17份活禽市场样品中,抽提RNA反转录后进行二重PCR检测,结果有4份为H1亚型AIV阳性,5份为H3亚型AIV阳性(图3),与病毒分离鉴定的结果一致。
3 讨论
AIV 16种HA亚型中,H1亚型和H3亚型属于低致病性禽流感病毒,但在人类流感病毒中,自1997年起,H1N1型与H3N2型在人群中交替流行,严重影响了人类的身体健康[13-15],其中的基因片段有可能来自于禽流感的H1和H3亚型。因此,本研究针对H1亚型AIV-HA基因和H3亚型AIV-HA基因,设计2对特异性引物,使该PCR反应能同时扩增出针对H1亚型和H3亚型AIV的目的片段,对我国现有H1亚型和H3亚型AIV的检测有十分重要的意义。

图3 二重PCR检测临床样品的结果Fig.3 The detection results of clinical samples by duplex PCR
因为感染H1和H3亚型禽流感病毒的禽类不会表现明显的临床症状,也很难通过病理组织变化观察进行鉴定。另外,传统的血清学检测方法敏感性不高。本研究所建立的二重PCR,对含有H1亚型AIV毒株、H3亚型AIV毒株进行了二重PCR检测,结果均同时得到了与试验设计大小相符的扩增条带,而对其他对照病毒的扩增结果均为阴性,说明本试验所建立的二重PCR特异性良好。同时,利用扩增片段长度大小的不同直接判定扩增结果,使得该方法在结果判定上更加直观、简便。另外,敏感性试验结果表明,该二重PCR最低能同时检测到50pg H1亚型AIV模板,26pg H3亚型AIV模板,可以看出该二重PCR方法敏感性较高。通过临床检测,也体现出来该二重PCR方法的高度准确性和简便性。
综上所述,本研究所建立的二重PCR方法,对同时鉴别检测H1亚型AIV和H3亚型AIV具有简便快速、特异性好、灵敏度高等特点,为H1和H3亚型禽流感的诊断和监控提供了技术手段。
[1] Webster R G,Bean W J,Gorman O J,et al.Evolution and ecology of influenza A virus[J].Microbiol Rev,1992,56(1):152-179.
[2] Zhu H C,Zhou B P,Fan X H,et al.Novel reassortment of Eurasian avian-like and pandemic/2009influenza viruses in swine:infectious potential for humans[J].Virology,2011,85(20):10432-10439.
[3] Gething M J,Bye J,Skehel J,et al.Cloning and DNA sequence of double-stranded copies of hemagglutinin genes from H2and H3strains elucidates antigenic shift and drift in human influenza virus[J].Nature,1980,287(5780):301-306.
[4] Gao Q S.A nine-segment influenza a virus carrying subtype H1and H3hemagglutinins[J].Virology,2010,84(16):8062-8071.
[5] Codeco C T.The epidemic wave of influenza A(H1N1)in Brazil,2009[J].Cad Saúde Pública,2012,28(7):1325-1336.
[6] Clans E C,Kawaoka Y,de Jong J C,et al.Infection of children with avian-human reassortant influenza virus from pigs in Europe[J].Virology,1994,204(4):453-457.
[7] Liu Y Z,Ji J,Xie Q M,et al.Isolation and complete genomic characterization of H1N1subtype swine influenzaviruses in southern China through the 2009pandemic[J].Virol J,2011,8(1):129-139.
[8] 庞耀珊,谢芝勋,Khan M I,等.应用多重PCR检测人工感染鸡呼吸道疾病的研究[J].中国预防兽医学报,2001,11(6):415-418.
[9] 谢芝勋,谢丽基,刘加波,等.禽流感和新城疫病毒二重荧光定量RT-PCR检测方法的建立[J].生物技术通讯,2008,19(3):410-413.
[10] Xie Z X,Pang Y S,Liu J B,et al.A multiplex RT-PCR for detection of type A influenza virus and differentiation of avian H5,H7,and H9hemagglutinin subtypes[J].Mol Cell Prob,2006,20(3-4):245-249.
[11] Xu X G,Chen G D,Huang Y,et al.Development of multiplex PCR for simultaneous detection of six swine DNA and RNA viruses[J].J Virol Meth,2012,183(1):69-74.
[12] 黄溢泓,韦正吉,李志源,等.五种禽呼吸道病病原多重PCR检测方法的建立和应用[J].中国兽医科学,2010,40(2):164-168.
[13] 马寅生,王永强,李 翔,等.禽流感跨种间传播的研究进展[J].中国兽医杂志,2009,45(12):62-64.
[14] Xu X Y,Lindstrom S E.Reassortment and evolution of current human influenza A and B viruses[J].Virus Res,2004,103(1-2):55-60.
[15] Brenda L.Implicationsof public understanding of avian influenza for fostering effective risk communication[J].Health Promotion Practice,2008,9(4):54-59.

