新生牛雄性生殖干细胞的分离纯化与培养
郑 鹏,于 磊,田亚光,黄 贺,张贵学
(东北农业大学动物科学技术学院,哈尔滨 150030)
雄性生殖干细胞具有自我复制和分化成精子的能力,是动物体内唯一能进行遗传信息传递的干细胞。雄性生殖干细胞既是干细胞生物学的重要研究对象,又是研究精子发生、制作转基因动物和研究基因功能的重要资源。Brinter等报道,将可育小鼠的雄性生殖干细胞移植到不育小鼠的睾丸中并建立精子发生[1],雄性生殖干细胞成为干细胞研究领域的研究热点。然而,雄性生殖干细胞的体外长期培养却未获得成功。直到Kanatsu-Shinohar等和Kubota等先后报道了小鼠的雄性生殖干细胞的体外长期培养和增殖的成熟体系[2]。生殖干细胞技术的发展和应用,将为克隆动物[2]、保护濒危物种[3]、生产转基因动物[4]、治疗雄性不育以及一些人类遗传疾病的基因治疗[5]提供新的机遇与途径。最近的研究表明,雄性生殖干细胞可以诱导分化成特定类型的细胞[6-8],在再生医学治疗领域具有广阔的应用前景,是继ES细胞、iPS细胞之后的另一种细胞来源。在牛ES细胞、iPS细胞没有成功建立之前,进行牛雄性生殖干细胞体外培养,研究牛雄性生殖干细胞的多能性,阐述细胞重编程的重要基础理论具有重要意义。
目前,关于哺乳动物雄性生殖干细胞体外增殖与分化研究主要集中在小鼠和人,其他动物的研究很少。有关牛雄性生殖干细胞的研究主要是集中在对4~6月龄牛雄性生殖干细胞的分离纯化[9-11]、冷冻保存[12]、自体移植[13]、异体移植[14]、体外分化培养[15]等。本文对新生牛雄性生殖干细胞进行分离纯化,对其培养、鉴定,探讨新生牛睾丸雄性生殖干细胞体外增殖相关影响因素和技术体系,以期为建立稳定、高效的家畜雄性生殖干细胞体外增殖与分化体系提供理论和实践依据。
1 材料与方法
1.1 动物与药品
新生牛睾丸采自出生后未超过24 h健康的荷斯坦公牛(哈尔滨市现代生物科技有限公司提供)。无菌操作取出双侧睾丸,置于4℃生理盐水中,2 h内送回实验室。
实验所用试剂除DMEM/F-12、FBS(购自Gibco公司)外,其他无特殊说明外(均购自Sigma公司);实验所用抗体(购自Santa cruz公司);RNA提取试剂盒(购自Solarbio);反转录试剂盒(购自ABI);Taq酶等(均购自大连宝生物公司);雄性生殖干细胞培养基:DMEM/F-12+2%(或10%)血清+2 mmol·L-1-谷氨酰胺+0.1 mmol·L-1巯基乙醇+1%双抗+1%MEM非必需氨基酸溶液+1%MEM维生素溶液+10 μg·mL-1胰岛素-转铁蛋白-亚硒酸钠+30 μg·mL-1丙酮酸钠。
1.2 方法
1.2.1 生殖干细胞的分离纯化
参照文献[16]的方法制备生精细胞悬液,并采用差速贴壁法和不连续密度梯度Percoll分选法分离纯化生殖干细胞和支持细胞。
差速贴壁分选采用6种方法:分别是含10%血清的培养液、培养2~4 h后差速、过夜培养、进行两步法差速(A);含2%血清的培养液、培养2~4 h后差速、过夜培养、进行两步法差速(B);含2%血清的培养液、直接培养过夜、进行一步法差速(C);用明胶包被培养瓶,按照上述三种方法(A、B、C)进行差速(A+、B+、C+)。分别在差速前(0 h)、培养2~4 h后差速后、过夜培养差速后进行AKP染色,鉴定生殖干细胞的比例。
参照文献[17-18]的方法进行生精细胞的不连续密度梯度Percoll分选,Percoll分选法分别采用20%、30%、40%、50%、60%的Percoll液进行分选。分选的各层细胞分别用台盼蓝进行死活染色、AKP进行生殖干细胞的比例鉴定。
生精细胞悬液进行不连续密度梯度Percoll分选后,采用A种方法,进行两次差速贴壁分选。分选后用进行AKP染色,鉴定生殖干细胞的比例。
1.2.2 生殖干细胞的培养
将纯化的雄性生殖干细胞以1×104个·cm-2的密度接种于35 mm培养皿中(Coing),于37℃、5%CO2、饱和湿度培养箱中培养,培养液分别为含2%和10%浓度血清的培养液,检测血清浓度对生殖干细胞和支持细胞增殖的影响。在2%血清浓度的培养液中添加100 ng的GDNF培养雄性生殖干细胞,观察生殖干细胞的增殖并进行AKP和OCT-4免疫组化染色。
2 结果与分析
2.1 差速贴壁分选的比较
差速贴壁分选的结果见表1,明胶包被培养瓶的方法,并没有显著提高生殖干细胞的比例(P>0.05);培养2~4 h后差速,10%的血清培养液组的细胞AKP阳性率显著高于2%的血清培养液组(P<0.05);过夜培养后,六种方法之间差异不显著(P>0.05)。
2.2 不连续密度梯度分选
生殖干细胞悬液梯度分选后,形成两条带和最底层的血细胞。第一条带的细胞离心洗涤后,利用台盼蓝染色,显示大部分是死细胞,进行培养时细胞没有贴壁。第二条带的细胞离心洗涤后,利用台盼蓝染色,显示95%以上都是活细胞,利用AKP进行染色,显示雄性生殖干细胞的比例在7%左右(见表2)。
2.3 差速贴壁分选与不连续密度梯度分选的比较
梯度分选后,继续进行两次差速贴壁,并与单纯的差速贴壁、梯度分选进行比较,结果显示(见表2),不连续密度梯度分选能有效的去除细胞碎屑和血细胞,但同时也会损失一些雄性生殖干细胞和支持细胞(回收细胞数6.1×106<细胞总数107),回收的雄性生殖干细胞数与不连续密度梯度后进行差速贴壁分选之间差异不显著。差速贴壁分选的回收细胞数、回收的雄性生殖干细胞数显著高于不连续密度梯度后进行差速贴壁分选,二者的细胞AKP阳性率之间差异不显著。三种方法的细胞活率之间差异不显著。可见,不连续密度梯度分选的作用主要在于除去血细胞和细胞碎屑的影响。

表1 雄性生殖干细胞差速贴壁分选比较(AKP阳性率,%)(n=10)Table 1 Comparison of differential adhesion methods of male germline stem cells(AKP positive rates,%,n=10)
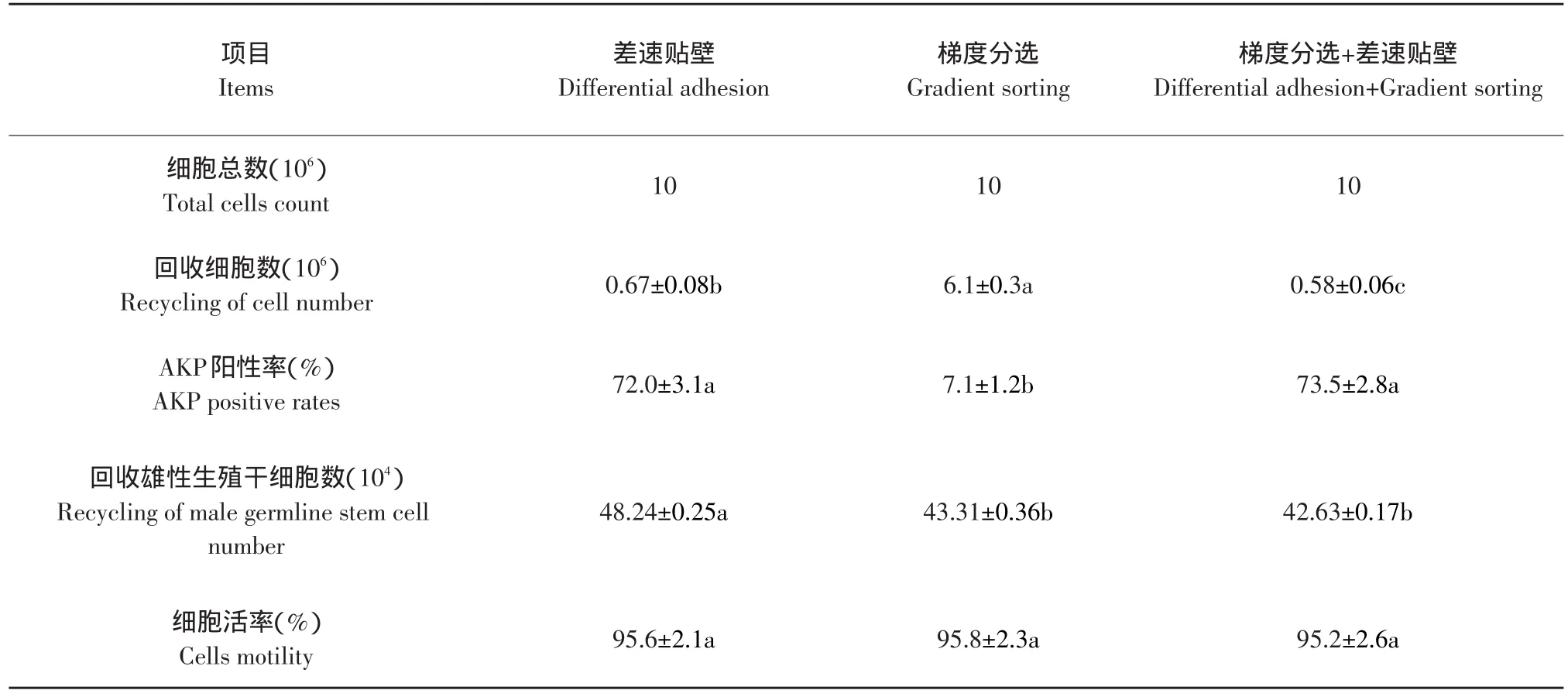
表2 差速贴壁与梯度分选的比较(n=10)Table 2 Comparison of differential adhesion and gradient sorting method
2.4 不同培养液的比较
2.4.1 血清对雄性生殖干细胞增殖的影响
将分离纯化后的雄性生殖干细胞悬液以1×104个·mL-1的密度接种到培养板内,检测血清浓度对细胞增殖的影响。雄性生殖干细胞进行缓慢的增殖,并且在培养的0~7 d内,10%培养液中的增殖速度稍大于2%培养液中的增殖速度,但差异并不显著(P>0.05),在培养10 d时,10%培养液中雄性生殖干细胞数量小于2%培养液中雄性生殖干细胞数量,差异也不显著(P>0.05)(见表3)。

表3 血清对雄性生殖干细胞增殖的影响(×104)(n=5)Table 3 Impact of serum to male germline stem cells proliferation(×104,n=5)
2.4.2 血清对支持细胞增殖的影响
支持细胞增殖速度较快,并且在培养的7~10d时,10%培养液中增殖速度大于2%培养液中的增殖速度,且二者之间差异显著(P<0.05)(见表4)。

表4 血清对支持细胞增殖的影响(×104,n=5)Table 4 Impact of serum to sertoli cells proliferation (×104,n=5)
在2%和10%血清浓度的培养液中雄性生殖干细胞增殖速度相近,而10%血清浓度的培养液中支持细胞增殖较快(见图1),由于竞争营养和生长空间,不利于雄性生殖干细胞增殖。因此,本试验在原代培养时,使用2%血清浓度的培养液。

图1 血清浓度对细胞增殖的影响Fig.1 Impact of different serum concentrations to cell proliferation
2.5 雄性生殖干细胞的培养与鉴定
将分离纯化后的雄性生殖干细胞悬液以1×104个·mL-1的密度接种到培养板内培养,添加100 ng的GDNF能显著促进雄性生殖干细胞增殖(见表5)。增殖的雄性生殖干细胞集落进行AKP、OCT-4染色,集落呈阳性表达结果见图版Ⅰ、Ⅱ(图版Ⅱ彩版见封二),初步确定雄性生殖干细胞集落具有一定的多能性。

表5 GDNF对雄性生殖干细胞增殖的影响(×104,n=5)Table 5 Impact of GDNF to male germline stem cells proliferation (×104,n=5)
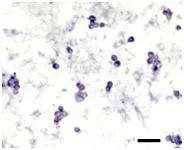
图版Ⅰ 培养3 d的雄性生殖干细胞的AKP染色PlateⅠ AKP staining of male germline stem cells after 3 d cultured,Bar=100 μm

图版Ⅱ 雄性生殖干细胞的OCT-4染色PlateⅡ OCT-4 staining of male germline stem cells
3 讨论与结论
3.1 生殖干细胞的分离与纯化
生精上皮细胞的分离多采用胶原酶、透明质酸酶、胰酶、DNA酶组合法消化,不同的实验室根据需要采用不同的组合。其关键在于控制消化程度,若消化不足,则管周肌样细胞残余较多;消化过度,则生精上皮细胞大量丢失或受损,严重影响细胞产量及活率。本试验先采用胶原酶处理,获得较纯净的曲细精管,然后以胰酶消化曲细精管获得生精上皮细胞。生精细胞悬液中常常并不能完全彻底地分离出目的细胞,只能达到培养物中以某种细胞为主的程度,所以也常称为富集(Enrichment)。分离纯化的方法主要有:不连续Percoll密度梯度离心法[17-18]、差速贴壁分选法[19]、流式细胞分选法[19-20]以及免疫磁珠分离法[6,20]等。本试验应用差速贴壁法、不连续密度梯度Percoll分选法分选生殖干细胞和支持细胞,结果显示不连续密度梯度分选能有效的去除细胞碎屑和血细胞,同时也会损失一些雄性生殖干细胞和支持细胞,综合考虑,差速贴壁分选法与其他方法相比更加简单、可行。
3.2 生殖干细胞的培养与多能性
目前,精原干细胞体外培养所用的培养基种类较多,添加成分各异,一般采用DMEM/F-12为基本培养基。Izadyar等研究认为牛精原细胞在MEM中培养比在KSOM中培养增殖更快[10]。Kubota等比较α-MEM和F12对小鼠精原细胞体外无血清培养的效果,结果表明α-MEM效果较好,显示不同动物来源的精原细胞需要采用不同的培养系统[20]。
当前关于精原干细胞培养条件的相关报道中绝大多数都添加一定量的血清。有研究表明,培养不同动物精原干细胞,培养基中所添加的血清浓度是不同的,对于牛精原细胞在无血清的条件下,培养几天后精原细胞大量死亡;加入2.5%血清时,精原细胞的存活和增殖情况有明显改善;加入更高浓度血清时,虽然精原细胞数目增加,但支持细胞和间质细胞的增殖远大于精原细胞[10]。因此,适宜的血清浓度可以延长精原细胞体外存活时间。胶质细胞源神经营养因子(Glial cell line-derived neurotrophic factor,GDNF)是转化生长因子-β超家族的一个成员。体外试验研究显示,培养液中添加GDNF影响多种动物精原干细胞的增殖,Shinohara等[19]试图建立小鼠精原细胞的无血清或无饲养层培养体系,但结果显示在无饲养层和GDNF存在时,精原细胞不能增殖。大多数关于精原干细胞培养的报道均表明,GDNF是调节精原干细胞增殖、分裂的关键因素之一[15]。在本试验中,采用2%血清,添加GDNF的培养液培养生殖干细胞,能显著促进雄性生殖干细胞增殖。
AKP(Alkaline phosphatase)在胚胎干细胞和成体干细胞中的活性很高,干细胞一旦分化,则AKP呈阴性。AKP常用来作为鉴定干细胞特性的标志[21]。OCT-4是POU家族的转录因子,由pou5f1基因编码,在早期胚胎发育中起着关键作用,所表达的蛋白质是细胞全能性的重要标志,OCT-4是参与调控胚胎干细胞自我更新和维持其全能性最为重要的转录因子之一,同时也是体外建立诱导多能干细胞(iPS)的关键基因[22]。OCT-4在ESC、PGCs、精原干细胞中都存在表达[23],并且用来鉴定细胞是处于自我更新、维持未分化的多能性状态,还是进入分化状态、失去多能性。因此,试验中应用AKP和OCT-4鉴定精原干细胞,证实新生牛睾丸中精原干细胞具有多能性,培养后形成的集落也具有多能性,本研究进一步证实了Simon等关于精原干细胞本身就具有多能性,可以直接转化为体细胞的观点[8]。
3.3 雄性生殖干细胞
雄性生殖干细胞作为体内位置确定、终身存在,并且能将携带的遗传信息传递至下一代的成体干细胞,在干细胞研究中的优势是显而易见的:更方便用于转基因动物的研究、更方便简单地分化成多能干细胞、为男性不育治疗提供新途径等等。但是,雄性生殖干细胞的体外增殖和分化一直困扰着生殖干细胞的发展进步,虽然在啮齿类动物上完成了生殖干细胞的长期培养鉴定,但是体外生殖干细胞分化成有活性、有受精能力的可育精子一直没有突破,大大限制了雄性生殖干细胞的应用和发展。
本试验对新生牛雄性生殖干细胞分离纯化的方法进行研究,并进行培养、鉴定,初步建立了新生牛睾丸雄性生殖干细胞的分离纯化与体外培养技术体系,将为建立稳定、高效的家畜雄性生殖干细胞体外增殖与分化体系提供理论和实践依据。
差速壁法能有效分选雄性生殖干细胞与支持细胞,2%血清培养液可用于雄性生殖干细胞体外培养,且培养基中添加GDNF能显著促进雄性生殖干细胞的增殖,增殖形成的雄性生殖干细胞集落具有多能性。
[1] Ralph L.Brinster,James W.Zimmermann.Spermatogenesis following male germ-cell transplantation[J].Proc Natl Acad Sci USA,1994,91:11298-11302.
[2] Kubota Hiroshi,Ralph L Brinster.Technology Insight:in vitroculture of spermatogonial stem cells and their potential therapeutic uses[J].Nature Reviews Endocrinology,2006(2):99-108.
[3] Qingguo Zhao,Jianle Wang,Yu Zhang,et al.Generation of histocompatible androgenetic embryonic stem cells using spermatogenic cells[J].Stem Cells,2010,2(28):229-239.
[4] Virginie Olive,Franc,Ois Cuzin.The spermatogonial stem cell:from basic knowledge to transgenic technology[J].IJBCB,2005,37:246-250.
[5] Ali Honaramooz,Susan Megee,Wenxian Zeng,et al.Adenoassociated virus(AAV)-mediated transduction of male germ line stem cells results in transgene transmission after germ cell transplantation[J].The FASEB Journal,2008,22:374-382.
[6] Sabine Conrad,Markus Renninger,Jorg Hennenlotter,et al.Generation of pluripotent stem cells from adult human testis[J].Nature,2008,456:344-349.
[7] Kossack N,Meneses J,Shefi S,et al.Isolation and Characterization of pluripotent human spermatogonial stem cell-derived cells[J].Stem Cells,2009,27:138-149.
[8] Simon L,Ekman G C,Kostereva N,et al.Direct transdifferentiation of stem/progenitor spermatogonia into reproductive and nonreproductive tissues of all germ layers[J].Stem Cells,2009,27:1666-1675.
[9] Izadyar F,Spierenberg G T,Creemers L B,et al.Isolation and purification of type a spermatogonia from the bovine testis[J].Reproduction,2002,124:85-94.
[10] Izadyar F,Spierenberg G T,Creemers L B,et al.Proliferation and differentiation of bovine type a spermatogonia during longterm proliferation in culture and germline transmission of mouse male germline stem cells[J].Biology of Reproduction,2003,68:612-616.
[11] Muren Herrid,Rhonda J.Davey,Keryn Hutton,et al.A comparison of methods for preparing enriched populations of bovine spermatogonia[J].Reproduction,Fertility and Development,2009,21:393-399.
[12] Izadyar F,Matthijs-Rijsenbilt J J,den Ouden K,et al.Development of a cryopreservation protocol for type a spermatogonia[J].J Andrology,2002,23(4):537-545.
[13] Izadyar F,Den Ouden K,Stout T A,et al.Autologous and homologous transplantation of bovine spermatogonial stem cells[J].Reproduction,2003,126:765-774.
[14] Herrid M,Vignarajan S,Davey R,et al.Successful transplantation of bovine testicular cells to heterologous recipients[J].Reproduction,2006,132:617-624.
[15] Pedro M Aponte,Takeshi Soda,Katja J Teerds,et al.Propagation of bovine spermatogonial stem cellsin vitro[J].Reproduction,2008,136 543-557.
[16] 郑鹏,李冬旭,田亚光,等.新生牛睾丸细胞的分离纯化与冷冻保存[J].东北农业大学学报,2010,41(2):96-100.
[17] Sandeep G,Miki S,Naojiro M,et al.Identification,isolation,andin vitroculture of porcine gonocytes[J].Biology of Reproduction,2007,77:127-137.
[18] Sandeep G,Mayako F,Kazuo T,et al.Multipotential ability of primitive germ cells from neonatal pig testis culturedin vitro,reproduction[J].Fertility and Development,2009,21:696-708.
[19] Kanatsu-Shinohara M,Ogonuki N,Inoue K,et al.Long-term proliferation in culture and germline transmission of mouse male germline stem cells[J].Biology of Reproduction,2003,69:612-616.
[20] Kubota H,Avarbock M R,Brinster R L,et al.Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells[J].Proc Natl Acad Sci USA,2004,101:16489-16494.
[21] Peng Zheng,Zhijun Huang,Zhonghua Lv,et al.Study of several factors affecting on preparation of mouse embryonic stem cells[J].Life Science Journal,2009(1):1-4.
[22] Xiao-yang Zhao,Wei Li,Zhuo Lv,et al.iPS cells produce viable mice through tetraploid complementation[J].Nature,461:86-90.
[23] Xia W,Yannan Z,Zhifeng X,et al.Alternative translation of OCT4 by an internal ribosome entry site and its novel function in stress response[J].Stem Cells,2009,27:1265-1275.

