高温紫链霉菌酸性耐热几丁质酶的纯化及性质研究
杨绍青,张舒平,闫巧娟,刘竹青,江正强,*
(1.中国农业大学食品科学与营养工程学院,北京100083;2.中国农业大学工学院,北京100083;3.中国农业大学水利与土木工程学院,北京100083)
几丁质酶(EC3.2.1.14)是一类重要的糖苷键水解酶,能够催化几丁质水解产生N-乙酰氨基葡萄糖单体或低分子量几丁寡糖[1]。近年来,几丁质酶由于在制备几丁寡糖、处理海洋废弃物以及农业生物防治等方面具有巨大的应用潜力而备受关注。目前几丁质酶已被广泛应用于医药、食品、化妆品、饲料、环保以及能源等领域。几丁质酶广泛存在于细菌、链霉菌、真菌、植物、昆虫甚至脊椎动物中[1-2]。微生物来源的几丁质酶由于具有生产速度快、产量高、性能稳定等优点,目前已成为几丁质酶的主要来源。迄今,已有许多关于不同微生物来源几丁质酶的纯化及性质的研究报道,其中以链霉菌来源为主,主要有灰色链霉菌(Streptomyces griseus)、深蓝紫链霉菌(Streptomyces cyaneus)、弗氏链霉菌(Streptomyces fradiae)、委内瑞拉链霉菌(Streptomyces venezuelae)、天蓝色链霉菌(Streptomyces coelicolor)、红色链霉菌(Streptomyces erythraeus ) 以 及 紫 黑 链 霉 菌(Streptomyces violaceusniger)等[2-4]。耐热几丁质酶具有热稳定性好、可在高温下反应从而加快反应速度、高温条件可减少环境微生物污染等优点,因此,相较中温酶而言更适合于工业化生产和应用。目前关于嗜热菌耐热几丁质酶的研究主要集中于部分嗜热古菌、嗜热细菌及嗜热真菌[5-6],关于嗜热链霉菌耐热几丁质酶的研究报道相对较少。Tsujibo 等[7]从高温紫链霉菌OPC-520 发酵液中纯化得到一种分子量为40ku 的几丁质酶,最适温度和pH 分别为80℃和9.0。Christodoulou 等[8]进一步克隆了高温紫链霉菌OPC-520 的几丁质酶基因chit40,并进行了高效表达,得到分子量为40ku 的重组几丁质酶,该酶的最适温度和pH 分别为60℃和6.0。目前,还没有关于高温紫链霉菌酸性几丁质酶纯化和性质的研究报道。实验室前期从土壤样品中筛选得到一株能够产耐热几丁质酶的嗜热链霉菌Z16,鉴定其为高温紫链霉菌。本研究进一步对该菌所产耐热几丁质酶进行分离纯化,并研究其酶学性质及对胶体几丁质的水解特性,为其今后工业化生产和应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
离子交换层析柱料DEAE-52、凝胶层析柱料Superdex-75 GE Healthcare 公司;几丁质、羧甲基纤维素(CMC) 美国Sigma 公司;乙二醇壳聚糖、乙二醇几丁质 日本Wako 公司;几丁寡糖 中科院微生物所金城教授;低分子量标准蛋白 大连宝生物工程有限公司;其它试剂 若无特殊说明均为分析纯。
TU-1800PC 紫外可见分光光度计 北京普析通用有限公司;蛋白纯化系统 上海青浦沪西仪器厂;硅胶板60F254德国Merck 公司;GL-20B 冷冻离心机 上海安亭科学仪器厂。
1.2 菌株及发酵产酶
菌株:高温紫链霉菌Z16 由实验室筛选并保存。菌株在胶体几丁质平板上50℃培养3~4d 后保存于4℃条件下,每6~7 周转接1 次。平板培养基组成为(g/L):胶体几丁质5,(NH4)2SO42,MgSO4·7H2O 0.5,K2HPO40.3,KH2PO40.7,FeSO40.1,琼脂15,pH值自然。
发酵产酶:首先将1 ~2 环菌种由平板接入到50mL 种 子 培 养 基 中(250mL 三 角 瓶),50℃,200r/min振荡培养18h,即为发酵种子液。然后按5%的接种量接种种子液于发酵培养基中,45℃,200r/min 振荡培养60h。发酵液于4℃下9720 ×g 离心10min,上清液即为几丁质酶粗酶液。
种子培养基组成为(g/L):粉末几丁质10,酵母浸粉5,蛋白胨5,MgSO4·7H2O 0.5,K2HPO40.3,KH2PO40.7,FeSO40.01 和ZnSO40.01,pH 自然。发酵培养基组成为(g/L):胶体几丁质5,粉末几丁质10,酵母浸粉1.25,黄豆粉3.75,吐温20 4,MgSO4·7H2O 0.5,K2HPO40.3,KH2PO40.7,FeSO40.01 和ZnSO40.01,pH 自然。
1.3 酶活力及蛋白含量测定
采用DNS 法测定几丁质酶酶活力。取100μL 胶体几丁质溶液(1%)于1.5mL 离心管中,50℃水浴预热10min,然后向离心管中加入100μL 适当稀释的酶液。50℃反应30min 后加入300μLDNS 试剂终止反应,最后煮沸10min 显色。待反应体系溶液冷却至室温后加入250μL 的去离子水,9720 ×g 离心5min,取上清液于540nm 下测吸光度值。酶活力单位(U)定义为:在上述反应条件下每分钟释放1μmol N-乙酰氨基葡萄糖所需要的酶量,以N-乙酰氨基葡萄糖为标准。
蛋白含量的测定采用Lowry 法[9],以牛血清蛋白作为标准。
1.4 几丁质酶的纯化
首先向粗酶液中缓慢加入40%~80%饱和度的硫酸铵,酶液在4℃下缓慢搅拌30min 后于9720 ×g下冷冻离心10min,收集沉淀,用20mmol/L pH7.0 的磷酸缓冲液溶解沉淀,沉淀溶液在相同的缓冲液中4℃下透析过夜。然后将透析后的蛋白样品以1mL/min的流速上样到预先用20mmol/L 磷酸缓冲液(pH7.0)平衡好的DEAE-52 阴离子交换层析柱中。先用平衡缓冲液以相同的流速洗脱未结合的杂蛋白直至OD280小于0.05,接着用0.5 ~1.0mol/L 梯度的NaCl 溶液(用pH7.0,20mmol/L PB 缓冲液配制)线性洗脱,收集洗脱部分,测定酶活力,SDS-PAGE 检测酶纯度。
1.5 SDS-PAGE 及分子量测定
SDS-PAGE 按Laemmli 等[10]方法进行,分离胶浓度为12.5%(w/v),浓缩胶浓度为4.5%(w/v)。考马斯亮蓝R-250 染色显示蛋白带。依据标准蛋白及待测纯酶在SDS 凝胶上的相对迁移率来计算纯酶在变性条件下的分子量。几丁质酶活性状态下分子量采用凝胶过滤法测定:将纯酶样品和标准蛋白分别以相同的条件过Superdex-75(1.0cm ×40cm)凝胶柱。采用20mmol/L 柠檬酸缓冲溶液(pH6.0)为洗脱液,洗脱流速0.33mL/min。
1.6 几丁质酶的最适pH 与最适温度及pH 与温度稳定性
在不同的pH 条件下测定酶活力以确定酶的最适反应pH。不同缓冲液体系分别为50mmol/L 柠檬酸缓冲溶液(pH3.0 ~6.0)、乙酸-乙酸钠缓冲溶液(pH4.0~6.0)、MES 缓冲液(pH5.5~6.5)、磷酸缓冲溶液(pH6.0~8.0)、CHES(pH8.0~10.0)、CAPS (pH10.0~11.0)和Na2HPO4-NaOH 缓冲液(pH11.0 ~12.0)。几丁质酶的pH 稳定性测定:将酶液在上述不同缓冲液中50℃下处理30min 后按照标准的方法测定残余酶活力。
几丁质酶的最适温度测定:分别在30~90℃下测定酶活力,酶活力最高点即为几丁质酶的最适反应温度。温度稳定性:将纯酶分别在30 ~90℃下保温30min,然后在50℃下测定残余酶活,以未保温(稀释相同倍数后,4℃处理)的酶活力作为100%。几丁质酶的半衰期测定:将酶液在55、60、65、70℃下分别保温300min,间隔取样,测定残余酶活力,以ln(相对残余酶活力)与处理时间作图,然后计算半衰期。
1.7 几丁质酶的底物特异性
分别以1% (w/v)的胶体几丁质、乙二醇几丁质、壳聚糖溶液、乙二醇壳聚糖、CMC、桦木木聚糖、刺槐豆胶、海带多糖及可溶性淀粉(溶解于50mmol/L pH4.0 缓冲液中)作为反应底物,50℃下分别反应10min 测定几丁质酶的酶活力。
1.8 几丁质酶的水解特性及产物分析
在1%的胶体几丁质溶液中加入1U/mL 的几丁质酶,混匀后置于50℃水浴中反应,在不同的时间点取样,样品于沸水中灭活5min 后采用TLC 法分析水解产物。展层体系为正丁醇∶乙酸∶水=2∶1∶1(v∶v∶v)。显色参考Kopparapu 等[11]的方法进行。
2 结果与分析
2.1 几丁质酶的分离纯化
高温紫链霉菌Z16 发酵产几丁质酶的粗酶液经硫酸铵分级沉淀和DEAE-52 弱阴离子交换层析两步纯化后得到电泳级纯酶(图1)。纯化过程酶活力回收率为22.3%,纯化倍数为12.7,比酶活力由2.9U/mg 提高到36.8U/mg(表1)。SDS-PAGE 法和凝胶过滤法测测定几丁质酶的分子量分别为41.6ku(图1)和40.8ku,说明该几丁质酶为单亚基蛋白。
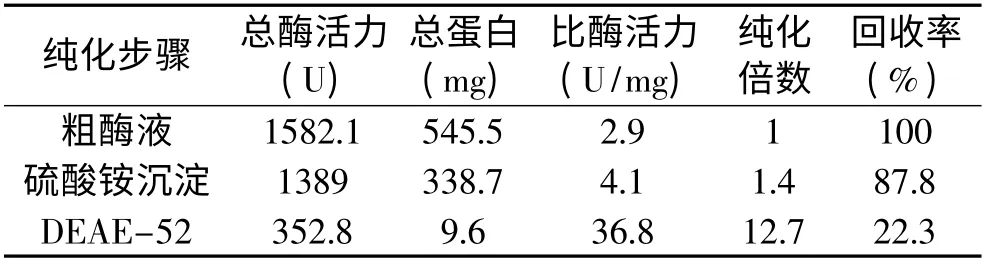
表1 高温紫链霉菌Z16 几丁质酶的纯化Table 1 Purification of the a chitinase from the culture broth of S.thermoviolaceus Z16
不同微生物来源的几丁质酶分子量差异较大,大多处于20~120ku 之间[12]。通常,细菌来源的几丁质酶分子量较大(60~110ku),真菌几丁质酶分子量相对较小(30~60ku),而放线菌来源的几丁质酶一般在30~40ku 左右[13]。本研究中的几丁质酶分子量与来源于高温紫链霉菌OPC-520[7]和浅玫瑰色链霉菌GH-18 的40ku 几丁质酶较为接近[14],但高于其它链霉菌如Streptomyces sp.M-20、Streptomyces sp. DA11和Streptomyces anulatus 等[3-4,15]几丁质酶的分子量。
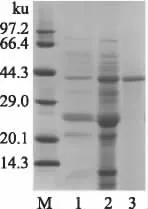
图1 高温紫链霉菌Z16 几丁质酶的纯化电泳图Fig.1 SDS-PAGE analysis of the proteins during the purification process of a chitinase from S.thermoviolaceus Z16
2.2 几丁质酶的最适pH 及pH 稳定性
在不同的pH 条件下测定几丁质酶的酶活力,结果表明该酶的最适反应pH 为pH4.0(柠檬酸缓冲液),在处于pH3.0~6.0 的酸性条件下保持较高的酶活力,当pH >6.0 时,酶活力开始快速下降(图2A),说明该酶是一种酸性几丁质酶。该几丁质酶酶在pH3.0~11.5 的不同缓冲液中处理30min 后残余酶活力仍保存在80%以上(图2B),说明该酶具有很强的pH 稳定性和很宽的pH 稳定范围。
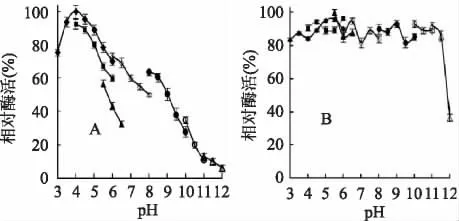
图2 几丁质酶的最适反应pH (A)及pH 稳定性(B)Fig.2 Optimal pH(A)and pH stability(B)of the purified chitinase
虽然微生物几丁质酶的最适pH 差别较大,分布于3.0 至11.0 之间,但绝大多数放线菌几丁质酶的最适pH 都处于偏酸性环境(pH4.0~6.0)。高温紫链霉菌Z16 几丁质酶的最适pH 为4.0,与来源于其它链霉菌的几丁质酶最适pH 接近,如来源于Strptomyces coelicolor A3 的几丁质酶(pH4.0)[16],但明显比同一种属菌株高温紫链霉菌OPC-520 来源的几丁质酶的最适pH9.0 低[17],说明两者性质存在很大差别,并不是同一种几丁质酶。
2.3 几丁质酶的最适温度及温度稳定性
几丁质酶的最适反应温度为60℃(图3A),当温度处于50~70℃之间时,几丁质酶具有较高的酶活力(>60%),而当温度低于50℃或高于70℃时,酶活力迅速下降(图3A)。温度稳定性测定结果表明该几丁质酶具有很好的温度稳定性,60℃下保温30min 后残余酶活力仍保持在80%以上(图3B),当温度继续升高到65℃以上时,残余酶活力开始急剧下降至25%以下(图3B)。进一步测定该酶在不同温度下的半衰期,结果表明该酶在55℃和60℃时具有很好的温度稳定性,半衰期分别为267min 和132.9min(图3C),而当温度提高至65℃和70℃时,该酶的半衰期快速降至16.6min 和13.4min(图3C)。
通常,高温酶相较于中温酶来说具有许多独特的优势,如不易变性、便于储藏、反应速度快、效率高、不易受污染等,因此实际应用的适应性更强。高温紫链霉菌Z16 几丁质酶的最适温度为60℃,比Tsujibo 等[17]报道的高温紫链霉菌来源的几丁质酶最适温度低(80℃),与来自高温紫链霉菌OPC-520 野生型几丁质酶一致(60℃)[8],但明显高于其它链霉菌来源的几丁质酶,如紫黑链霉菌(28℃)[18]、中温链霉菌RC1071(40℃)[19]、海洋链霉菌DA11(40℃)[4]和灰色链霉菌HUT7037(55℃)[2]等。
2.4 几丁质酶的底物特异性及水解特性
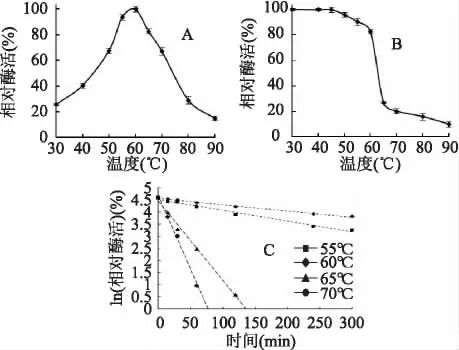
图3 几丁质酶的最适反应温度(A)、稳定稳定性(B)和半衰期(C)Fig.3 Optimal temperature (A),thermostablity (B)and thermal denaturing time (C)of a chitinase from S.thermoviolaceus Z16
几丁质酶的底物特异性见表2。该酶具有严格的底物特异性,对胶体几丁质表现出了最强的水解作用,比酶活力达到36.8U/mg,对乙二醇几丁质、CMC 及壳聚糖溶液只有轻微的水解能力,比酶活力分别仅为3.0、0.6、0.32U/mg,而对乙二醇壳聚糖、刺槐豆胶、海带多糖、桦木木聚糖和可溶性淀粉等其它底物没有水解能力。
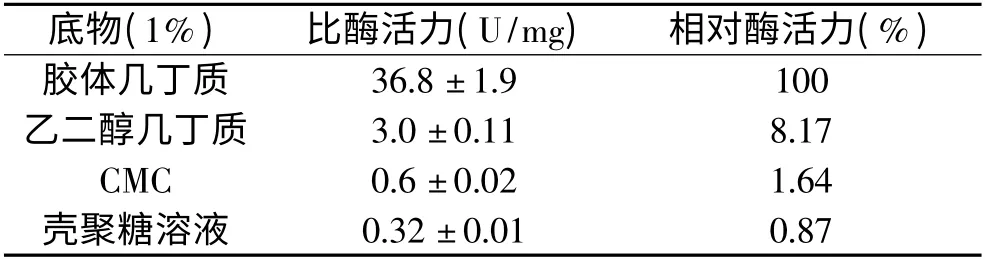
表2 几丁质酶的底物特异性Table 2 Substrate specificity of the purified chitinase
在1%浓度的胶体几丁质溶液中加入1U/mL 的几丁质酶,50℃进行水解反应以考察几丁质酶对胶体几丁质的水解特性。结果表明该几丁质酶能够高效降解胶体几丁质,降解产物主要为N-乙酰氨基葡萄糖和几丁二糖,其次还有少量的几丁三糖生成(图4)。根据该酶水解产物的组成,可判定其为内切几丁质酶。本研究中的几丁质酶显示出严格的底物特异性,仅对胶体几丁质溶液有很强的水解活性,对乙二醇几丁质、CMC 及壳聚糖溶液只有轻微的水解能力,而对其它底物则没有水解能力。这一特性与来源于Streptomyces sp.M-20 的几丁质酶比较接近[3],但是与灰色链霉菌HUT7037 来源的几丁质酶差别较大,后者具有较宽的底物特异性范围,不仅能够水解胶体几丁质,而且还能够水解乙二醇几丁质、羧甲基几丁质以及脱乙酰几丁质等几丁质类化合物[2]。严格的底物特异性使本研究中的酸性耐热几丁质酶适合应用于几丁质资源的高效降解、生物转化等领域。
3 结论
从高温紫链霉菌Z16 发酵液中纯化得到一种几丁质酶。该酶为单亚基蛋白,SDS-PAGE 和凝胶过滤测得分子量分别为41.6ku 和40.8ku。该酶的最适反应pH 和最适反应温度分别为pH4.0 和60℃,且该酶在pH3.0~6.0 时保持较高的酶活力,同时,该酶在55℃和60℃的半衰期分别为267min 和132.9min,表明该酶为一种酸性的耐热酶。该酶能够将胶体几丁质水解成N-乙酰氨基葡萄糖、几丁二糖以和少量的几丁三糖。高温紫链霉菌Z16 这些优良的酶学特性使其具有重要的应用价值和广阔的应用前景。
[1]Bhattacharya D,Nagpure A,Gupta R K.Bacterial chitinases:properties and potential[J].Crit Rev Biotechnol,2007,27(1):21-28.
[2]Mitsutomi M,Hata T,Kuwahara T. Purification and characterization of novel chitinases from Streptomyces griseus HUT6037[J].J Ferment Bioeng,1995,80:153-158.
[3]Kim KJ,Yang YJ,Kim JG.Purification and characterization of chitinase from Streptomyces sp.M-20[J].J Biochem Mol Biol,2003,36(2):185-189.
[4]Han Y,Yang B,Zhang F,et al.Characterization of antifungal chitinase from marine Streptomyces sp.DA11 associated with South China Sea sponge Craniella australiensis[J].Mar Biotechnol,2009,11(1):132-140.
[5]Tanaka T,Fujiwara S,Nishikori S,et al.A unique chitinase with dual active sites and triple substrate binding sites from the hyperthermophilic archaeon Pyrococcus kodakaraensis KOD1[J].Appl Environ Microbiol,1999,65(12):5338-5344.
[6]郭润芳,史小琴,李多川,等.一种耐热几丁质酶的产生及其稳定性研究[J].微生物学通报,2008(4):481-485.
[7]Tsujibo H,Hatano N,Endo H,et al. Purification and characterization of a thermostable chitinase from Streptomyces thermoviolaceus OPC-520 and cloning of the encoding gene[J].Bio Biotechnol Biochem,2000,64(1):96-102.
[8]Christodoulou E,Duffner F,Vorgias C E.Overexpression,purification,and characterization of a thermostable chitinase(Chi40)from Streptomyces thermoviolaceus OPC-520[J].Protein Express Purif,2001,23(1):97-105.
[9]Lowry O H,Rosebrough N J,L F A,et al.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[10]Laemmli U K,Molbert E,Showe M,et al.Form-determining function of the genes required for the assembly of the head of bacteriophage T4[J].J Mol Biol,1970,49(1):99-113.
[11]Kopparapu N K,Liu Z Q,Yan Q J,et al. A novel thermostable chitinase (PJC) from pomegranate (Punica granatum)juice[J].Food Chem,2011,127:1569-1575.
[12]余长缨,韩宝芹,李静,等.海洋弧菌几丁质酶的产酶条件及分离纯化研究[J].高技术通讯,2002(9):70-73.
[13]王伟霞,李福后.微生物几丁质酶的研究进展[J].安徽农业科学,2007,32:10196-10198.
[14]Jiang X Y,Chen D C,Hong S L,et al.Identification,characterization and functional analysis of a GH-18 chitinase from Streptomyces roseolus[J].Carbohydr Polymer,2011,87(4):2409-2415.
[15]Aly M M,Tork S,Al- Garni S M.Chitinolytic enzyme production and genetic improvement of a new isolate belonging to Streptomyces anulatus[J].Ann Microbiol,2011,61(3):453-461.
[16]Kawase T,Yokokawa S,Saito A,et al. Comparison of enzymatic and antifungal properties between family 18 and 19 chitinases from S.coelicolor A3(2)[J].Bio Biotechnol Biochem,2006,70(4):988-998.
[17]Tsujibo H,Endo H,Minoura K,et al.Cloning and sequence analysis of the gene encoding a thermostable chitinase from Streptomyces thermoviolaceus OPC-520[J].Gene,1993,134(1):113-117.
[18]Shekhar N,Bhattacharya D,Kumar D,et al.Biocontrol of wood-rotting fungi with Streptomyces violaceusniger XL-2[J].Can J Microbiol,2006,52(9):805-808.
[19]Gomes R C,Semedo L T,Soares R M,et al.Purification of a thermostable endochitinase from Streptomyces RC1071 isolated from a cerrado soil and its antagonism against phytopathogenic fungi[J].J Appl Microbiol,2001,90(4):653-661.

