HPLC 法测定人血浆中5-氟尿嘧啶的浓度
叶丽卡,谢志红,陈瑞卿(广州医学院第二附属医院,广州 510260)
5-氟尿嘧啶(5-Fluorouracil,5-FU)是尿嘧啶的类似物,可以使合成脱氧核糖核酸(DNA)的胸腺嘧啶合成酶失活,也可直接替代尿嘧啶掺入核糖核酸(RNA),导致致死合成。因此,在消化道、头颈部肿瘤等多种恶性肿瘤的治疗中,5-FU是最常用的基础药物[1,2]。5-FU在体内代谢半衰期短、毒副反应大,且吸收不规则、个体消除呈非线性,若体内浓度过高时会发生典型的毒副反应如胃肠道毒性和骨髓抑制,还会在生长迅速的正常组织中产生一些毒性作用,包括中枢系统(如小脑变性、共济失调、嗜睡)、心血管系统及皮肤(如手足综合征、感觉迟钝)等毒性作用。因此,有必要建立测定人体血浆5-FU浓度水平的方法用于药动学以及相关研究。众多文献报道用高效液相色谱(HPLC)法成功测定5-FU前体类药物在肺癌、乳腺癌、肝癌、胃癌、直肠癌的癌组织、血液、正常组织中不同时间点的浓度变化[3~6],但方法往往检测限过高或者难以重复。本试验旨在建立一种快速、灵敏、准确的测定人体血浆内5-FU血药浓度的方法,为下一步研究该药在我国人群的药动学打下基础。
1 仪器与试剂
1.1 仪器
高效液相色谱系统,包括LC-10ATVP双泵、SPD-M10AVP可变波长紫外检测器、CTO-10AVP柱温箱、SIL-10ADVP自动进样器、CBM-10A系统控制器、DGU-12A脱气装置、LC solution工作站(日本岛津公司);XW-80涡旋混合器(上海医科大学仪器厂);B160A型医用低速离心机(河北白洋离心机厂);5417R小型台式高速离心机(德国Eppendorf公司);真空离心浓缩仪(美国Thermo公司)。
1.2 试药
5-FU对照品(美国Sigma公司,批号:097K1352,纯度:99%);其余试剂均为分析纯;所用超纯水为自制去离子水。
2 方法与结果
2.1 色谱条件
色谱柱:Ultimate C18色谱柱(250mm×4.5mm,5μm);流动相:10mmol·L-1KH2PO4溶液;流速:1.0m L·min-1;检测波长:265 nm;柱温:40℃;进样量:20μL。
2.2 对照品溶液配制
准确称取5-FU对照品30.7mg至25m L量瓶,加入1m L盐酸,最后用蒸馏水定容至刻度,得到1.228mg·m L-1的5-FU对照品溶液。
2.3 血浆样品处理方法
取血浆100μL,置于5m L玻璃试管中,加入乙酸乙酯2 m L,涡旋振荡2min后,3 200 r·min-1离心5min,取上层析液置于另一玻璃试管中;再次加入乙酸乙酯2m L进行第2次提取,涡旋振荡2min后,3 200 r·min-1离心5min,取上层析液。合并2次提取的上层析液,离心浓缩挥干,加入100μL流动相,混匀取出,置于EP管中,10 000 r·min-1离心7min,取上清液20μL进样。
2.4 专属性考察
将取空白血浆200μL按“2.3”项下方法操作,取上清液20 μL进样分析,得到空白血浆色谱图,判断空白血浆的干扰情况;取5-FU对照品20μL进样分析,得到5-FU对照品色谱图,判断5-FU在本文方法条件下出峰情况;将空白血浆和5-FU对照品混合,按“2.3”项下方法操作,取上清液20μL进样分析,得血浆+5-FU对照品色谱图。高效液相色谱图见图1。

图1 高效液相色谱图A.5-FU对照品;B.空白血浆+5-FU对照品;C.空白血浆;1.5-FUFig 1 HPLC chromatogram sA.5-FU control;B.blank plasma+5-FU control;C.blank plasma;1.5-FU
2.5 线性关系考察
取空白血浆8份,分别加入由5-FU对照品和蒸馏水配制的系列标准液适量并混匀,使血浆中药物浓度分别为0.48、0.96、1.92、3.84、7.68、15.35、30.7、61.4μg·m L-1,按“2.3”项下方法处理,最后分别取20μL进样,经HPLC法分析,得到5-FU各浓度峰面积(A)。以峰面积(A)对相应浓度(c)进行回归分析,得到5-FU的回归方程为A=0.542 2c-0.091 8(r=0.999 8,n=8)。结果表明,5-FU血药浓度在0.48~61.4μg·m L-1范围内线性关系良好。
2.6 精密度及回收率试验
配制5-FU低、中、高(1.92、7.68、30.7μg·m L-1)3种不同浓度的含药标准血浆,按“2.3”项下方法处理,每个浓度进行5样本分析,于同日内和连续3 d内分别处理测定。将测得的峰面积代入标准曲线,得相应浓度,计算RSD;与理论浓度相比,求得方法回收率,详见表1。
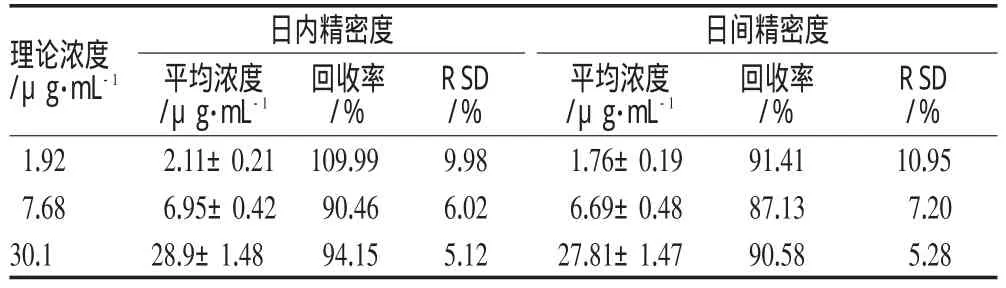
表1 精密度及方法回收率试验结果(n=5)Tab 1 Resultsof precision andmethodology recovery tests
2.7 样品稳定性试验
配制含5-FU 1.92、7.68、30.1mg·L-1的3组共15个样品,分别考察室温放置(1、2、3 d)稳定性、长期冻存(-20℃冻存10、20、30 d)以及冻融稳定性(冻融1、2、3次),按“2.3”项下方法分别进行操作及测定,结果其RSD均<10%。
2.8 样品质量控制试验
分别配制成低、中、高浓度(1.92、7.68、30.1mg·L-1)的血浆样品各12份,置-20℃冻存备用。每次检测血样时同时检测3种质量浓度质控样品,如果相对回收率落在85%~115%之间,即可认为检测正常,否则须检查整个操作过程以及仪器原因。在本试验中,检测的质控样品均在规定范围内,则可认为仪器处于正常状态。
3 讨论
5-FU水溶性很大,在本研究建立的方法中,笔者用纯磷酸盐作为流动相,流动相中不含有机溶剂,容易长菌变质,因此,要注意即时冲洗管道,以免造成污染和堵塞;同时,应注意选用适用于水溶性物质的色谱柱,以免出现色谱柱寿命过短而造成损失和延误试验进程。
因为5-FU为水溶性较强的物质,因此,在部分文献中,采用了蛋白沉淀法处理血浆样品。本研究中笔者发现,若用高氯酸、乙腈、甲醇等沉淀蛋白,在5-FU出峰时间均存在干扰,无法消除或与待测物质分离;另外,蛋白沉淀法往往稀释了药物浓度,而5-FU在血浆中浓度较低,因此,用有机溶剂提取后浓缩更利于提高检测灵敏度。笔者曾尝试用二氯甲烷、异丙醇、氯仿、乙酸乙酯等作为提取溶剂,经比较,乙酸乙酯作为提取溶剂时,提取率最好、干扰少。因此,选用乙酸乙酯作提取溶剂。
经过方法学验证,该方法符合生物样本测定的要求,与文献报道的5-FU测定方法相比,整个试验过程中所用试剂成本低,适合大样本研究中血浆中5-FU浓度的测定。该方法具有操作简便可靠、准确、稳定性高等特点,适用于人血浆中5-FU的浓度测定。该方法的建立可以为5-FU的人体药动学相关研究提供参考。
[1]黎远冬,梁宁生,韦劲松,等.HPLC法同时测定人血浆中5-氟尿嘧啶及其活性代谢物5-氟-2脱氧尿嘧啶核苷的浓度[J].药物分析杂志,2007,27(4):494.
[2]刘传华,刘师莲,卞继峰,等.HPLC快速测定5-氟尿嘧啶血药浓度[J].药物分析杂志,2002,22(2):96.
[3]陆基宗,温 浩,许英华,等.肝癌患者5-氟尿嘧啶血药浓度的监测与测定方法的改进[J].中国医院药学杂志,2004,24(2):83.
[4]姚水宝,杨水新.高效液相色谱法测定人血清中5-氟尿嘧啶的浓度[J].中国药房,2001,12(4):227.
[5]Licea-Perez H,Wang S,Bowen C.Developmentof a sensitive and selective LC-MS/MSmethod for the determination of alpha-fluoro-beta-alanine,5-fluorouracil and capecitabine in human plasma[J].JChromatogr B Analyt Technol Biomed Life Sci,2009,877(11):1 040.
[6]Kosovec JE,Egorin MJ,Gjurich S,et al.Quantitation of 5-fluorouracil(5-FU)in human plasma by liquid chromatography/electrospray ionization tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2008,22(2):224.

