脑缺血后大鼠脑实质DNA损伤修复相关基因Gadd45β蛋白的表达
李建瑞 李长清 刘迎梅 刘 彬 (重庆医科大学附属第二医院神经内科,重庆 400010)
近年来有研究表明〔1〕,生长抑制与DNA损伤修复基因β(Gadd45β)缺失的大鼠在活动诱发的成熟海马区神经祖细胞增殖和新生神经元的树突增长中存在明显缺陷。Gadd45β可能是参与调节神经元回路活化、DNA修饰与成年脑内神经再生外源性调节因子分泌的关键环节之一。但脑缺血性损伤后Gadd45β的表达变化及其作用不清楚,本研究通过检测在缺血周边区Gadd45β蛋白的表达变化,探讨其在脑缺血后促损伤的神经元再生和神经修复方面的作用。
1 材料与方法
1.1 实验动物分组及动物模型制作 健康SD大鼠94只,雄性,鼠龄3个月左右,体重250~280 g(由重庆医科大学动物中心提供),将94只大鼠随机分成正常大鼠组4只、假手术组30只、脑I/R对照组30只和腹腔注射PDTC组(PDTC组)30只,除正常组外,各组又分别分成缺血再灌注后6、12、24、48及72 h组5个亚组,每个亚组6只。脑I/R组和PDTC(四氢化吡咯二硫代氨基甲酸酯)组各大鼠均采用Zea等〔2〕的线栓法,建立大鼠左侧大脑中动脉阻塞(MCAO)模型,缺血2 h后再灌注,脑I/R对照组各大鼠在再灌注后0.5 h腹腔注射生理盐水(100 mg/kg),PDTC组各大鼠缺血再灌注后0.5 h腹腔注射PDTC(100 mg/kg)。以清醒后出现对侧上肢为重的瘫痪及同侧Homer征为模型成功的判断标准。假手术组除插线1 cm同时腹腔注射同等剂量的生理盐水外,其余步骤同PDTC组。正常大鼠不经任何处理直接取材检测。
1.2 运动功能评分 参照 Zea Longa〔2〕的5分法进行评分。术后大鼠清醒时(多为术后1.5~3 h)进行第一次评分,术后24 h、72 h 再次评分。
1.3 标本采集及细胞学检查 试验组动物在规定时间点取材,40 g/L多聚甲醛(4℃)经心脏灌注固定,立即取脑自视交叉平面向后冠状切开制成5 mm厚的组织块,用4%多聚甲醛固定24 h后,常规脱水、透明、浸蜡、包埋,切片厚4 mm,HE染色,光镜高倍镜(400倍)下,随机观察缺血周围6个不重叠的视野,每个视野不少于100个细胞,取其平均数。
1.4 Gadd45β蛋白的检测 采用免疫组化(SABC)法,Gadd45β为兔多克隆抗体(Santa Cruz公司提供)稀释度为1∶50。按照试剂盒说明书操作,DAB显色,苏木素轻度复染,脱水,透明,封片。取缺血后再灌注各组大脑切片如0.01 mol/L PBS代替一抗孵育时,Gadd45β蛋白质免疫反应阴性,表明一抗的特异性较强。
1.5 半定量分析Gadd45β蛋白 采用Western印迹法,在相应时相点处死大鼠,按照凯基全蛋白提取说明书提取全蛋白,应用Bradford法测定提取物的蛋白浓度,用12%分离胶行蛋白SDS-PAGE变性电泳,分离含一定量蛋白的全蛋白抽提物,检测Gadd45β和β-actin时每泳道蛋白加样量均为40 μg。电泳结束,将蛋白电转印至 PVDF膜;TBS洗膜后,用一抗工作液孵膜,4℃过夜 (16~18 h);TBST缓冲液洗膜3次,用HRP标记二抗工作液孵膜,37℃1 h;洗膜3次,ECL化学发光法显影、拍照,实验重复5次,图像处理系统对条带进行灰度值测定。以β-actin为 内 参 照,一 抗 为 小 鼠 抗 β-actin单 克 隆 抗 体(1∶1000),二抗为 HRP标记羊抗小鼠 IgG(1∶1000)。Western印迹膜片用Chemi Doc-XRS系统扫描,并用 QuantityOne 4.6版图像分析软件(Bio-Rad公司产品)测量Gadd45β蛋白和内参照β-actin蛋白各显色条带的平均光密度值,以Gadd45β与对应的内参照 β-actin蛋白显色条带的 OD值的比值标示Gadd45β蛋白相对表达量。
1.6 统计学分析 采用SPSS13.0统计软件,计量资料用±s表示,多组间比较用单因素方差分析,两组间比较采用t检验。
2 结果
2.1 大鼠运动功能评分 脑I/R组和PDTC组大鼠在术后清醒时评分相近,两组大鼠在造模术后各时间点神经功能缺损评分变化趋势相同,腹腔注射PDTC后大鼠在术后24 h,72 h的评分较脑I/R组高,但第72小时评分有统计学意义(P<0.05)。见表1。
表1 各组大鼠不同时间点神经功能评分( ± s,n=6)

表1 各组大鼠不同时间点神经功能评分( ± s,n=6)
与脑I/R对照组比较:1)P<0.05
72 h假手术组组别 再灌注后清醒 再灌注后24 h 再灌注后0.00±0.00 0.00±0.00 0.00±0.00脑I/R组 2.83±0.41 2.42±0.49 1.83±0.26 PDTC组 2.82±0.40 2.67±0.41 2.33±0.521)
2.2 各组大鼠脑组织Gadd45β的表达 正常大鼠可见少许Gadd45β蛋白表达,位于神经元细胞核,被染成棕黄色,主要见于海马。假手术组大鼠脑组织中Gadd45β蛋白免疫反应阳性细胞与正常大鼠比较无明显差别。在脑I/R组大鼠Gadd45β蛋白的免疫阳性反应见于细胞核,主要在缺血区皮质缺血半暗带表达,而缺血中心区则很少。与假手术组相比,不同时间点MCAO大鼠缺血对侧Gadd45β蛋白的表达无显著增加,在再灌注后6 h缺血侧Gadd45β蛋白阳性细胞数开始增多,12 h进一步增多,24 h达到高峰,之后开始下降,48 h,72 h进一步下降但仍高于假手术组主要见于缺血侧皮层的顶叶区,在丘脑也有表达。PDTC组在各时间点阳性细胞数均显著少于脑I/R组,高于假手术组,但Gadd45β蛋白表达与脑I/R组呈现相同变化趋势。见图1,表2。
2.3 半定量检测各组大鼠脑组织Gadd45β蛋白表达 脑I/R组Gadd45β蛋白在缺血再灌注后6 h开始升高,12 h进一步增多,24 h达到高峰,48 h有所下降,72 h进一步下降,差异有统计学意义(P<0.05)。PDTC组在各时间点Gadd45β蛋白表达与脑I/R组呈现相同趋势但明显低于脑I/R组,差异有统计学意义(P<0.05)。见图2,表3。
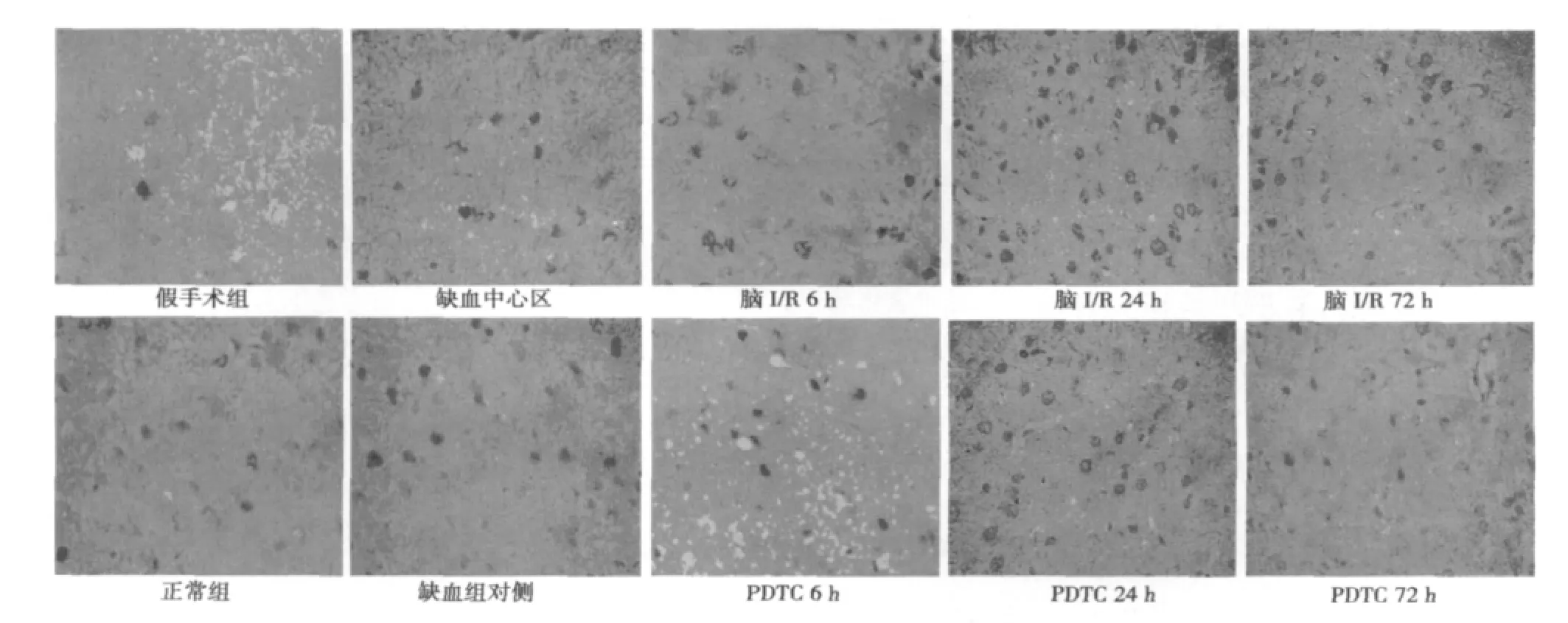
图1 各组大鼠Gadd45β表达(×400)
表2 各个时间点Gadd45β蛋白的表达情况(细胞数/视野, ± s,n=6)
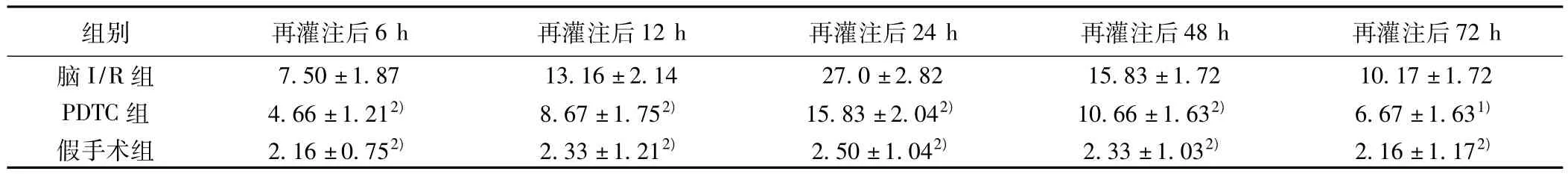
表2 各个时间点Gadd45β蛋白的表达情况(细胞数/视野, ± s,n=6)
与脑I/R组比较:1)P<0.05,2)P<0.01,下表同
72 h脑I/R组 7.50±1.87 13.16±2.14 27.0±2.82 15.83±1.72 1组别 再灌注后6 h 再灌注后12 h 再灌注后24 h 再灌注后48 h 再灌注后0.17±1.72 PDTC组 4.66±1.212) 8.67±1.752) 15.83±2.042) 10.66±1.632) 6.67±1.631)假手术组 2.16±0.752) 2.33±1.212) 2.50±1.042) 2.33±1.032) 2.16±1.172)
表3 各组大鼠各个时间点Gadd45β蛋白的表达(n=6,±s)

表3 各组大鼠各个时间点Gadd45β蛋白的表达(n=6,±s)
72 h脑I/R对照组 0.93±0.017 0.99±0.015 1.10±0.055 0.90±0.033组别 再灌注后6 h 再灌注后12 h 再灌注后24 h 再灌注后48 h 再灌注后0.84±0.017 PDTC组 0.85±0.0212) 0.87±0.0122) 0.91±0.0222) 0.83±0.0101) 0.80±0.0202)

图2 Western印迹检测各时间点Gadd45β蛋白表达
3 讨论
最新研究表明,在缺血后的神经元中,可以引起DNA单链及双链损伤或断裂,进而导致神经元损伤和死亡〔3,4〕。大量的研究已发现损伤的DNA可以引起Gadd45的表达增多。作为DNA损伤及诱导相关基因 Gadd45,由 Gadd45α、Gadd45β 和Gadd45γ 三种亚型组成〔5〕。
近年来已有研究表明脑缺血后Gadd45的表达在促进受损的脑组织修复和抗损伤方面发挥着重要作用。研究发现出生后7日的新生小鼠脑缺血后受损脑组织的中有Gadd45蛋白的大量表达,推测Gadd45在对抗过氧化物引起的脑组织损伤和促进神经元修复中发挥重要作用〔6〕。Jin等〔7〕发现,局限性脑缺血4h后的大鼠,在其缺血的皮层开始出现Gadd45 mRNA的表达,而在缺血24 h后则主要表达在缺血半暗带区域内。本文发现在脑缺血再灌注后6 h时Gadd45β蛋白开始增多,24 h达到高峰,之后开始下降,但72 h仍高于假手术组,提示脑缺血可诱导持续达72 h以上的Gadd45β蛋白表达增加。
我们在研究中发现,PDTC组的大鼠在腹腔注射四氢化吡咯二硫代氨基甲酸酯后,大鼠缺血脑组织Gadd45β蛋白表达增加受到明显抑制,提示四氢化吡咯二硫代氨基甲酸酯可抑制脑缺血诱导的Gadd45β表达。四氢化吡咯二硫代氨基甲酸酯为NF-κB的抑制剂。Jin等〔8〕研究发现在外界压力和细胞因子的刺激下NF-κB的亚单位RelA可以激活Gadd45β的表达。由以上研究提示脑缺血诱导的Gadd45β表达可能受到NF-κB信号通路活动的调控。
Bin等〔9〕研究认为Gadd45β对受到氧化应激和化学药物的刺激发生损伤和变性的视网膜神经节细胞具有保护作用,有抑制视网膜神经节细胞变性的作用。Gadd45β不仅对大鼠受损神经节细胞具有保护作用而且可能对中枢神经系统中其他受损神经元也有保护作用。脑缺血诱导的Gadd45β表达主要在缺血区皮质缺血半暗带,而缺血中心区则很少。已有大量研究表明脑缺血后存在氧化应激,Ca内流等引起的神经元的损伤。由此提示Gadd45β对脑缺血后氧化应激损伤的神经元也有可能有神经保护和促进受损神经元修复的作用。我们通过对造模术后不同时点大鼠运动功能评分后发现,与脑I/R组比较PDTC组大鼠造模术后肢体活动恢复受到明显的抑制,证明抑制了Gadd45β的表达不利于瘫痪肢体的恢复,进一步说明Gadd45β有神经康复作用。
近年来的研究发现大鼠脑缺血后可以引起BDNF和FGF-1等外源性神经生长因子的表达和分泌增加。已有大量研究表明在神经系统发育、成熟过程中维持神经元功能和神经元损伤后的再生修复和防止神经细胞退行性变等多方面BDNF和FGF-1发挥着重要作用。Alam等〔10〕研究发现FGF-1的启动因子B是FGF-1基因表达的必要因子,其在调控FGF-1基因的转录和翻译中发挥着重要的作用。有研究发现〔11〕BDNF调节区Ⅸ的启动可促进更多的BDNF表达,抑制DNA甲基化酶的活动可使得BDNF调节区Ⅸ的DNA不发生甲基化从而对调节区Ⅸ的启动有促进作用。说明BDNF调节区ⅨDNA脱甲基有促进BDNF表达作用。研究发现,电刺激可以诱导脑组织Gadd45β的表达,大鼠缺失Gadd45β基因后,在电刺激等活动诱发的成熟海马区神经祖细胞增殖和新生神经元树突生长中存在明显缺陷,Gadd45β通过调节BDNF和FGF-1的脱甲基化促进BDNF等以旁分泌的形式分泌〔1〕。BDNF和 FGF-1分泌到脑组织中后就可以发挥其营养神经元和促进树突生长的作用。以上这些研究发现提示,Gadd45β在调节神经修复和再生中,可能是最关键的环节之一,对其调控机制及其在神经修复中的作用进行系统深入研究有可能对脑卒中后的神经功能康复治疗等方面带来新思路。
1 Ma DK,Jang MH,Guo JU,et al.Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis〔J〕.Science,2009;323(5917):1074-7.
2 Zea Longa EL,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without cranie-ctomy in rat〔J〕.Strok,1989;20(1);84-91.
3 Bottiger BW,Schmitz B,Wiessner C.Neuronal stress response and neuro-nal cell damage after cardiocirculatory arrest in rats〔J〕Neuroscience,1996;92(4):1324-35.
4 Lai H,Sigh NP.Single-and double-strand DNA breaks in rat brain cells after acute exposure to radio-frequency electromagnetic radiation〔J〕.Int J Rad Biol,1996;69:513-21.
5 Chi H,Lu B,Takekawa M,et al.GADD45beta/GADD45gamma and MEKK4 comprise a genetic pathway mediating STAT4-independent IFN gamma production in T cells〔J〕.EMBO J,2004;23:1576-786.
6 Charriaut-Marlangue C,Richard E,Ben-Ari Y.DNA damage and DNA damage-inducible protein Gadd45 following ischemia in the P7 neonatal rat〔J〕.Brain Res Dev Brain Res,1999;116(2):133-40.
7 Jin K,Chen J,Kawaguchi K,et al.Focal ischemia induces expression of the DNA damage-inducible gene GADD45 in the rat brain〔J〕.J Neuroreport,1996;7:1797-802.
8 Jin R,De Smaele E,Zazzeroni F,et al.Regulation of the Gadd45beta promoter by NF-kappaB〔J〕.DNA Cell Biol,2002;21(7):491-503.
9 Bin L,Genn S,Salvatore P,et al.Growth arrest and DNA damage protein 45b(Gadd45β)protects retinal ganglion cells from injuries〔J〕.J Neurobiol Dis,2009;33(1):133-40.
10 Alam KY,Frostholm A,Hackshaw KV.Characterization of the 1B promoter of fibroblast growth factor 1 and its expression in the adult and developing mouse brain〔J〕.J Biol Chem,1996;271:30263-71.
11 Aid T,Kazantseva A,Piirsoo M,Palm K,et al.Mouse and rat BDNF gene structure and expression revisited〔J〕.J Neurosci Res,2007;85:525-35.

