早期免疫型肠内营养对胃癌新辅助化疗患者术后康复的作用研究
张 斌 杨铁军 陈小兵 姬社青 金 歌 曹新广
1.河南省肿瘤医院普通外科,河南 郑州 450007;2.河南省肿瘤医院肿瘤内科,河南 郑州 450007;3.郑州大学第一附属医院心内科,河南 郑州 450052;4.河南省肿瘤医院内镜中心,河南 郑州 450007
胃癌是我国常见恶性肿瘤之一[1]。患者术后能否顺利康复是患者能否获得长期生存的关键,多器官功能障碍综合征(MODS)是患者术后死亡的常见原因之一,全身炎症反应综合征(SIRS)是MODS的起点,化疗后患者白细胞下降,组织抗感染能力下降,因此加速化疗患者术后康复是患者治疗重点。近年来,肠内营养的进展之一就是免疫型肠内营养。免疫型肠内营养(瑞能)具有抗炎作用,成为近年研究热点[2]。为探讨免疫型肠内营养对胃癌新辅助化疗患者炎症反应的调节作用,本组对接受新辅助化疗的手术患者进行了前瞻性研究,以进一步为免疫肠内营养的临床应用提供依据。
1 资料与方法
1.1 一般资料
本组60例患者,男34例,女26例,按住院号奇偶数分为治疗组(30 例)与对照组(30 例)。治疗组年龄(57.1±9.7)岁,对照组年龄(54.6±8.5)岁;为2009年2月~2011年5月河南省肿瘤医院治疗患者,术前均经病理学检查证实为胃体上部或贲门部腺癌,无消化道梗阻,未行其他治疗,经CT检查为cT3~4N0~3M0患者,无严重心肺功能疾病,KPS评分≥95分。术前行新辅助化疗2~3个周期,2~4周后再行手术治疗。
1.2 治疗方法
新辅助化疗采用mFOLFOX-6方案(奥沙利铂85 mg/m2,ivgtt,第 1 天;亚叶酸钙 200mg/m2,ivgtt,第 1 天;5-FU400mg/m2,iv,第 1 天;5-FU 2 400 mg/m2,46 h,持续 iv;14 d 重复 1 次,为1周期)。化疗前常规给予抗过敏及昂丹司琼止吐治疗,保肝辅助治疗,完成2个周期,观察疗效。手术方式为D2或D3全胃切除术(Roux-en-Y吻合)。对照组(30例)术后常规治疗,抗炎(二代头孢菌素),化痰(氨溴索注射液 150 mg,ivgtt,bid),保肝(促肝细胞生长素),免疫[胸腺法新,1.6 mg,ih,qod,肠外支持治疗(卡文)等];患者肠道排气后加用肠内营养。治疗组(30例)术后常规治疗基础上,于术日应用瑞能40 mL及术后第1天应用瑞能200 mL,术后2~6 d根据患者耐受情况应用瑞能500~1 500 mL。采用鼻空肠营养管途径,营养管末端位于空肠屈氏韧带下约45 cm(Roux-en-Y吻合,空肠空肠吻合口下30 cm),将肠内营养液滴注到患者的空肠。用输液泵控制滴速,速度在20~80 mL/h。治疗期间每天观察并记录患者有无恶心、呕吐、腹胀、腹痛、腹泻等症状。两组静脉营养液均应用1 440 mL卡文提供能量,并补充电解质、维生素和微量元素。
1.3 观察指标
观察两组患者化疗副反应(血液系统,消化系统及神经系统)发生率及分级;观察两组手术风险:术后SIRS发生率,吻合口瘘,切口感染情况及术后血液感染,导管相关感染,肺部感染发生率,及术后2、4、6 d C反应蛋白(C-reactive protein,CRP)情况;首次肠道排气时间;SIRS判断标准:具有以下2项或>2项:①体温>38.0℃;②心率>90次/min;③呼吸>20次/min;④白细胞数>12.0×109/L;
1.4 统计学方法
采用SPSS 13.0软件进行统计分析,计量资料以均数±标准差()表示。两独立样本的计量资料采用t检验;重复测量的计量资料采用方差分析,两两比较采用LSD-t检验。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
本组患者早期给予免疫型肠内营养,并逐渐增量,患者肠道耐受良好,无明显腹胀腹泻发生。两组患者在性别,年龄方面比较,差异无统计学意义(P>0.05),对化疗耐受性良好,化疗不良反应以消化道反应、骨髓抑制及周围神经毒性为主,无危及生命不良反应发生[3];化疗后2~4周化疗不良反应消失,无手术禁忌证。见表1。
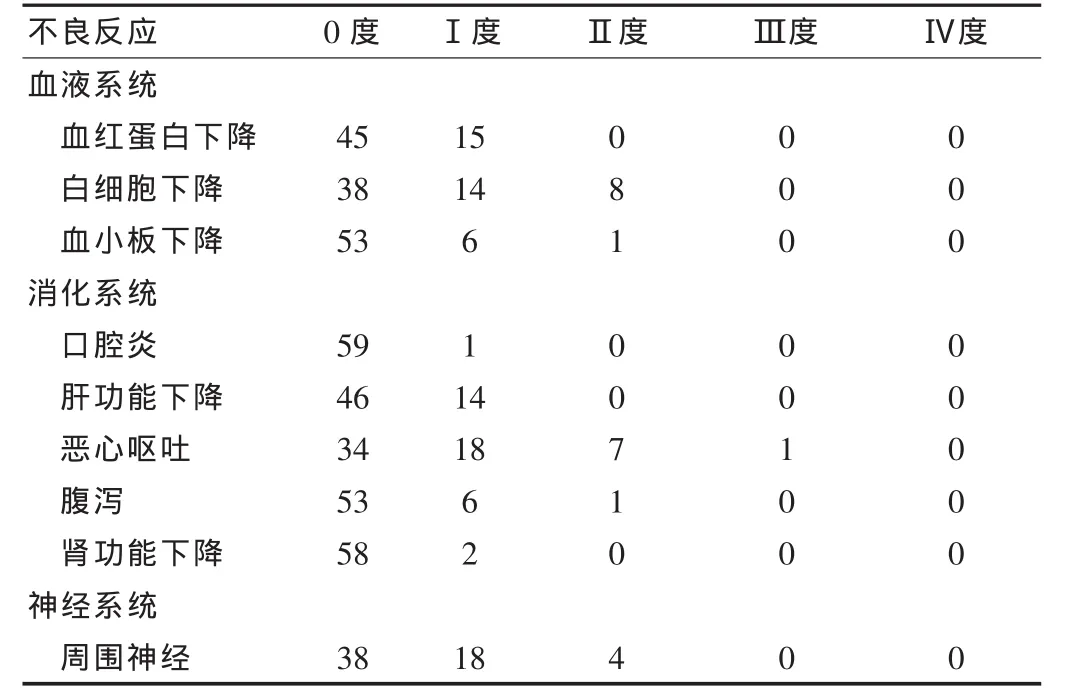
表1 化疗不良反应发生及分级(例)
2.2 患者术后SIRS发生例数及相关感染发生例数比较
对照组1例吻合口瘘,瘘口小,保守治疗1周,术后半个月痊愈出院。所有感染患者均经对症治疗后痊愈,未延长住院时间,无死亡病例发生。两组术后第2天SIRS发生例数、吻合口瘘及切口感染、血液感染、导管相关感染、肺部感染比较,差异均无统计学意义(P>0.05);术后4、6 d SIRS发生例数治疗组明显低于对照组,差异有统计学意义(P<0.05)。见表2。
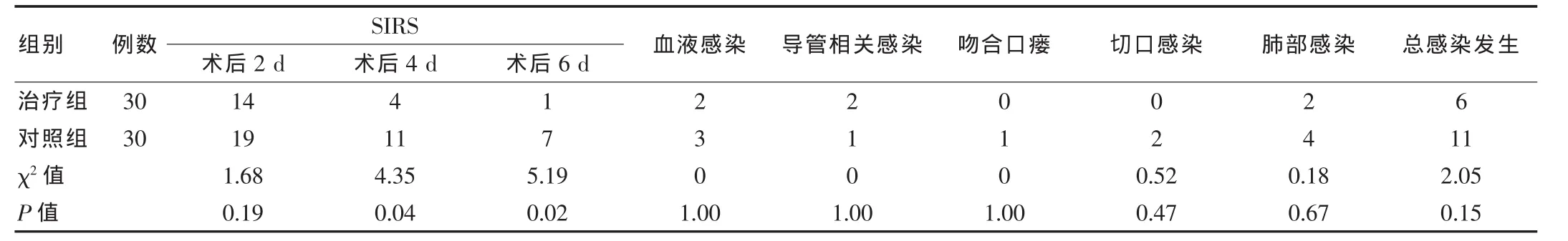
表2 患者术后SIRS发生例数及相关感染发生例数比较(例)
表3 患者白细胞、CRP及排气时间比较()
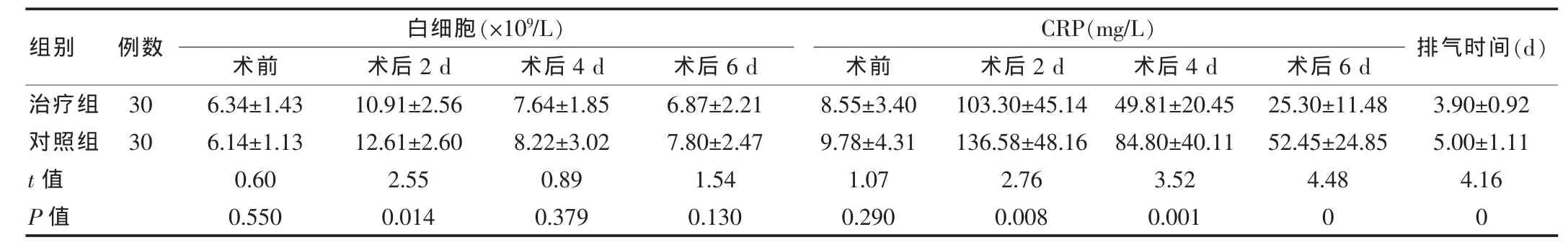
表3 患者白细胞、CRP及排气时间比较()
2.3 患者白细胞、CRP及排气时间比较
两组患者术后2、4、6 d CRP检测值比较及术后首次排气时间比较,差异均具有高度统计学意义(P<0.01);术后第2天白细胞恢复情况治疗组低于对照组,差异具有统计学意义(P<0.05);第4、6天白细胞恢复情况治疗组低于对照组,但两组比较差异无统计学意义(P>0.05)。见表3。
3 讨论
胃癌患者常有不同程度的营养不良和免疫功能低下,化疗后患者白细胞不同程度下降,肠内营养支持治疗对胃癌术后患者减少并发症、促进恢复、提高肿瘤患者对治疗的耐受性都有一定的作用。炎症反应是机体抗病和自我保护的重要防御机制。炎症可启动组织愈合、免疫反应,但过度的炎症反应,可造成组织、器官的损害,甚至引起功能障碍[4];减少胃癌患者术后过度炎症反应,是胃癌患者术后顺利康复的重要环节。免疫型肠内营养就是在标准肠内营养的基础上添加一些免疫增强剂或使某种营养素达到药理学剂量,瑞能是一种高能量、高脂肪、低碳水化合物的整蛋白纤维型肠内营养乳剂,富含免疫增强物质核昔酸、ω-3不饱和脂肪酸及抗氧化剂维生素A、C、E,可改善肿瘤患者的免疫状况,提高机体的抗氧化能力。研究表明ω-3脂肪酸具有调控细胞因子的产生与释放,减轻有害的或过度的炎症反应的作用[5-7]。
肠道是消化吸收营养物质的最佳途径,肠内营养是一种简便、安全、有效的营养补给方法,可减少代谢并发症和肠道细菌易位的发生。研究表明只要患者胃肠道功能基本正常并且能耐受,就应选择肠内营养[8]。围术期给予恶性肿瘤患者含有免疫增强作用的肠内营养,有利于改善机体防御机制、控制炎症反应。CRP是反应炎症感染和疗效的良好指标[9]。本研究显示两组患者术前CRP值无差异,术后第2天CRP值达高峰,后逐渐下降,研究显示治疗组术后2、4、6天CRP检测值明显低于对照组;提示早期应用免疫型肠内营养组患者炎症反应消退早,患者恢复快,早期应用免疫型肠内营养能较早解除化疗手术对机体的免疫抑制,降低炎症反应。早期应用免疫型肠内营养使代谢和炎症反应朝着有利于机体康复方向发展[10],促进患者康复。以往许多研究得出肠内营养的感染性并发症低于肠外营养[11],这与肠内营养可保护肠黏膜屏障完整性,防止肠腔内正常菌群移位,引起内源性感染有关。本研究显示,行早期免疫型肠内营养的患者在胃肠功能恢复方面明显早于非肠内营养支持患者。而两组患者术后SIRS第2天发生例数、吻合口瘘及切口感染、血液感染、导管相关感染、肺部感染发生例数两组比较差异无统计学意义,可能与病例数少有关。
本研究观察mFOLFOX-6新辅助化疗方案两组患者恢复顺利,无严重化疗不良反应发生,无死亡病例发生,治疗组患者SIRS发生例数低于对照组,且4、6 d SIRS发生例数比较,两组差异有统计学意义(P<0.05)。术后白细胞恢复情况治疗组明显优于对照组;且第2天白细胞恢复情况两组比较统计学差异有统计学意义,提示早期应用免疫型肠内营养可在术后减轻炎症反应,减少炎症因子的生成,对机体组织起到一定的保护作用;对大手术或创伤后危重患者的临床研究也显示,早期实施肠内营养,有助于改善患者营养状况,降低术后并发症[12]。
因此本研究提示,胃癌新辅助化疗患者早期应用免疫型肠内营养能降低术后SIRS发生率,阻断过度炎症反应,促进肠道功能恢复,加速患者术后康复,值得临床推广应用。但本组研究病例较少,尚待于进一步扩大样本研究。
[1] 徐飚,王建明.胃癌流行病学研究[J].中华肿瘤防治杂志,2006,13(1):81-87.
[2]Galban C,Montejo JC,Mesejo A,et al.An immune-enhancing enteral diet reduces mortality rate and episodes of bacteremia in septic intensive care unit patients[J].Crit Care Med,2000,28(3):643-648.
[3]Kim HJ,Eun JY,Jeon YW,et al.Efficacy and safety of oxaliplatin,5-Fluorouracil,and folinic Acid combination chemotherapy as first-line treatment in metastatic or recurrent gastric cancer [J].Cancer Res Treat,2011,43(3):154-159.
[4]Hochwald SN,Harrison LE,Heslin MJ,et al.Early postoperative enteral feeding improves whole body protein kinetics in uppergastrointestinal cancer patients[J].Am J Surg,1997,174(3):325-330.
[5]Friesecke S,Lotze C,Kohler J,et al.Fish oil supplementation in the parenteral nutrition of critically ill medical patients:a randomised controlled trial[J].Intensive Care Med,2008,34(8):1411-1420.
[6]O'FlahertyL,Bouchier-HayesDJ.Immunonutrition and surgical practice[J].Proc Nutr Soc,1999,58(4):831-837.
[7]Marik PE,Zaloga GP.Immunonutrition in critically ill patients:a systematic review and analysis of the literature [J].Intensive Care Med,2008,34(11):1980-1990.
[8]Agudelo GM,Giraldo NA,Aguilar N,et al.Incidence of nutritional support complications in critical patients: multicenter study[J].Nutr Hosp,2011,26(3):537-545.
[9]Nunes BK,Lacerda RA,Jardim JM.Systematic review and meta-analysis of the predictive value of C-reactive protein in postoperative infections[J].Rev Esc Enferm USP,2011,45(6):1488-1494.
[10]Nguyen NQ,Besanko LK,Burgstad C,et al.Delayed enteral feeding impairs intestinal carbohydrate absorption in critically ill patients[J].Crit Care Med,2012,40(1):50-54.
[11]Arévalo Manso JJ.Enteral feeding set replacement as a key factor in preventing infectious complications[J].Rev Enferm,2011,34(9):16-22.
[12]Woo SH,Finch CK,Broyles JE,et al.Early vs delayed enteral nutrition in critically ill medical patients[J].Nutr Clin Pract,2010,25(2):205-211.

