DNA/单壁碳纳米管/聚多巴胺修饰电极的制备及其分析应用
张 婷,冯莅均,张修华,宋功武
(1.武汉软件工程职业技术学院,湖北 武汉 430205;2.湖北大学化学化工学院,湖北 武汉 430062)
痢特灵(Furazolidone,Fu),学名呋喃唑酮,是一种人工合成的抗菌药物,广泛用于治疗动物的痢疾和肠炎。痢特灵是一种诱变致癌剂[1],因此应严格控制动物性食品中痢特灵的残留量。目前,对痢特灵含量的测定方法主要有分光光度法[2]、HPLC法[3]和极谱法[4]等,大多存在耗时长、灵敏度低、操作繁琐等缺点。由于呋喃唑酮具有电活性,因此可探索适当的电化学测定方法以充分发挥电化学简便、灵敏的优势[5]。
作者在此采用电化学聚合方法制备了聚多巴胺修饰玻碳电极(PDA/GCE),并进一步用单壁碳纳米管和DNA进行修饰,制备得到DNA/单壁碳纳米管/聚多巴胺复合膜修饰电极(DNA/SWNTs/PDA/GCE),详细研究了呋喃唑酮在该修饰电极上的电化学行为及其与DNA的相互作用机理。
1 实验
1.1 试剂与仪器
呋喃唑酮、DNA,Sigma-Aldrich(St.Louis,Missouri)公司;多巴胺(DA),上海晶纯试剂有限公司;单壁碳纳米管(SWNTs),中科院成都有机所;其它试剂均为分析纯;实验室用水为二次蒸馏水。
电化学工作站CHI660C三电极系统:裸GCE或修饰电极为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极(SCE),上海辰华仪器公司;BRANSON2000型超声波清洗仪,美国;320-S型酸度/离子计,瑞士METTLER-TOLEDO公司。
1.2 DNA/SWNTs/PDA/GCE的制备
将处理好的裸玻碳电极置于0.05 mol·L-1DA溶液(PBS,pH=7.0)中,在-0.6~+0.6 V的电位范围内以0.1 V·s-1的扫描速度聚合6圈,即得到PDA/GCE;然后取10 μL 1.0 mg·mL-1SWNTs溶液滴涂于PDA/GCE表面,空气中室温干燥,即制得SWNTs/PDA/GCE;最后将20 μL 1.0 mg·mL-1DNA滴涂于SWNTs/PDA/GCE表面,空气中室温干燥,即制得DNA/SWNTs/PDA/GCE。
1.3 电化学行为研究
电化学实验采用三电极系统,在含有Fu的BR缓冲溶液(pH=7.0)中,在选定的电位范围内记录循环伏安曲线(CV)和差分脉冲伏安曲线(DPV)。DPV测定参数如下:脉冲宽度25 mV,频率30 Hz,脉冲增量4 mV。交流阻抗图谱的测定在5 mmol·L-1[Fe(CN)6]3-/4-溶液中进行,0.1 mol·L-1的KNO3为支持电解质,所施加的交流信号的振幅为5.0 mV,频率范围为50~100 kHz,电化学电池的等效电路由Randles等效电路表示。
2 结果与讨论
2.1 DNA/SWNTs/PDA/GCE的交流阻抗表征
图1为不同电极在5 mmol·L-1[Fe(CN)6]3-/4-溶液中的交流阻抗图谱。

a.GCE b.SWNTs/PDA/GCE c.PDA/GCE d.DNA/SWNTs/PDA/GCE
由图1可以看出:裸GCE的交流阻抗曲线近乎是一条直线(曲线a),表明在此情况下,氧化还原探针[Fe(CN)6]3-/4-极易到达电极的表面发生电化学反应,电极上几乎没有阻碍电子传递的物质存在。当裸GCE上修饰了SWNTs/PDA膜(曲线b)或PDA膜(曲线c)后,阻抗图谱中的高频部分出现了一个小半圆,表明探针[Fe(CN)6]3-/4-的电子传递受阻,说明SWNTs/PDA或PDA膜已经被修饰到电极表面;而SWNTs/PDA膜的阻抗比PDA膜小,表明SWNTs的存在能促进电极与基体溶液中电活性物质的电子传递,使得SWNTs/PDA复合膜有较好的电子传递能力。当DNA固定到SWNTs/PDA/GCE上(曲线d),半圆的直径进一步增大,这是因为DNA生物大分子的结构阻碍了界面电子传递;同时,也证明了DNA被成功地固定到了电极表面。
2.2 呋喃唑酮在DNA/SWNTs/PDA/GCE上的电化学行为
图2为1.0×10-4mol· L-1呋喃唑酮在0.1 mol·L-1pH=7.0的BR缓冲溶液中于不同电极上的循环伏安曲线。
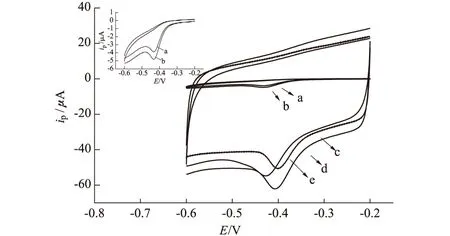
a.GCE b.PDA/GCE c.SWNTs/GCE d.SWNTs/PDA/GCE e.DNA/SWNTs/PDA/GCE
由图2可知,呋喃唑酮在裸GCE上(曲线a)于-0.43 V出现一个还原峰;在PDA/GCE(曲线b)上,呋喃唑酮的还原峰电流较裸GCE有所增大;在SWNTs/GCE(曲线c)上,呋喃唑酮的还原峰电流明显增大,这是由于SWNTs的存在有效地增大了电极的表面积;在SWNTs/PDA/GCE(曲线d)上,呋喃唑酮有良好的电化学响应,峰电流较裸GCE增大了约10倍,表明SWNTs和PDA对呋喃唑酮的电化学还原具有协同电催化作用。此外,在SWNTs/PDA/GCE上,呋喃唑酮的响应信号比PDA/GCE上的更强,表明SWNTs可以加速呋喃唑酮与电极表面之间的电子传递;同时,碳纳米管增大了电极的有效表面积,从而也显著增大了还原峰电流。在DNA/SWNTs/PDA/GCE(曲线e)上,相同浓度的呋喃唑酮还原峰电流减小,峰电位负移,由此说明DNA与呋喃唑酮通过静电结合形成非导电复合物[6,7],从而阻碍了界面电子传递。
2.3 呋喃唑酮与DNA的相互作用
在BR缓冲溶液(pH=7.0)中加入不同浓度DNA后,1.0×10-4mol·L-1呋喃唑酮在SWNTs/PDA/GCE上的循环伏安曲线见图3。

图3 加入不同浓度DNA后,呋喃唑酮在SWNTs/PDA/GCE上的循环伏安曲线
由图3可知,在底液中加入12.5 mg·mL-1DNA后,呋喃唑酮的还原峰电流明显降低,峰电位负移;而底液中DNA的浓度增加到25.0 mg·mL-1时,呋喃唑酮的还原峰电流进一步降低,峰电位进一步负移。这表明溶液中DNA与呋喃唑酮是通过静电相结合[8]。
据报道[9],结合常数(βs)与结合位点数(m)的关系为log[ΔI/(ΔImax-ΔI)]=logβs+mlog[Fu],因此可以根据呋喃唑酮峰电流的变化计算出呋喃唑酮与DNA的结合常数和结合位点数。
实验表明log[ΔI/(ΔImax-ΔI)]与log[Fu]为线性关系(图4),其线性方程为log[ΔI/(ΔImax-ΔI)]=5.09+0.95 log[Fu],R=0.995。根据直线的截距和斜率得到m=1、logβs=5.09,说明Fu与DNA相互作用的结合位点数为1,结合常数为1.23×105。
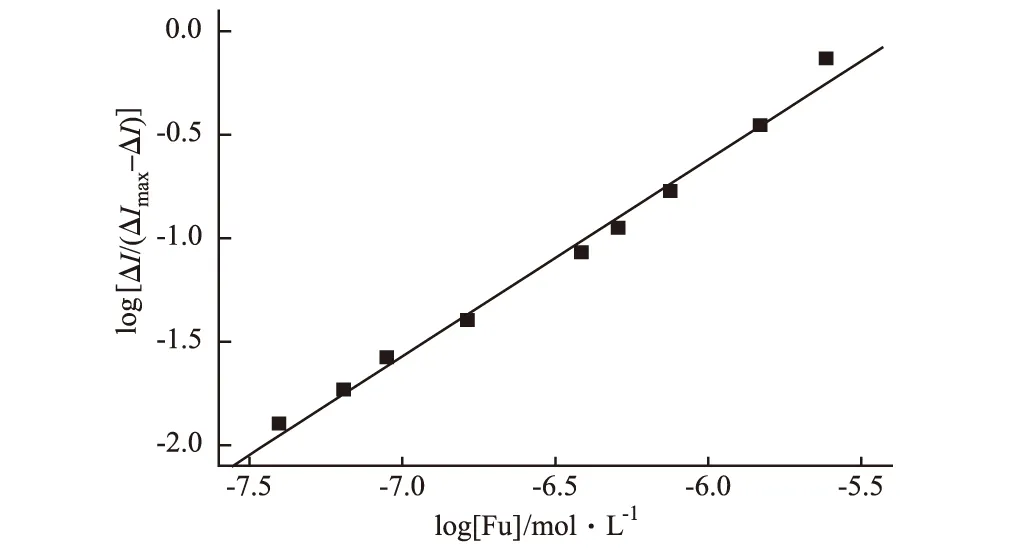
图4 log[ΔI/(ΔImax-ΔI)]与log[Fu]的关系曲线
2.4 定量测定
2.4.1 线性范围和检测限
在所选最佳实验条件下,测定不同浓度呋喃唑酮的差分脉冲伏安曲线(DPV),结果见图5。其中小图为呋喃唑酮的标准曲线。

a~k,×10-6 mol·L-1:0.04,0.065,0.09,0.17,0.39,0.51,0.76,1.5,2.5,3.6,4.8
由图5可知,呋喃唑酮的还原峰电流随着浓度的增加而增大,并在4.0×10-8~4.8×10-6mol·L-1浓度范围内呈良好的线性关系,线性回归方程为:ipc=3.11×10-7+1.85[Fu],R=0.997(n=11),检测限为1.33×10-8mol·L-1(S/N=3)。
2.4.2 电极的重现性和稳定性
采用DPV法研究了DNA/SWNTs/PDA/GCE复合膜修饰电极的重现性和稳定性。在1.0×10-6mol·L-1的呋喃唑酮溶液中(BR,pH=7.0),用同一支修饰电极连续测定5次,还原峰电流的相对标准偏差为3.08%;采用5支不同的修饰电极在相同实验条件下进行测定,还原峰电流的相对标准偏差为4.74%,表明该修饰电极对呋喃唑酮的定量测定有很好的重现性。将修饰电极置于冰箱中保存,40 d后测定上述溶液的电流响应,响应峰电流为原电流的91.72%。这表明该DNA/SWNTs/PDA/GCE复合膜修饰电极具有良好的重现性和稳定性。
2.4.3 干扰实验
3 结论
制备了DNA/SWNTs/PDA/GCE复合膜修饰电极。结果发现:SWNTs的引入确实可以提高复合膜的界面电子传递效率;DNA/SWNTs/PDA/GCE复合膜修饰电极对呋喃唑酮氧化还原具有明显的电催化作用;呋喃唑酮与DNA通过静电结合形成非导电复合物,该复合物阻碍了电极界面电子传输,其结合常数、结合位点数分别为1.23×105和1。在最佳的实验条件下,呋喃唑酮还原峰电流与其浓度在4.0×10-8~4.8×10-6mol·L-1范围内呈良好的线性关系,检测限达到1.33×10-8mol·L-1。
参考文献:
[1] 赵敏,胡劲波,来永春,等.离子注入Ni-C修饰电极伏安法测定痢特灵[J].北京师范大学学报(自然科学版),1997,33(4):517-520.
[2] Sachan A,Trivedi P.Estimation of atenolol and nifedipine in multicomponent formulations by ultraviolet spectroscopy[J].Asion J Chem,1999,11(3):970-974.
[3] 刁石强,吴燕燕,李来好,等.高效液相色谱法测定水产养殖底泥中呋喃唑酮残留量的研究[J].南方水产,2010,6(2):53-58.
[4] 王福民.硝基呋喃类药物呋喃唑酮的新极谱法测定[J].分析测试学报,2003,22(4):48-50.
[5] Fotouhi L,Banafsheh S,Heravi M M.Electrochemistry of the interaction of furazolidone and bovine serum albumin[J].Bioelechem,2009,77(1):26-30.
[6] Carter M T,Rodriguez M,Bard A J.Voltammetric studies of the interaction of metal chelates with DNA.2.Tris-chelated complexes of cobalt(Ⅲ) and iron(Ⅱ) with 1,10-phenanthroline and 2,2′-bipyridine[J].J Am Chem Soc,1989,111(24):8901-8911.
[7] Tian X,Song Y H,Dong H M,et al.Interaction of anticancer herbal drug berberine with DNA immobilized on the glassy carbon electrode[J].Bioelechem,2008,73(1):18-22.
[8] Li Y L,Liu M L,Xiang C H,et al.Electrochemical quartz crystal microbalance study on growth and property of the polymer deposit at gold electrodes during oxidation of dopamine in aqueous solutions[J].Thin Solid Films,2006,497(1-2):270-278.
[9] Ibrahim M S.Voltammetric studies of the interaction of nogalamycin antitumor drug with DNA[J].Anal Chim Acta,2001,443(1):63-72.

