紫藤瘤提取物抗病原真菌活性研究
吴培云, 刘劲松, 陈爱民, 钟文武, 王 刚
(安徽中医学院药学院,现代中药安徽省重点实验室,安徽合肥230031)
紫藤Wisteria sinensis(Sims)Sweet是一种常见的园林绿化植物,属豆科紫藤属,是一种落叶攀援缠绕性的大藤本植物。罗充等[1]研究发现紫藤等园林植物有杀菌作用,紫藤叶片丙酮提取液对真菌和细菌的生长均有一定的抑制作用[2]。紫藤瘤是紫藤老藤茎上所生的赘瘤,具体形成机理尚不明确。紫藤瘤可入药,有杀虫、止痛、解毒等功效[3],中医临床上可用于癌症的治疗[4-5]。植物在生命过程中受到病原真菌、细菌、昆虫和动物的咬食等多重胁迫,诱导次生代谢产物的发生和积累[6-8]。紫藤瘤的产生机理虽不清楚,但我们推测这样的一个赘瘤组织对紫藤自身的化学防御应该有一定的积极生理意义。基于这样的思路,我们选择病原真菌、细菌对紫藤瘤提取物进行抑菌活性研究,以期揭示紫藤瘤这种特殊药材的形成机理,为该药材的品质保证及质量控制提供一些思路。
1 材料
1.1 紫藤瘤 紫藤瘤药材由安徽中医学院中药教研室方成武教授提供,并鉴定为豆科植物紫藤Wisteria sinensis(Sims)Sweet的藤瘤。
1.2 作物病原真菌 小麦赤霉病菌Gibberella zeae、棉花枯萎病菌Fusa-rium oxysporum f.sp.vasinfectum、辣椒枯萎病菌Fusarium oxysporum f.sp.capsicum、玉米穗腐病菌Fusarium monilifome、油菜菌核病菌Sclerotiorum sclerotiorum由河南农业大学农学院中药材系实验室提供。
1.3 细菌 大肠杆菌Escherichia coli、金黄色葡萄球菌Staphyloccocus aureus、枯草芽孢杆菌 Bacillus subtilis、巨大芽孢杆菌Bacillus megaterium、苏云金杆菌Bacillus thuringiensis、荧光假单胞杆菌Pseudomonas fluorescens由河南农业大学农学院中药材系实验室提供。
1.4 PDA固体培养基 马铃薯 (去皮)200 g,葡萄糖20 g,琼脂20 g,水1000 mL。马铃薯煮30 min,4层纱布过滤,取汁,加入葡萄糖和琼脂,煮至琼脂完全融化,补水至1000 mL。常规分装,121℃高压灭菌30 min。
1.5 牛肉膏蛋白胨培养基 30 g牛肉膏,5 g蛋白胨,15 g琼脂,5g氯化钠,蒸馏水1000 mL,用1 mol/L NaOH将其pH调至7.0~7.2。常规分装,121℃高压灭菌30 min。
1.6 试剂 二甲基亚砜、葡萄糖、琼脂、蛋白胨、牛肉膏、氯化钠、氢氧化钠,均为国产分析纯。
2 方法
2.1 紫藤瘤样品提取 取粉碎后的紫藤瘤粉末100 g,用10倍 (体积/质量)的乙醇于1000 mL三角瓶内室温浸提24 h,期间不时搅拌,共浸提两次,合并浸提液,过滤,45℃下减压浓缩,得到紫藤瘤乙醇提取物约12 g。
2.2 药液的制备 取适量紫藤瘤乙醇提取物放入量瓶,加入微量二甲基亚砜,振荡混匀,无菌水定容,配制成质量浓度为5 mg/mL、2.5 mg/mL溶液。
2.3 体外抗作物病原真菌活性试验
2.3.1 抑菌试验方法 菌落生长速率法[9]:取1 mL供试药液,与9 mL的PDA培养基于无菌试管中混匀,倒入无菌培养皿中制成带药的培养基平板,无菌水作空白对照。用无菌打孔器在活化后的作物病原真菌菌落边缘切下直径6 mm生长一致的菌饼。将打好的菌饼菌丝面向下,接于培养基平板中心,使菌丝与新鲜培养基充分接触,防止感染其它杂菌,封口膜封口,然后于26℃恒温培养箱培养3~5 d。每个试验重复3次。
2.3.2 抑菌结果测量 采用十字交叉法,待空白对照菌落长至平板边缘时,测量各培养皿中的菌落生长直径,以3次重复菌落直径的平均值计算菌丝生长抑制率。菌丝生长抑制率 (I)=[空白对照菌落生长直径 (C)-处理菌落生长直径 (T)] /[空白对照菌落生长直径 (C) -6] ×100%,即:

其中,6是菌饼直径,单位为mm。
2.4 体外抗细菌活性试验
2.4.1 菌悬液的制备 用接种环挑取活化后生长良好的细菌,放入10 mL无菌水中,振荡混匀,用血球计数法确定菌悬液浓度,稀释至106~108cfu。
2.4.2 抑菌试验方法 采用滤纸片法[10],用直径6 mm的打孔器打好滤纸片后121℃灭菌30 min,烘干后浸泡在供试药液中30 min。用镊子取出滤纸片,稍晾干后备用。牛肉膏蛋白胨培养基倒入无菌平皿中,每皿约15 mL,凝固后,加入0.1 mL制备好的菌悬液,用涂布棒涂布均匀,然后贴制备好的含药滤纸片,滤纸片距平皿边缘1.5 cm以上,各滤纸片之间距2.5 cm以上。置于36℃恒温培养20~24 h。每个试验重复3次。
2.4.3 抑菌结果测量 采用十字交叉法[11],测量培养皿中各滤纸片的抑菌圈直径,以3次重复的平均值为抑菌圈直径,单位为mm。抑菌圈直径在小于6 mm为无抑菌,6~8 mm为微弱抑菌,8~13 mm为弱抑菌,13~18 mm为中等抑菌,大于18 mm则为强抑菌。
3 结果与讨论
3.1 体外抗作物病原真菌活性结果 紫藤瘤乙醇提取物无论是5 mg/mL还是2.5 mg/mL都对油菜菌核病菌Sclerotiorum sclerotiorum、小麦赤霉病菌Gibberella zeae、棉花枯萎病菌Fusarium oxysporum f.sp.vasinfectum、辣椒枯萎病菌Fusarium oxysporum f.sp.capsicum、玉米穗腐病菌 Fusarium monilifome 5种作物病原真菌均有较好的抑菌效果,尤其对前3种病原真菌的抑制作用显著,见图1。
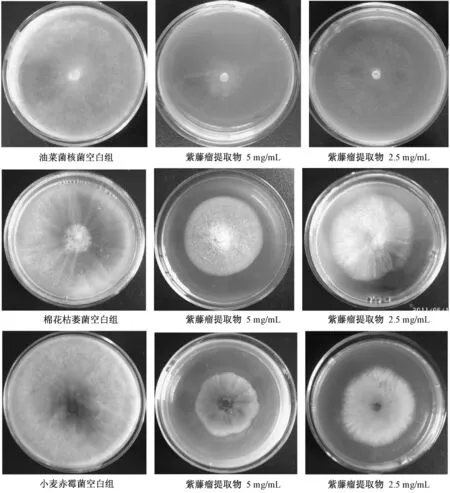
图1 紫藤瘤乙醇提取物对病原真菌体外抑制效果
紫藤瘤乙醇提取物抑制作物病原真菌具有一定的选择性,质量浓度为5 mg/mL对油菜菌核病菌的抑制最强,高达63.9%,对辣椒枯萎病菌的抑制最弱,抑菌率为27.1%。另外,紫藤瘤乙醇提取物抑菌试验中的3次重复数据离散度好,在抑菌率平均值的上下8%以内,反映了本试验方法学的稳定性。紫藤瘤乙醇提取物对5种作物病原真菌抑制率的高低顺序为:油菜菌核病菌﹥棉花枯萎病菌﹥小麦赤霉病菌﹥玉米穗腐病菌﹥辣椒枯萎病菌。油菜菌核病菌对紫藤瘤乙醇提取物不同质量浓度敏感性大,2.5 mg/mL紫藤瘤乙醇提取物对其抑菌率仅为32.1%,和5 mg/mL的抑菌率相差31.8%。而其他4种病原真菌对紫藤瘤乙醇提取物的不同质量浓度敏感性差,2.5 mg/mL的抑菌率和5 mg/mL的抑菌率相差5%以内。见表1。在本次实验中没有采用抗真菌阳性药物作对照是因为紫藤瘤的提取物成分复杂,而对照药是单一化合物,它们之间的活性不能进行量化比较,只有分离得到单体化合物之后才方便进行活性的大小比较。另外,本次实验的主要目的是基于紫藤化学生态防御的观点初步研究紫藤瘤是否有抗病原真菌的活性,为今后深入的研究提供一些思路。
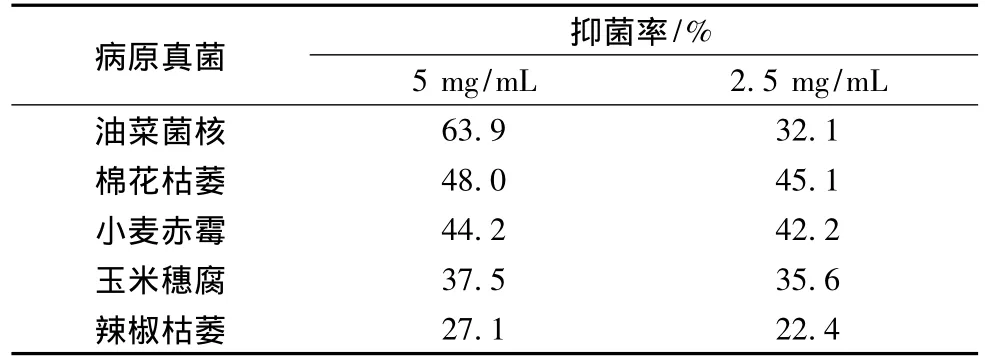
表1 紫藤瘤乙醇提取物对作物病原真菌体外抑制率
3.2 体外抗细菌活性结果 紫藤瘤乙醇提取物在5 mg/mL和2.5 mg/mL质量浓度下对大肠杆菌Escherichia coli、金黄色葡萄球菌 Staphyloccocus aureus、枯草芽孢杆菌 Bacillus subtilis、巨大芽孢杆菌Bacillus megaterium、苏云金杆菌Bacillus thuringiensis、荧光假单胞杆菌Pseudomonas fluorescens都无明显抑菌效果。
4 结论
本研究中紫藤瘤乙醇提取物对5种作物病原真菌有较好的抑菌效果,在5 mg/mL时对油菜菌核病菌、棉花枯萎病菌、小麦赤霉病菌的抑菌率高达50%左右,有继续深入研究的价值。紫藤瘤乙醇提取物5 mg/mL和2.5 mg/mL质量浓度下对棉花枯萎病菌、小麦赤霉病菌、玉米穗腐病菌、辣椒枯萎病菌4种作物病原真菌的抑菌率相差在5%以内,可见紫藤瘤乙醇提取物的抗真菌效果稳定。紫藤瘤乙醇提取物中的抑菌活性成分的分离、鉴定以及量效关系研究等还有待进一步的深入探讨。另外,有人认为紫藤瘤的产生可能是细菌寄生紫藤茎所致的植物病瘤[12-13],但本次实验中并未见紫藤瘤提取物有明显的抑制细菌的作用。
[1]罗 充,理艳霞,张 伟,等.19种园林植物组织杀菌作用的研究[J].安徽农业科学,2005,33(5):810-811.
[2]姜艳华,樊晓晖,姜 华.紫藤活性成分的提取与抑菌作用初探[J].河南农业科学,2009(3):60-68.
[3]冯洪钱,冯新英,王 成.日本《假名安驥集》疑难土草药考注[J].农业考古,2008(4):281-282.
[4]林博夫,杨世忠.中药W、T、T、C治疗胃癌获显效[J].广西中医药,1983(4):48.
[5]赵耀先.对《中药W、T、T、C治疗胃癌获显效》译文的几点意见[J].广西中医药,1984(2):53.
[6]袁秀云,谢慧玲.植物次生物质在植物防御中的作用[J].焦作大学学报,2004,18(4):52-54.
[7]张 瑛,严福顺.虫害诱导的植物挥发性次生物质及其在植物防御中的作用[J].昆虫学报,1998,41(2):204-214.
[8]Dixon R A.Natural products and plant disease resistance[J].Nature,2001,411:843-847.
[9]江茂生,许文耀.艾蒿提取物对13种植物病原菌物的抑制作用[J].福建农林大学学报:自然科学版,2007,36(4):352-356.
[10]朱宏科.大型真菌的抗细菌和抗真菌活性研究[D].杭州:浙江大学,2006.
[11]Ma B J,Wu T T,Ruan Y,et al.Antibacterial and antifungal activitiy of scabronine G and H in vitro[J].Mycology,2010,1(3):200-203.
[12]Liu J,Wang E T,Ren da W et al.Mixture of endophytic agrobacterium and sinorhizobium meliloti strains could induce nonspecific nodulation on some woody legumes[J].Arch Microbiol,2010,192(3):229-234.
[13]Liu J,Wang E T,Chen W X,et al.Diverse rhizobia associated with woody legumes Wisteria sinensis,Cercis racemosa and Amorpha fruticosa grown in the temperate zone of China[J].Syst Appl Microbiol,2005,28(5):465-477.

