食管鳞癌组织中CDC2、CLDN5蛋白表达及其临床病理意义的研究
马 莉 李红伟 柴大敏 冯振中 甘怀勇 陶仪声*
(1蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室;2蚌埠医学院第一附属医院放疗科 安徽 233003)
食管癌是由食管黏膜上皮或腺上皮发生的恶性肿瘤,在十大恶性肿瘤中居第四位,在我国主要是以鳞癌为主。临床进展迅速且转移率高,易复发,预后差。食管癌的发生是一个多基因变异累积的复杂过程,因此从分子水平研究食管癌的发生机制对食管癌的诊断和治疗都有重大的意义。细胞分裂周期2(CDC2)基因涉及细胞周期调控中一个较为重要的基因,该基因主要在G2-M期起重要作用。CLDN5是claudin家族的一个重要成员,是构成细胞间紧密连接的主要骨架蛋白。本研究通过检查食管鳞癌中CDC2和CLDN5的蛋白因表达情况,探讨它们与食管癌发生、发展的作用以及两者之间的关系。
材料和方法
1.一般材料
收集2007-2008年本教研室食管鳞状细胞癌存档标本(石蜡包埋)90例,其中男性69例,女性21例;年龄38-79岁,中位年龄59岁。其中高分化鳞癌24例,中分化45例,低分化21例;浸润至浅层(粘膜内至浅肌层)20例,深层(深肌层至外膜层)70例;局部和远处有淋巴结转移者38例,无转移者52例;同时重度不典型增生16例,并挑选癌灶边缘5.0cm以上远端切缘组织28例做正常对照。
2.主要试剂
CLDN5一抗(兔抗人)购自NeoMarkers公司。CDC2一抗(兔抗人)购自Santa crus公司。
3.实验方法
用免疫组化Elivision方法对90例食管癌组织,28例癌旁正常组织及16例重度不典型增生组织做CDC2、CLDN5染色。抗体滴度分别均为1∶100,具体操作参见试剂说明书,用PBS代替一抗做阴性对照,用乳腺癌和皮肤组织分别做阳性对照。
4.结果判定及统计学分析
CDC2的阳性着色定位于细胞浆或细胞核,CLDN5的阳性着色定位于细胞浆。每张切片随机观察10个高倍视野,每个视野计数200个细胞,统计阳性细胞数及观察显色度,阳性强度用半定量法,按阳性细胞所占得百分数评分:阳性细胞<10%为0分,10%-50%为1分,51%-75%为2分,>75%为3分。细胞不着色为0分,浅黄为1分,黄色为2分,棕褐色为3分。两者分数相乘0-2分为阴性(-),≥3分为阳性(+)。结果观察采用双盲法。
5.统计学处理
应用spass 17.0软件进行统计学分析,采用卡方检验和spearman等级相关检验,P<0.05有统计学意义。
结 果
1.CDC2蛋白和CLDN5蛋白在食管鳞癌、重度不典型增生及食管癌旁组织中的表达
CDC2在食管癌细胞中定位于细胞质和细胞核,CLDN5在食管癌中定位于细胞质。CDC2蛋白和CLDN5蛋白在90例食管鳞癌中的阳性表达率分别为88.89%(80/90)、85.56%(77/90)在16例重度不典型增生中CDC2蛋白和CLDN5蛋白的阳性表达率均为68.75%(11/16)。28例正常食管黏膜上皮细胞CDC2蛋白和CLDN5蛋白的阳性表达率分别为48.86%(12/28)、25.00%(7/28)。CDC2和CLDN5蛋白在食管鳞癌中的表达均高于正常黏膜组织(P<0.05),其中CDC2蛋白在食管鳞癌中的表达强于不典型增生组织(P<0.05)。CLDN5蛋白表达在不典型增生及正常黏膜上皮组织间表达有显著差异性(P<0.05)(表1、图A-D)。
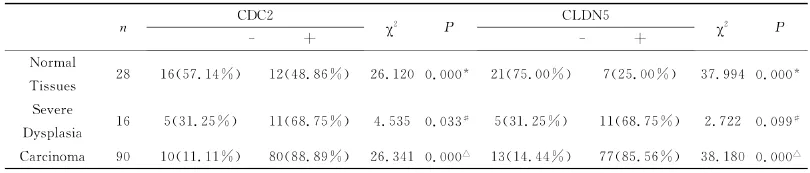
表1 CDC2和CLDN5蛋白在正常组织-食管癌中的表达Table1 Expression of CDC2and CLDN5protein from normal tissue to ESCC
2.食管鳞癌中CDC2和CLDN5蛋白表达及临床病理因素之间的关系
在90例食管鳞癌中,CDC2蛋白在高分化鳞癌21例中有21例阳性表达,在中分化鳞癌45例中有41例阳性表达,在低分化21例中有15例阳性表达;临床分期Ⅰ期组29例中有22例阳性表达,Ⅱ期组40例中有37例阳性表达,Ⅲ+Ⅳ期组21例中有21例阳性表达。CDC2蛋白的阳性表达与患者年龄、性别、浸润深度及淋巴结转移无关,但与分化程度及临床分期有关(P<0.05)。在90例食管鳞癌中,CLDN5蛋白的表达程度与年龄、性别、浸润深度、分化程度、临床分期及有无淋巴结转移均无关(P>0.05)(表2)。
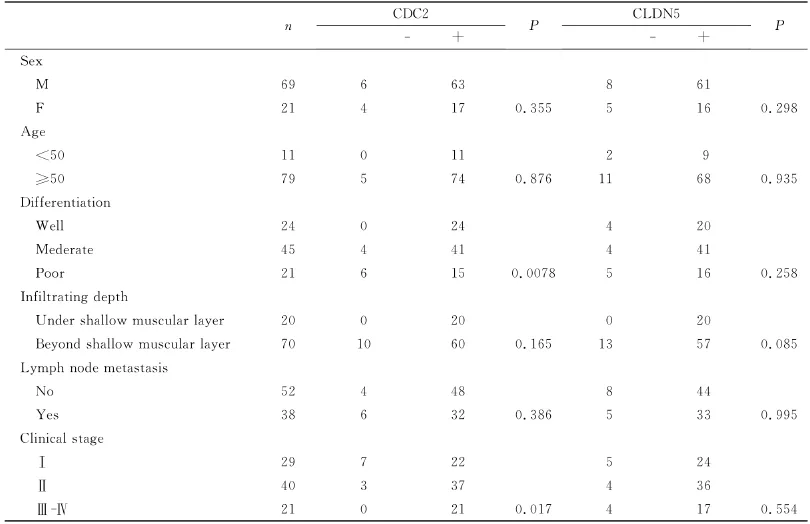
表2 食管癌中CDC2和CLDN5蛋白的表达水平与临床病理参数之间的关系Table2 The relationship of CDC2and CLDN5expression and clinicopathological manifestations in ESCC
3.CDC2和CLDN5在食管鳞癌中表达的相关性
在90例食管鳞癌组织中,CDC2与CLDN5蛋白均阳性表达的74例,均阴性表达的7例,前者阳性而后者阴性表达的3例,前者阴性而后者阳性表达的6例。CDC2与CLDN5蛋白在食管鳞癌中得表达呈正相关(r=0.537,P<0.05)(表3)。
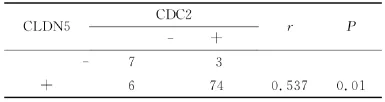
表3 CDC2和CLDN5在食管癌中表达的相互关系Table3 Correlation of CDC2and CLDN5in ESCC
讨 论
细胞周期是指细胞从上一次有丝分裂结束到下一次有丝分裂完成所经历的整个连续过程。一个完整的细胞周期通常可以划分为4个连续的阶段:G1期、S期、G2期和M期,细胞周期调控是各种细胞周期调控因子在细胞周期检验点的监控下规律而有序地启动和完成细胞分裂的整个过程。食管癌的发生、发展过程中存在着细胞周期调控机制的异常,最终导致肿瘤细胞持续性的增殖。CDC2基因是细胞周期调控过程中一个较为重要的基因,该基因在G2→M期调控中起主要作用。CDC2基因编码分子量为34kD的丝氨酸/苏氨酸蛋白激酶即P34cdc2激酶[1]。该激酶在G2后期,与周期素B结合,构成有丝分裂促进子(MAP)的主要成份,在磷酸酶和激酶的作用下激活,促进细胞进入M期[2]。如果p34cdc2的活性被抑制,细胞将停留在G2/M期。p34cdc2的活化是细胞分裂以及增殖的信号,它具有启动DNA复制和诱发有丝分裂的双重作用[1]。CDC2过度表达见于结肠癌、胃癌、乳腺癌等多种恶性肿瘤组织中、且与分期分级和预后有关[3-5]。Nozoe等[6]用免疫组化研究了91例食管鳞状细胞癌中CDC2的表达情况,发现41例主要在细胞质中高表达,50例主要在细胞核中高表达,并且细胞质中高表达CDC2的食管鳞癌的角质化比例显著高于胞核中高表达者。因为角质化与食管鳞癌的分化程度相关,因此提示CDC2的表达强度与食管鳞癌的分化程度有关。CDC2高表达同时也说明细胞将进入分裂期或刚刚完成分裂,如果细胞不表达CDC2,该细胞则不能进行分裂,因此CDC2的表达率反应细胞分裂、增殖的能力。本实验结果发现食管癌组织中CDC2表达明显高于重度不典型增生和正常食管上皮组织,三者之间有显著差异性,提示CDC2蛋白在食管鳞癌发生、发展中起重要作用,可作为食管癌早期诊断及判断增殖活性的又一特异性指标。同时还发现CDC2蛋白在食管癌的表达强度与分化及临床分期有关(P<0.05)。可能会成为临床分期的参考指标,辅助临床判断食管癌预后。
1998年Furuse等[7]首先从鸡肝中找到了claudin蛋白家族的两个成员后,到目前为止,已发现claudin基因家族的24个成员[8],分析其序列,发现其同源性为12.5%-69.7%,表明它们的功能具有高度保守性。Claudin是一组分子量从17-27kDa的跨膜紧密连接蛋白,它们是构成紧密连接的主要骨架蛋白,与Occludin、连接黏附分子3类主要的膜蛋白构成了细胞间的紧密连接。紧密连接维持细胞极性,形成屏障阻止膜蛋白、液体及小分子的侧向扩散,维持了细胞顶部和基底部的完整性。研究还证实紧密连接还具有调节细胞增殖分化的功能。在不同的组织中表达不同的Claudin蛋白,并且同一种组织也可表达多种Claudin蛋白。Claudin蛋白可能决定某一种组织紧密连接的选择性和强度。1个细胞的Claudin蛋白形成多聚体并与邻近细胞的Claudin蛋白相互作用从而构成了细胞间的连接骨架。分化成熟的细胞组成是高度有序的,癌组织基因序列发生突变,表现为分化差,细胞极性紊乱或消失,细胞间紧密连接功能异常。紧密连接完整性的破坏是导致肿瘤细胞生长所需的各种因子扩散的原因之一。Ohtsuki等[9]发现小鼠脑组织中毛细血管内皮细胞上claudin-5mRNA大量表达,其表达水平是claudin-1,-3及-12mRNA 表达水平的593倍以上,结果提示CLDN5参与血脑屏障中紧密连接的形成。后来发现CLDN5仅在正常血管内皮细胞、血管肉瘤及良性脉管肿瘤中高表达,并可作为脉管源性肿瘤特异性分子标记物[10],还可作为抗血管生成药物治疗的新靶点。CLDN5的表达主要在脉管源性肿瘤中报道多见,而在食管癌中罕见报道。本研究的实验结果发现,在正常食管上皮中CLDN5蛋白的表达较弱,在食管上皮不典型增生及癌组织中表达增强,说明claudin-5蛋白的显著表达和食管癌的发生、发展有关,可能会成为食管癌早期诊断的重要标记。但CLDN5蛋白表达程度与年龄、性别、浸润深度、分化程度、临床分期及有无淋巴结转移均无显著差异性。实验还发现CDC2的蛋白表达与CLDN5呈现明显的正相关,随着细胞增殖能力的增强,其CLDN5蛋白的表达量增强,两者同时检测有利于食管癌的早期检出率。具体的作用机制还有待于我们进一步的研究。
[1]Gao CY,BassnettS,ZelenkaPS,et al.CyclinB,p34cdc2,and H1kinaseactivity in terminally differentiating lens fiber cells.Dev Biol,1995,169(1):185-194
[2]Xu N,Chang DC.Different thresholds of MPF inactivation are responsible for controlling differentmitotic events inmammalian cell division.Cell Cycle,2007,6(13):1639-1645
[3]Meyer A,Merkel S,Brückl W,et al.cdc2as prognostic marker in stage UICC-II colon carcinomas.Eur J Cancer,2009,45(8):1466-73
[4]Kim DH.Prognostic implications of cyclin B1,p34cdc2,p27(Kip1)and p53expression in gastric cancer.Yonsei Med,2007,48(4):694-700
[5]Chae SW,Sohn JH,Kim DH,et al.Overexpressions of Cyclin-B1,cdc2,p16and p53in human breast cancer:the clinicopathologic correlations and prognostic implications.Yonsei Med J,2011,52(3):445-53
[6]Nozo E T,Takahash I,Baba H,et al.Relationship between int-racellular localization of p34cdc2protein and differentiation of esophageal squamous cell carcinoma.Cancer Res Clin-Oncol,2005,131(3):179-183
[7]Furuse M,Fujita K,H iiragi T,et al.Claudin21and 22:Novelintegral membrane p roteins localizing at tight junctions with nosequence sim ilarity to occluding.J Cell Biol,1998,141(7):1539-1550
[8]Tsukita S,Furuse M,Itoh M.Multifunctional strands in tight junctions.Nat Rev Mol Cell Biol,2001,2(4):285-293
[9]Ohtsuki S,Yamaguchi H,Katsukura Y,et a1.mRNA exp ression levels of tight junction p rotein genes in mouse brain capillary endothelial cells highly purified by magnetic cell sorting.J Neurochem,2008,104(1):147-154
[10]Soini Y.Expression of claudins 1,2,3,4,5and 7in various types of tumours.Histopathology,2005,46(5):551-560

