一株水貂阿留申病毒的分离鉴定及VP2基因序列分析1)
桑 宇 张段玲 钱毓斌 张彦龙
(东北林业大学,哈尔滨,150040)
水貂阿留申病(Aleutian Ddisease,AD)是由阿留申病毒(Aleutian disease parvovirus,ADV)引起的水貂慢性传染性疾病,主要侵害水貂的免疫系统,以浆细胞弥漫性增生和持续性病毒血症为特征[1-2]。AD在有水貂饲养的国家普遍存在,临床上主要表现为水貂产仔量降低、死胎、流产、肾小球肾炎、动脉血管炎和肝炎,并导致成年水貂的免疫系统紊乱,仔貂突发严重肺炎而死亡[3]。病理剖检常见肾肿大、充血而呈红色,后变灰褐色或淡黄褐色,有的表面可见斑点状出血,间有灰白色坏死灶[4]。水貂AD发病率约75%,直接死亡率可达30%[5]。病貂毛皮质量下降,对水貂养殖业造成巨大的经济损失[6-7]。
对流免疫电泳(CIEP)是现今世界公认的并且应用最为广泛的AD检测方法,通过CIEP检测淘汰AD阳性貂对貂群进行净化,是目前AD防控唯一有效的方法。虽然我国已经研制出AD的CIEP诊断抗原,但由于我国水貂养殖方式和对AD危害认识不足等原因,AD检测净化一直没有得到广泛的推广。近年,国际毛皮市场的旺盛需求带动了我国水貂养殖规模的逐年扩大,但由于管理上的不完善等原因导致我国水貂ADV感染率居高不下,初步统计ADV的感染率高达80%~90%。AD对我国水貂养殖业健康发展的影响越来越严重,加强检测净化工作已经逐渐被广大养殖场(户)所认识和接受。为了深入了解近年来我国ADV的流行情况,并利用当前的流行毒株研制新的诊断抗原,笔者从送检水貂样本中分离出一株ADV(命名为ADV-ZYL1),对其VP2序列进行测定,基于氨基酸的同源性绘制分析表,阐明ADV-ZYL1毒株的抗原变异情况,为进一步开展该病的诊断和防治研究奠定基础。
1 试验材料
病料 山东威海养殖户送检的疑似ADV感染致死的水貂样本,采集其实质器官,置于-20℃保存。
试剂和细胞 蛋白酶K、PMD18-T载体购自宝生物工程(大连)有限公司;胰蛋白酶、DMEM购自Invitrogen公司;Taq DNA聚合酶、dNTP、DL2000 DNA Marker、感受态大肠杆菌DH5α、小量胶回收试剂盒均购自北京全式金生物技术有限公司;小牛血清购自内蒙古金源康生物工程有限公司;猫肾传代细胞系(CRFK)购自中国科学院上海生命科学研究院细胞库;ADV阳性核酸为东北林业大学野生动物资源学院动物医学实验室保存。
引物 检测用的特异性引物参考Qie等[8]的研究报告。上游P1:5'-CTTGTCACGCTACTAGAATGGT-3'(2 587 ~2 609 bp);下游 P2:5'-AGCTTAAGGTTAGTTTACATGGTTTACT-3'(3 252 ~3 279 bp)。可扩增的目的DNA片段的长度为693 bp。参考GenBank中保存的标准毒株ADV-G(M20036)核苷酸序列,利用引物设计软件Oligo 6.0分别设计合成两对引物,用于扩增 VP2全序列。上游AD1:5'-TATTCAGCAAGCAAAAAAGAAG-3'(2 336~2 355 bp);下游 DV1:5'-TTGGTTGGTATGAGTTAAGTAG-3'(3 921~3 942 bp)。扩增的目的片段命名为part.1,长度为1 606 bp。上游 AD2:5'-TATTCAGCAAGCAAAAAAGAAG-3'(3 810~3 831 bp);下游 DV2:5'-TATTCAGCAAGCAAAAAAGAAG-3'(4 452 ~4 474 bp)。扩增的目的片段命名为part.2,长度为664 bp。以上引物均由上海生工生物工程有限公司合成。
2 试验方法
2.1 DNA的提取及PCR检测
取水貂部分脏器,用剪刀尽量剪碎,加入600 μL 的1×TNE(消化缓冲液),40 μL 蛋白酶 K,80 μL 10%SDS,55℃消化过夜。向各试管加入720 μL的平衡酚(V(酚)∶V(氯仿)=1∶1的混合溶液),震荡摇匀成乳浊液,放置0.5 h,4℃条件下12 000 r/min离心15 min。取700 μL上清液加入等体积的异丙醇,摇匀静置30 min,4℃条件下12 000 r/min离心15min,弃上清。沉淀用75%预冷乙醇洗涤,12 000 r/min离心5 min,弃上清,干燥后加入10~20 μL灭菌纯水。溶解后以紫外分光光度计定量为1 g/L。检测引物P1、P2的PCR反应条件:94℃预变性 3 min,94 ℃ 0.5 min,50 ℃ 0.5 min,72 ℃ 1 min,进行40个循环,最后72℃延伸7 min。反应结束后取5 μL扩增产物用1%琼脂糖进行电泳,观察结果。
2.2 病毒分离
将脏器置于研钵中并在冰上研碎,按研碎组织体积占据30%的比例加入DMEM制备组织悬液,悬液以12 000 r/min离心15 min,收集上清,以0.22 μm滤膜除菌后用于病毒的细胞培养。用含10%胎牛血清的DMEM培养液在37℃二氧化碳培养箱中培养CRFK细胞,细胞长成单层后倾去培养液,加入除菌组织悬液2 mL于31.8℃吸附2 h[9],中间晃动数次,倾倒出吸附液,然后加入含10%胎牛血清的DMEM培养液,置于二氧化碳恒温箱中31.8℃培养,以3~4 d作为标准,盲传至出现病变后收获各代病毒培养物。
2.3 分离病毒的PCR检测和VP2全基因序列克隆测定
对出现病变后收获的各代病毒培养物提取DNA,12 000 r/min 离心15 min,弃上清,加入490 μL的1×TNE(消化缓冲液),10 μL 蛋白酶K,55 ℃消化过夜,其余步骤同2.1。以引物P1、P2进行PCR扩增,反应结束后通过琼脂糖凝胶电泳观察结果。用两对测序引物AD2、DV2和AD1、DV1分别对病毒分离前后的DNA进行PCR扩增。PCR采用25 μL体系。取2 μg DNA 作为模板,加入 10×Buffer 2.5 μL,上下游引物各1 μL、2.5 mmol/L 的 dNTP 2 μL、最后加0.5 μL 的 Taq 酶,用灭菌纯水补足到25 μL。反应结束后分别进行电泳切胶回收,纯化产物连接PMD18-T载体,转化到感受态大肠杆菌DH5α,PCR检测阳性单克隆菌落送英骏公司进行测序。测定结果编辑后用MEGA4.1和GenBank中国内外已发表的水貂阿留申病毒VP2蛋白氨基酸序列进行同源性比较。
3 结果与分析
3.1 病料的PCR初步检测
提取幼貂脏器的DNA,并利用引物P1、P2进行PCR扩增。在脾脏DNA中得到了与预期扩增片段(693 bp)相符的核酸电泳带,见图1。

图1 PCR检测结果
3.2 病毒分离
将PCR检测为阳性的脾脏碾磨过滤除菌,除菌后的组织悬浮液吸附于单层的CRFK细胞,31.8℃培养3代无明显细胞病变,盲传到第4代培养96 h后,细胞系出现严重的细胞脱落,并有大量空斑,形成CPE(cytopathic effect)。继续在31.8℃条件下培养到第10代,仍见大量空斑和明显的CPE(图2),冻融收集培养液。

图2 分离毒株感染CRFK细胞后第10代96 h的形态观察
3.3 分离病毒的PCR检测及VP2序列测定
细胞培养物提取DNA后PCR检测仍为阳性(图3),对病毒分离前后提取的DNA分别用AD1、DV1和AD2、DV2两对引物进行扩增,得到了预期大小的扩增片段,见图4。切胶纯化后克隆测序表明,分离前后病毒序列无变化,登陆基因数据库比对其测序结果,该结果与美国标准毒株ADV-G的VP2核苷酸同源性为94.7%,进一步证明了ADVZYL1为水貂阿留申病毒,而且此毒株可以在CRFK细胞中稳定生长。
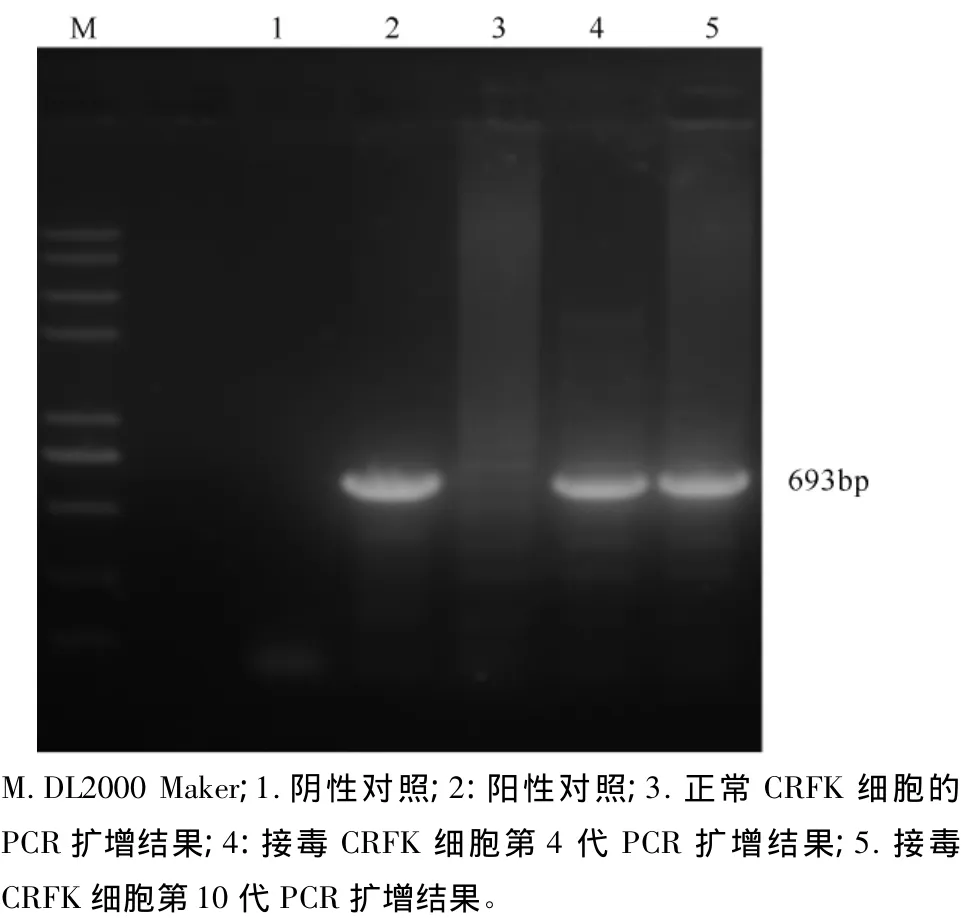
图3 病毒分离后培养液PCR检测结果
3.4 ADV的VP2蛋白同源性比较
测序结果用DNAStar进行编辑。将编辑后ADVZYL1毒株的VP2基因与GenBank中的国际毒株ADV-Far East(DQ371395)、ADV-FIN(GQ336866)、ADV-G(M20036)、ADV-LN1(GU183264)、ADV-LN2(GU183265)、ADV -LN3(GU269892)、ADV -SL3(X97629)、ADV-TR(U39013)、ADV-TR2(U39014)、ADV-Utah-1(Z18276)的核苷酸序列进行同源性比较,见表1。结果显示,ADV-ZYL1与其它亚型的毒株相比较,VP2蛋白氨基酸同源性为92.6% ~96.1%,其中与强毒力毒株ADV-Utah-1的亲缘关系最近,与远东毒株ADV-Far East的亲缘关系最远。

图4 病毒分离前后培养液PCR检测结果
4 结论与讨论
本次试验病料来源于断乳前发病死亡的幼貂,通过病理学剖检发现,其具有明显脏器病变,表现为肺脏出血性炎症,肾脏肿大、表面有出血点。细菌培养、犬瘟热病毒和水貂病毒性肠炎等检测结果均为阴性。应用已发表的特异性ADV引物进行PCR检测呈阳性,因此认为幼貂由ADV感染致死。病料处理后在CRFK细胞连续培养10代后,获得了稳定毒株ADV-ZYL1。利用设计的扩增VP2基因全序列的引物,分别对病料DNA提取物和病毒细胞培养物DNA进行VP2基因的测序,序列分析结果显示,分离前后VP2同源性为100%,进一步验证了病毒分离结果的可信度。

表1 11株ADV的VP2基因的氨基酸序列同源性分析结果
ADV的VP2蛋白由VP2基因编码而成,在病毒衣壳中占有绝大部分的比重,是其主要抗原决定簇载体[11-12],可以引起中和抗体反应[13]。人工表达的全VP2蛋白能独立组装成病毒衣壳,因此VP2基因的结构决定了病毒的抗原性[14]。近几年的研究还表明,真核、原核表达的VP2全序列或者VP2片段都可直接用于ELISA和CIEP检验,表现出很好的抗原性[15]。对VP2核苷酸和氨基酸的研究有助于研究ADV抗原性,因此本次试验选择了对ADV-ZYL1毒株的VP2全序列氨基酸进行分析,结果表明:ADV病毒虽属于细小病毒科,但是VP2蛋白的氨基酸突变率介于0.8%到8.8%之间,核苷酸突变率介于0.3%到7.7%之间,远远高于同属于细小病毒科的水貂肠炎病毒和犬细小病毒[16-17],而且突变氨基酸位点不仅集中在超变区,还广泛存在于保守区,这与之前的报道相一致[18]。ADV-ZYL1毒株与同源性最近的毒株ADV-Utah-1有着24个氨基酸的差别,再次说明了阿留申病毒的氨基酸突变十分明显。
尽管AD对水貂养殖业的危害巨大,但是目前国内外还未研制出有效预防本病的疫苗,只能通过CIEP检验血清淘汰病貂来实现对本病的控制和根除[10]。笔者的研究分析表明,ADV的核苷酸和氨基酸的突变率都很高,国内饲养水貂过程中ADV的基因在不断突变,使用进口抗原进行AD检测有可能会影响检测的特异性和敏感性,使得出现假阴性的可能性增加,从而弱化了AD的净化效果。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]Fox J M,Stevenson M A,Bloom M E.Replication of Aleutian mink disease parvovirus in vivo is infiuenced by residues in the VP2 protein[J].Journal of Virology,1999,73(10):8713-8719.
[3]Bloom M E,Alexandersen S,Perryman S,et al.Nucleotide sequence and genomic organization of Aleutian mink disease parvovirus(ADV):sequence comparisons between a nonpathogenic and a pathogenic strain of ADV[J].Journal of Virology,1988,62(8):2903-2915.
[4]徐凤宇,王树志.水貂阿留申病概述[J].经济动物学报,2006,10(2):106-111.
[5]朱善元,王健.水貂阿留申病基因检测芯片的研究与初步应用[J].中国预防兽医学报,2006,28(6):688-691.
[6]Knuuttila A,Uzcátegui N,Kankkonen J,et al.Molecular epidemiology of Aleutian mink disease virus in Finland[J].Vet Microbiol,2009,133(3):229-238.
[7]Themudo G E,Ostergaard J,Ersbøll A K.Persistent spatial clusters of plasmacytosis among Danish mink farms[J].Preventive Veterinary Medicine,2011,102(1):75-82.
[8]Qie K L,Durrant G,Wolfinbarger J B,et al.The relationship between capsid protein(VP2)sequence and pathogenicity of Aleutian mink disease parvovirus(ADV):a possible role for raccoons in thetransmission of ADV infections[J].Journal of Virology,1996,70(2):852-861.
[9]Bloom M E,Race R E,Wolfinbarger J B.Characterization of A-leutian disease virus as a parvovirus[J].Journal of Virology,1980,35(3):836-843.
[10]刘晓,刁燕,杜锐.水貂阿留申病毒的分子生物学研究进展[J].经济动物学报,2010,14(1):52-55.
[11]梁冬莹,华育平,曾祥伟.水貂阿留申病毒VP2基因主要抗原表位区的原核表达[J].东北林业大学学报,2007,35(6):39-41.
[12]徐磊,闫喜军,张蕾,等.水貂阿留申病毒VP2基因的原核表达及初步应用[J].中国农学通报,2010,26(8):7-11.
[13]Bloom M E,Best S M,Hayes S F,et al.Identification of Aleutian mink disease parvovirus capsid sequences mediating antibody-dependent enhancement of infection,virus neutralization,and immune complex formation[J].Journal of Virology,2001,75(2):11116-11127.
[14]Christensen J,Strorgard T,Bloch B,et al.Expression of Aleutian mink disease parvovirus proteins in a baculovirus vector system[J].Journal of Virology,1993,67(1):229-238.
[15]杨莘,易立,王建科,等.水貂阿留申病毒结构蛋白与非结构蛋白在疾病诊断与疫苗研发中的应用[J].动物医学进展,2011,32(1):69-72.
[16]Zhang Renzhou,Yang Songtao,Zhang Wei,et al.Phylogenetic analysis of the VP2 gene of canine Parvoviruses circulating in China[J].Virus Genes,2010,40(3):397-402.
[17]Zuo Jing,Rao Jiahui,Xu Huihui,et al.Analysis of the VP2 gene sequence of a new mutated mink enteritis parvovirus strain in PR China[J].Virology Journal,2010,7:124.
[18]华育平,马建.阿留申病细小病毒的分离及VP2基因遗传衍生分析[J].畜牧兽医学报,2005,36(9):960-963.

