哈茨木霉分生孢子提取物对杨树烂皮病菌、水稻稻瘟病菌的抑制作用1)
池玉杰 伊洪伟 李东东
(东北林业大学,哈尔滨,150040)
木霉菌(Trichoderma spp.)是在生物防治上应用最为广泛的一类真菌。据文献报道[1],已有多种木霉菌用于真菌病害的生物防治,既包括土传病害,又包括树木枝干病害,都取得了相当不错的防治效果。目前,生产上常用的木霉菌剂多为它的孢子制剂,将木霉发酵制成的孢子制剂进行种子包衣或土壤处理,可以有效地防治苗期病害。以色列Makhteshim Agan公司开发的以哈茨木霉T39菌株发酵液的生防制剂(Trichodex)为25%可湿性粉剂,可以用于防治灰霉病、苗枯病、霜霉病和白粉病等叶部病害及果实在储藏期的腐烂[2]。哈茨木霉(Trichoderma harzianum)的特点是抗逆性强、活性高、生长快。本地种由于适应当地气候、水土条件,施药后能很快地在防治基体上生长,起到抑制“真菌病害”的作用[3-5]。但对于中国东北地区的严寒气候,能够应用在多种林木和农作物上的木霉制剂还未见报道[6]。杨树烂皮病是世界性的严重病害,主要为害杨、柳树等阔叶树的枝干,在我国东北、西北、华北等地广泛发生,传染性极强,严重时常导致林木大片死亡。由真菌引起的水稻稻瘟病(rice blast)是水稻上的一种极具毁灭性的病害,病原菌的无性世代为Pyricularia grisea(Cooke)Sacc.,有性世代为 Magnaporthe grisea(Hebert)Bart。病菌在种子和稻草上越冬,播种后导致苗瘟,若气温在15℃以上又遇降水潮湿,病菌能够迅速大量传播,侵入稻株组织吸收养分,破坏细胞,在叶片上产生边缘黄褐色、中央灰色的梭形病斑,随后汇合成梭形条斑,叶片枯焦,影响水稻灌浆成熟。本文运用甲醇、乙醇、NaOH、超声波4种方法对“本地种”哈茨木霉分生孢子进行提取,分别测定了各种提取物对杨树烂皮病菌、水稻稻瘟病菌的抑制作用,从而找出提取分生孢子中抑菌活性物质的最佳溶剂与方法,为搞清木霉菌的生防机制和进一步开发木霉生物杀菌剂奠定基础。
1 材料与方法
1.1 菌种来源
哈茨木霉菌株分离自实验室栽培食用菌灰树花时染菌的菌袋。杨树烂皮病菌(Cytosprora chrysosperma)采自大庆市林业局红旗林场20年生的小黑杨树林内具有杨树烂皮病斑的枝条,自行分离得到。水稻稻瘟病1号、2号菌株为黑龙江八一农垦大学靳学慧教授惠赠。
1.2 菌种培养与分生孢子的收集
将哈茨木霉接种到直径9 cm的PDA平板上,于25℃下培养7 d,产孢后用无菌水将分生孢子洗脱,配成1×107个孢子/mL的孢子悬浮液作为扩大培养菌种。在无菌条件下,将上述分生孢子悬浮液接种到装入液体PDA培养基中,于28℃恒温扩大培养,待长满孢子后用无菌水将分生孢子洗脱,用两层纱布过滤。取滤液于5 000 r/min离心30 min,收集沉淀物(分生孢子)供提取用。
1.3 抗菌物质提取
甲醇法:取10 g沉淀物,加入甲醇150 mL混匀振荡,使分生孢子充分溶于甲醇中,在常温下浸泡24 h,于3 000 r/min离心15 min,收集上清液,用旋转蒸发器((60±1)℃)水浴减压浓缩后,获得膏状提取物(记为A)供测定用。
乙醇法:取10 g沉淀物(分生孢子,下同),加入150 mL 95%的乙醇混匀振荡,使分生孢子充分溶于乙醇中,在常温下浸泡24 h,于5 000 r/min离心15 min,弃沉淀物,收集上清液,按甲醇法减压浓缩,获得膏状提取物(记为B)供测定用。
碱法:取10 g沉淀物,加入150 mL 1%的NaOH混匀振荡,使分生孢子充分溶于溶液中,在常温下浸泡24 h,于5 000 r/min离心15 min,弃沉淀物,收集上清液,按甲醇法减压浓缩((70±1)℃)后,获得膏状提取物(记为C)供测定用。
超声波水法:采用不同强度的超声波破碎分生孢子及不同的提取次数提取抗菌物质。
①取10 g沉淀物,加入去离子水150 mL混匀振荡,使分生孢子充分溶于水中,用超声波粉碎仪将分生孢子细胞破碎(功率6 W,时间15 min),于10 000 r/min离心30 min,弃沉淀物,收集上清液用旋转蒸发器水浴减压浓缩((50±1)℃)后,获得膏状提取物(记为D1)供测定用。
②取10 g沉淀物,加入去离子水150 mL混匀振荡,使分生孢子充分溶于水中,用超声波粉碎仪将分生孢子细胞破碎(功率4 W,时间5 min),3 000 r/min离心15 min,分别收集沉淀物和上清液,上清液用旋转蒸发器水浴减压浓缩((50±1)℃)后,获得膏状提取物(记为D2)供测定用。
③取乙醇法收集的沉淀物,再加去离子水150 mL,用超声波粉碎仪重复处理(方法同B),3 000 r/min离心15 min,弃滤渣,取上清液用旋转蒸发器水浴减压浓缩((50±1)℃)后,获得膏状提取物(记为D3)供测定用。
1.4 提取物抑菌活性的测定
用无菌水将上述各种方法提取的提取物分别稀释成 100(A1、B1、C1、D11、D21、D31)、1000(A2、B2、C2、D12、D22、D32)倍母液,用细菌过滤器过滤,取培养7d的杨树烂皮病菌、稻瘟病1号、2号菌株菌饼(直径5 mm)各1块接种于平板中央,将滤液150 μL滴加到菌饼上,置于恒温培养箱中25℃培养,每处理3次重复,以滴加150 μL无菌水为对照。5 d后用十字交叉法测量病原菌菌落直径,并按下式计算抑菌率。
2 结果与分析
2.1 哈茨木霉分生孢子提取物对杨树烂皮病菌的影响
2.1.1 甲醇、乙醇和NaOH分生孢子提取物对杨树烂皮病菌的抑制
用甲醇、乙醇和NaOH 3种溶剂对哈茨木霉分生孢子进行提取,得到的抑菌结果见表1。方差分析结果(表2)表明,各溶剂提取物对菌落生长抑制差异不显著。从表1可以看出,对母液稀释100倍处理的抑菌效果好于稀释1 000倍的处理。其中将NaOH提取物稀释100倍的抑菌效果最好,抑菌率为39.46%,而乙醇和甲醇提取物的抑菌效果较弱。
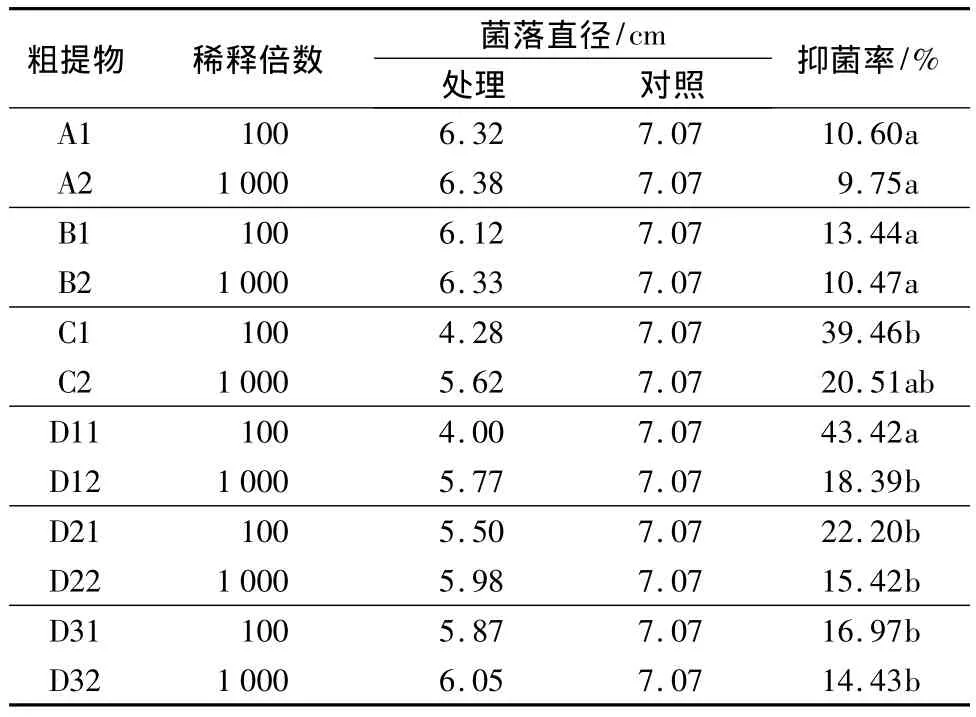
表1 不同溶剂与超声波水法不同处理提取物对杨树烂皮病菌的抑菌率
2.1.2 超声波水法分生孢子提取物对杨树烂皮病菌的抑制
用超声波水法对哈茨木霉分生孢子进行提取,得到的抑菌结果见表1。方差分析结果(表2)表明,超声波水法不同处理提取物对菌落生长抑制差异显著。其中:D11的抑菌率最高,为43.42%;D32的抑菌率最低,为14.43%。

表2 不同溶剂与超声波水法不同处理提取物对杨树烂皮病菌落生长抑制方差分析结果
2.2 哈茨木霉分生孢子提取物对水稻稻瘟病菌1号、2号菌株的影响
2.2.1 甲醇、乙醇和 NaOH分生孢子提取物对1号、2号水稻稻瘟病菌的抑制
用甲醇、乙醇和NaOH对哈茨木霉分生孢子进行提取,得到的抑菌结果如表3。方差分析结果(表4)表明,各溶剂提取物对稻瘟病1号菌株的菌落生长抑制差异不显著,对2号菌株的菌落生长抑制差异显著。从表3可以看出:对母液稀释100倍处理的抑菌效果明显好于稀释1 000倍的处理,其中将甲醇提取物稀释100倍对1号菌株的抑菌效果最好,抑菌率为35.78%,而乙醇和NaOH的提取物对1号菌株的抑菌效果较弱;将乙醇提取物稀释100倍对2号菌株的抑菌效果最好,抑菌率为18.52%,而甲醇和NaOH的提取物对2号菌株的抑菌效果较弱。
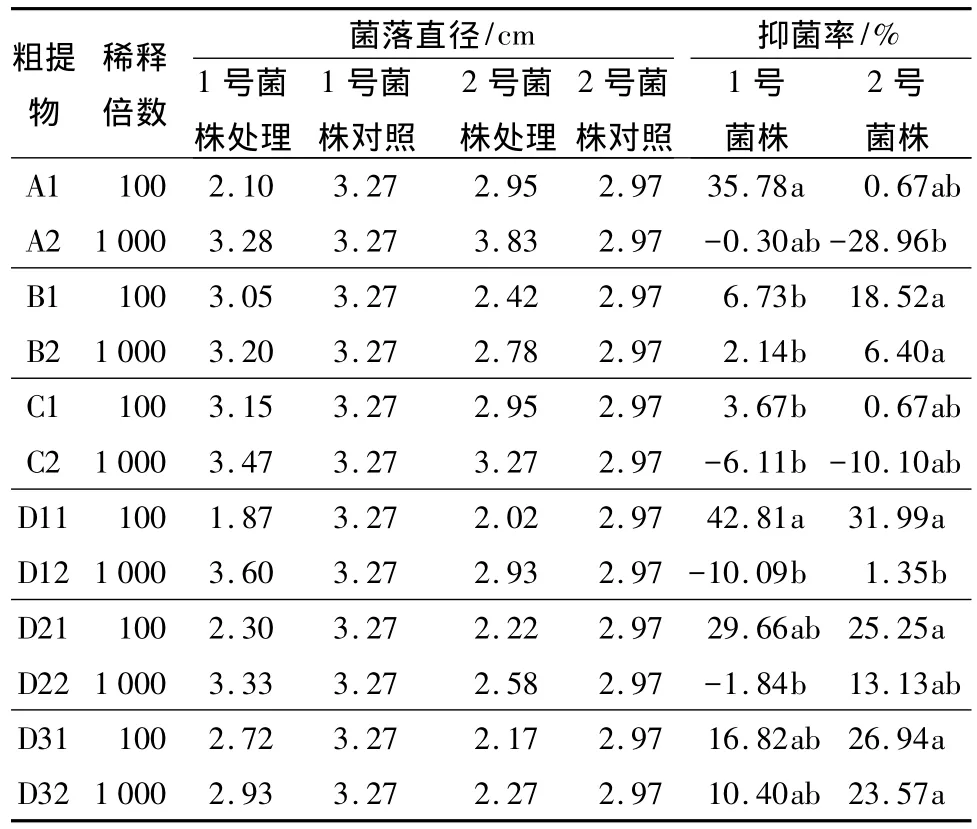
表3 不同溶剂与超声波水法不同处理提取物对水稻稻瘟病菌1号、2号菌株的抑菌率

表4 不同溶剂提取物对稻瘟病1号、2号菌株菌落生长抑制的方差分析结果
2.2.2 超声波水法分生孢子提取物对水稻稻瘟病菌1号、2号菌株的抑制
用超声波水法对哈茨木霉分生孢子进行提取,得到的抑菌结果见表3。从表3可以看出,D1提取物稀释100倍对1号和2号菌株的抑菌率均最高,分别为42.81%和31.99%。方差分析结果(表5)表明,超声波水法不同处理提取物对1号、2号菌株菌落生长抑制的差异都不显著。
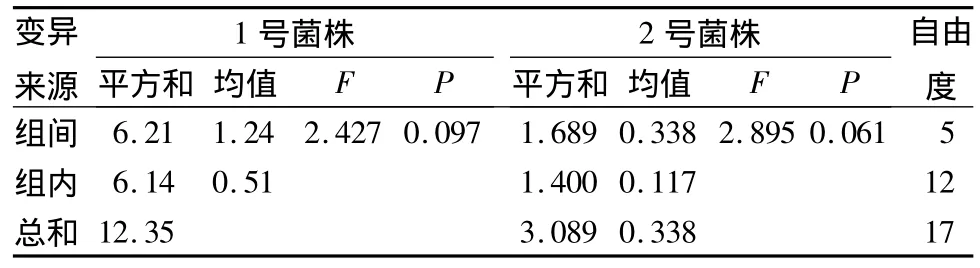
表5 超声波水法不同处理提取物对稻瘟病1号、2号菌株菌落生长抑制的方差分析结果
3 结论与讨论
目前,防治植物病原菌的木霉菌剂多以分生孢子为主要成分,而对分生孢子抑菌活性物质的提取,有助于深入了解分生孢子防病的机制。本文采用甲醇、乙醇、NaOH等溶剂和不同强度及不同提取次数的超声波破碎法对哈茨木霉分生孢子进行了抗菌物质提取,用不同提取物分别对杨树烂皮病菌、水稻稻瘟病菌进行了抑菌试验。目的是找出提取分生孢子中抑菌物质的最佳溶剂与方法,为进一步开发木霉生物杀菌剂奠定基础。试验结果表明,无论是抑制杨树烂皮病菌还是水稻稻瘟病菌,提取抑菌物质的最佳方法均为超声波水法的第一种处理,它能够获得抑菌效果最强的活性物质。D1提取物稀释100倍后对杨树烂皮病菌的抑菌率仍高达43.42%,对水稻稻瘟病菌1号、2号菌株的抑菌率也分别高达42.18%和31.99%。超声波水法提取物抑菌率的方差分析结果表明:处理杨树烂皮病菌时,3种超声波水法提取物差异显著;处理2个水稻稻瘟病菌菌株时都不显著。在3种不同溶剂分生孢子提取物的抑菌试验中,将NaOH提取物稀释100倍后对杨树烂皮病菌的抑菌率相对较高,为39.46%,而甲醇和乙醇提取物的抑菌效果较弱,分别为10.60%和13.44%;将甲醇提取物稀释100倍后对水稻稻瘟病菌1号菌株的抑菌率相对较高,为35.78%;将乙醇提取物稀释100倍后对水稻稻瘟病菌2号菌株的抑菌率相对较高,为18.52%。3种不同溶剂分生孢子提取物抑菌率的方差分析表明,水稻稻瘟病菌2号菌株的菌落生长抑制差异较显著。
[1]杨合同,唐文华,Ryder M.木霉菌与植物病害的生物防治[J].山东科学,1999,12(4):7-15.
[2]Rabeendran N,Jones E E,Moot D J,et al.Biocontrol of Sclerotinia lettuce drop by Coniothyrium minitans and Trichoderma hamatum[J].Biological Control,2006,39(3):352-362.
[3]辛雅芬,商金杰,高克祥.拮抗木霉菌的生防机制研究进展[J].东北林业大学学报,2005,33(4):88-91.
[4]于新,田淑慧,徐文星,等.木霉菌生防作用的生化机制研究进展[J].中山大学学报:自然科学版,2005,44(2):86-90.
[5]Song Xiaoyan,Shen Qingtao,Xie Shutao,et al.Broad-spectrum antimicrobial activity and high stability of Trichokonins from Trichoderma koningii SMF2 against plant pathogens[J].FEMS Microbiology Letters,2006,260(1):119-125.
[6]Washington O,Michael J,Aad T.Effect of Infesting soil with Trichoderma harzianum and amendment with coffee pulp on survival of Armillaria[J].Biological Control,2003,26(3):293-301.

