锂离子电池非水有机电解液研究现状与进展
李 劼,袁长福,张治安,赖延清,刘业翔
(中南大学冶金科学与工程学院,湖南 长沙 410083)
电解液作为锂离子电池的核心三要素之一,对锂离子电池各方面性能都有着重要的影响。例如其熔、沸点直接关系到电池能在何种温度下使用,电池的倍率特性与电解液电导率直接相关,电化学窗口则决定了正负极材料的配对选用。而且,相比较改进电池正负极材料性能或改良电池结构设计来说,改善电解液各方面特性对于提高电池性能来说显得更加经济有效,因为,电解液的替换对原有生产工艺来讲影响不大。
一般,好的电解液应当具备如下特性:(1)稳定性高,要求电解液具备高的闪点、高的分解温度、低的电极反应活性等;(2)电导率高,要求电解液粘度低、锂盐溶解度和电离度高;(3)宽温度工作范围,要求电解液具有宽液程;(4)优良的负极成膜特性,当使用石墨作为负极时,要求电解液能在首次充放电过程中形成稳定低阻抗的SEI膜;(5) 合适的分解电压,要求电解液的电化学窗口能够满足工作要求。
锂离子电池电解液研究的难点在于其某些性能之间存在相互制约的关系,使得研究者很难找到一种理想的电解液配方。对不胜枚举的相关研究工作进行总结的时候,可以深刻体会到这点,而且认识到这点对于客观评价相关研究工作,进而把握正确的研究方向极其重要。基于这一思想,下面分别从锂盐、溶剂、添加剂三方面对锂离子电池电解液的研究现状进行评述。
1 锂盐研究现状与最新进展
锂盐是电解液离子传导的主体,是电解液的核心组分。根据其阴离子是否含有有机官能团,可分为无机锂盐和有机锂盐。
性能好的锂盐应当具备如下特性:(1)宽温度范围内易溶于有机溶剂,易于解离;(2)对铝集流体有良好的钝化作用;(3)高的化学、电化学和热稳定性;(4)易于制备,环境友好,成本低。
目前锂盐的研究现状是:文献报道的锂盐种类繁多,但同时满足上述特性均优良要求的非常少,有些锂盐虽具备若干优良特性,但往往由于某一致命弱点而不被采用,如20世纪80年代在锂离子电池中广泛应用的LiAsF6,虽然与LiPF6、LiBF4、LiClO4、LiCF3SO3(简称 LiTFS)、LiN(SO2CF3)2(简称LiTFSI)相比,其综合电化学性能最好[1],但由于砷的毒性而逐渐被淘汰。
目前,商业化应用最广的锂盐是LiPF6,关于LiPF6用作锂离子电池电解质锂盐的缺点有很多报道,包括热稳定性差(高温条件下,LiPF6<=>PF5+LiF反应平衡常数很大,生成的PF5与有机溶剂具有很高的反应活性),易水解,生成HF,破坏SEI膜的稳定,溶解正极活性材料,进而引起容量的衰减和安全隐患[2],而且其较低的低温电导率限制了其在低温环境下的使用。因此,LiPF6不过是退而求其次的无奈选择。
致力于寻找一种性能更为优良的全新锂盐以取代LiPF6的研究工作一直以来是业界关注的焦点。其中硼酸酯类有机锂盐的开发工作居多,为近年来该领域最为活跃且最受关注的课题。自Xu W等[3]首次报道合成出具有高解离常数、高电化学稳定性的LiB(C2O4)2(简称LiBOB),Xu K等[4]将此用作锂离子电池电解质锂盐,电池容量发挥高、循环与倍率特性均良好,特别是在60℃下性能依然稳定后,便引起了业界对Li-BOB广泛而深入的研究,主要包括与之相配溶剂体系的优化,电池各方面性能的进一步评估[5],与LiFP6相比,LiBOB的最大优势是稳定性与成膜性,但在线性碳酸酯中较低的溶解度和较差的低温特性成为其大规模应用的主要障碍。为解决这一矛盾,Zhang S S设计并制备出具有LiBF4和LiBOB阴离子结构各一半的新型锂盐LiBF2(C2O4)(简称LiODFB),结合了LiBF4低温特性好和LiBOB成膜与稳定性的优势[6]。Li J等从溶剂体系优化、电池性能评价等方面做了进一步的研究[7]。总结起来,虽然LiODFB继承了LiBOB的大部分优点,低温特性也有所提升,但仍未达到理想结果,其电导率本质上还无法与传统LiPF6基功能电解液相媲美,高倍率特性不佳阻碍了其在高功率电池中的应用。此外,含磷(P)类有机锂盐也有少量研究,其中以LiPF3(C2F5)3(简称LiFAP)性能较好,但综合性能无法与LiPF6相比,例如虽然其热分解温度高,但放热量和自分解速率也大,有违开发性能优良且稳定新型锂盐的初衷。
虽然广大科研人员在新型锂盐的开发上进行了大量艰苦卓绝的工作,但目前为止,还没有哪一种锂盐有完全取代LiPF6的趋势。近年来,与新型锂盐开发同时进行的有关锂盐的研究工作还有两大类:(1)将两种或以上的优势互补的锂盐混溶形成复合盐电解液,以期达到结合不同锂盐优势的目的。如Zhang S S等采用LiBF4加LiBOB的复合盐电解液,使LiFePO4正极的可工作温度范围拓宽到-40~80℃[8];Li M等研究显示,少量LiBOB加入到LiPF6基电解液中可以改善SEI膜性质[9];Zhang Z等则将LiODFB与LiPF6复合,使得LiFe-PO4/AG电池性能相比纯LiPF6电解液大为提高,特别是电池的高温特性[10];Gnanaraj J S等则研究了LiFAP与LiPF6的复合效果,结果显示高温下复合盐电解液与石墨负极的相容性要好于任一纯锂盐电解液[11];(2)较早研究过的某方面性能独特的锂盐重新引起研究人员的兴趣。随着市场对不同性能锂离子电池的差异化需求的不断出现,以及正负极材料的更新换代带来与现有锂盐的相容性问题,使研究人员认识到众多较早研究和使用的锂盐中有很多被遗弃的瑰宝,具有很大的重新应用价值。如LiBF4虽然由于易水解、电导率较低、常温特性不如LiPF6好而不被广泛应用,但Zhang S S等通过重新进行更为深入的研究发现,虽然其低温下的电导率不如LiPF6,但却表现出比LiPF6远为优异的低温性能,此外,其高温特性也要更好,对水分不如LiPF6敏感,而且还认为常温循环特性也相当[12],因此在低温使用性能要求较高的场合更为适用;LiTFSI是早期使用的一种锂盐,由于存在对正极的腐蚀问题而逐渐不被采用,现在则作为聚合物锂离子电池电解质锂盐而研究较多,但随着高嵌锂电位正极材料的发展,需要寻求与之相配的高电压电解液,因此具有宽电化学窗口、高热稳定性等优良性能的LiTFSI重新引起了研究人员的兴趣,如Abu-Lebdeh Y等研究显示LiTFSI与己二腈[CN(CH2)4CN,简称AND]配成电解液,电化学窗口可达6 Vvs.Li+/Li[13];Marom R等重新对比研究了LiClO4与LiPF6基碳酸酯类有机溶剂电解液的各方面性能,认为LiClO4的阳极稳定性和Al集流体致钝性虽然不如LiPF6,但不存在HF破坏负极表面SEI膜的问题,虽然LiClO4的反应热也更高,但是两者反应起始温度相当,由此提出重新应用LiClO4的可能[14]。
2 溶剂研究现状与最新进展
溶剂是锂离子电池非水有机电解液的主体成分,溶剂的各种物理化学参数对电解液性能有着至关重要的影响。
好的溶剂体系应当同时具备以下几个特性:(1)适当的极性与粘度。极性与粘度是影响电导率的两个主要因素,介电常数大的极性溶剂有利于锂盐阴阳离子解离,提高锂盐溶解度,但同时会带来粘度上升的不利影响,这是目前采用混合溶剂体系的主要原因;(2)低熔点、高沸点。熔点与沸点直接影响电池的高低温性能;(3)高闪点、低蒸汽压。这有利于提高电池的安全性;(4)优良的成膜性能。采用低嵌锂电位负极时,能否形成优良的固体电介质膜(SEI膜)是溶剂选择需要考虑的重要方面;(5)化学稳定性好和电化学稳定性好,氧化还原电位差最好大于4.5 V;(6)无毒环保。
目前,商业化锂离子电池采用的溶剂组成一般为环状碳酸酯[主要有碳酸乙烯酯(EC)、碳酸丙烯酯(PC)]和链状碳酸酯[主要有碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸甲乙酯(EMC)]的混合物,且由于EC具有非常好的负极成膜性能,一般作为溶剂的一个固定组成。相比EC,PC溶剂成本低,且具有较高的化学、电化学和光稳定性,能够在更为恶劣的条件下使用,PC的凝固点(-42℃) 远低于EC(+36.4℃),基于PC电解液的使用能显著拓宽电解液的温度范围,唯一的致命缺点是PC会随Li+共嵌入石墨层,使石墨层间剥落,影响SEI膜的形成。随着具有抑制PC共嵌入功能的成膜添加剂的研究工作取得较好成果,PC的应用更加普遍。Hu C Y等研究认为,高温下,EMC不稳定,对电池安全不利,应当尽量减少EMC的用量[15]。总之为了获得最佳特性,目前,已发展到采用三元,或四元甚至五元溶剂体系。
除上述提及的最常用的碳酸酯外,其他碳酸酯类溶剂也有研究报道,如碳酸甲丙酯(MPC)、碳酸甲异丙酯(MiPC),碳酸甲丁酯(BMC)等其他非对称链状碳酸酯,它们具有很低的介电常数(εr≈3~4),因此一般需要与EC溶剂配合以加强锂盐的离解,但同时具备很低的熔点、较高的沸点、低粘度和高电化学窗口,有利于提高电池的低温性能。如Wang L等的研究显示,-20℃的低温下,LiMn2O4/Li半电池在1 mol/L LiPF6(EC∶MPC)(1∶3)电解液中的放电比容量可达111.6 mAh/g,约为室温下放电容量的93%[16]。MPC也开始应用于有特殊性能要求的商业锂离子电池中,如国内天津金牛电源材料有限责任公司公布的耐高温防气胀高温电解液JN9502系列的基本组成中就有MPC。
其他类有机溶剂用作锂离子电池电解液溶剂的研究也有较多报道,可大致分为以下几类:(1)链状羧酸酯,如乙酸甲酯(MA)、甲酸甲酯(MF)、丁酸甲酯(MB)等。这类溶剂具有很低的熔点,较低的粘度,作为共溶剂加入到EC基电解液中是应用于如宇宙空间器等特殊场合的超低温电解液开发的重要技术思路[17];(2)亚硫酸酯,如亚硫酸乙烯酯(ES)、亚硫酸丙烯酯(PS)、亚硫酸二甲酯(DMS)等。该类溶剂具有与碳酸酯相似的分子结构,更低的熔点,而且S上的孤对电子可以与Li+螯合,有利于锂盐离解,这些特性是引起研究者兴趣的主要原因。但诸多研究表明,环状亚硫酸酯,如ES、PS等更适合于用作PC-基电解液的成膜添加剂[18],而链状亚硫酸酯,如DMS、DES等,成膜特性差,但有一定潜力用作EC基电解液的低粘度共溶剂,提高电解液的低温性能和安全性。B T Yu等对比研究了 1 mol/L LiPF6(EC∶DMS)(1∶1)与1 mol/L LiPF6(EC∶DMC)(1∶1)电解液在室温(25℃)下的特性,发现前者电导率比后者高6.5 mS/cm,在Li/石墨半电池中,虽然前者的首次充放电效率更低,但充电容量和后续循环效率更高[19]。这些结果值得关注,也说明有进一步研究的意义;(3)氟代有机溶剂,包括氟代碳酸酯、氟代羧酸酯、氟代醚等,如三氟代碳酸丙烯酯(TFPC)、二氟代乙酸甲酯(MFA)。高热稳定性是该类有机溶剂的最大特点,这对提高电池的安全性十分有利,是不燃有机溶剂开发的重要方面。关于EC、PC成膜特性差异巨大的机理,学术界存在甲基的“电子效应”(PC上多余甲基的给电子作用)和“空间效应”的争议。X J Wang等[20]的最新研究结果显示,一氟代碳酸丙烯酯(MFPC)、三氟代碳酸丙烯酯(TFPC)、EC、PC的成膜能力顺序为TFPC>EC>MFPC>>PC,含大取代基团的EC-CH2CH2Si(CH3)2OSi(CH3)3和EC-CH2CH2Si(CH3)3具有与EC一样好的成膜特性,证明“电子效应”是影响成膜的最主要原因,该结果对基于EC结构的溶剂开发工作具有很好的启示作用,也表明基于EC结构的有机溶剂开发工作具有很好的前景,具有进一步研究的价值。此外,当负极采用高嵌锂电位负极时,如Li4Ti5O12,由于负极表面不形成SEI膜,因此电解液溶剂的成膜特性可以不作考虑,使得溶剂的选择范围更广,如A Abouimrane等[21]以成膜特性不是很好,但热稳定性优良的四甲基砜(TMS)和EMC混合,用作Li4Ti5O12/LiNi0.5Mn1.5O4电池电解液溶剂,电池可以很好地以2C倍率循环1000次。因此,在这种负极材料体系电池中,那些主要因成膜特性不佳而不被使用的溶剂具有很好的应用前景,应当引起研究者的更多关注。
3 添加剂研究现状与最新进展
添加剂是目前功能型电解液的技术核心之所在,也是目前锂离子电池非水电解液研究的焦点。加入功能型添加剂是改善锂离子电池各方面性能最简便有效的技术途径。特别是随着锂离子电池应用领域的不断推广,普通电解液已无法满足特殊应用场合的需要,新型功能添加剂的开发变得更加重要。
目前,研究过的添加剂种类繁多,按具体功能可分为改善SEI膜性能的成膜添加剂、正极保护剂、LiPF6盐稳定剂、防过充保护剂、阻燃添加剂、离子溶剂化增强剂、集流体腐蚀抑制剂、隔膜润湿剂、降粘剂等。Zhang S S按照上述分类对各类添加剂的作用机理、研发目的和2006年7月份之前的研发工作分别做了全面而细致的综述[22]。而在这一时间之后,国内外研究者对于新型功能添加剂的开发做了很多新的工作,取得了很多新的成果,表1按照文献报道先后顺序对一些新型功能添加剂进行总结。
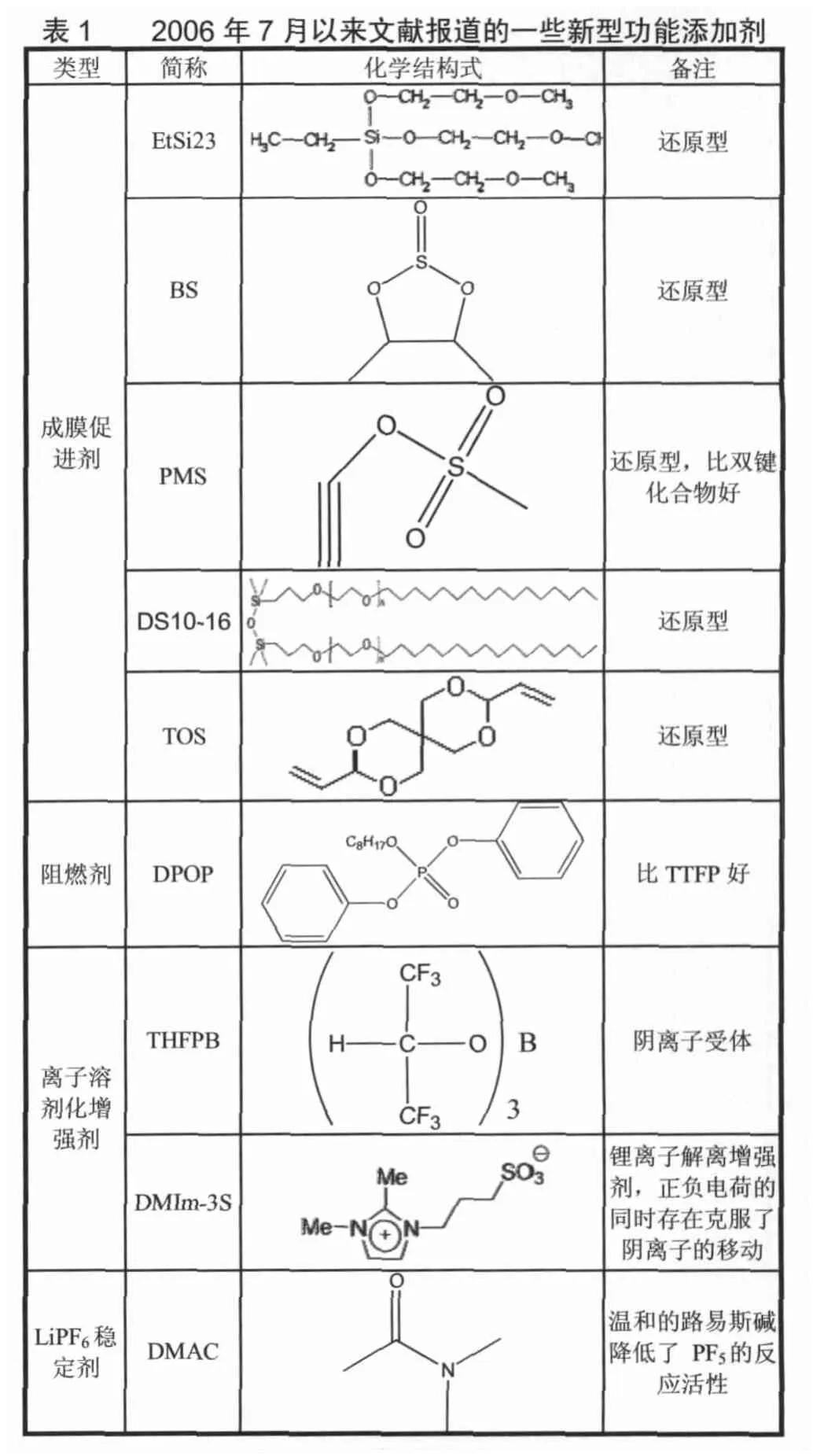
?
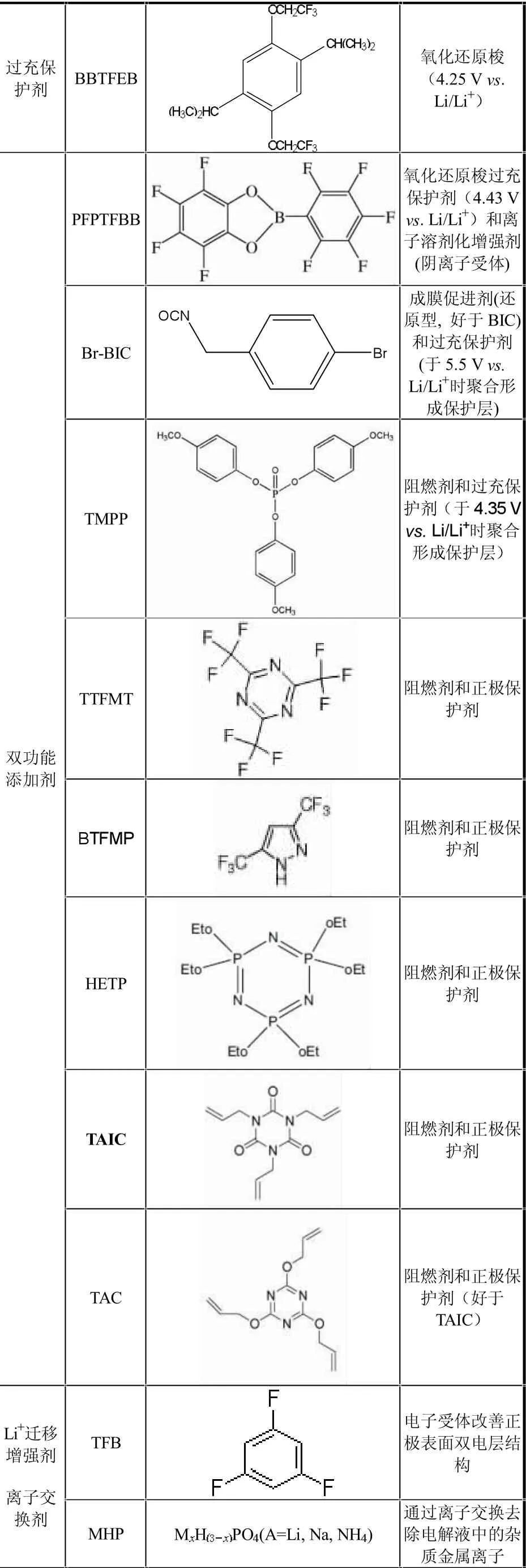
续表1 2006年7月以来文献报道的一些新型功能添加剂
近年来,添加剂研究所呈现的特征和取得的进展有以下几方面:(1)大多数新型添加剂均为以前报道过的功能添加剂的衍生物。保持主体结构不变,通过改变取代基团来调节添加剂的性能,如T Tsujikawa等[23]通过改变三磷腈的的取代基,得到分解温度满足他们所需开发的安全型电解液要求的阻燃剂C;(2)双功能甚至多功能添加剂的开发引起研究者的很大兴趣。大量研究表明,功能添加剂在改善电池某方面性能的同时,会给其他某些性能带来负面影响,这也是限制添加剂加入量的主要原因。双功能甚至多功能添加剂从一定程度上缓解了这一矛盾,因此具有很大吸引力,目前,将不同种类添加剂的功能基团进行组合设计是开发这类添加剂的主要手段[24-25];(3)某些不同类型添加剂具有协同作用。K Abe等[26]研究发现同时加入三键和双键化合物添加剂,对电池性能的提高作用比单一添加剂要高得多,特别是对电池循环性能和气体析出的改善,并认为产生协同效应的关键因素包括:未饱和部分存在结构差异,以及较大的还原电势差;(4)先理论计算再研究已逐渐取代纯粹的试探性研究。例如采用量子化学中的密度泛函理论(DFT)计算与氧化还原电位相关的最高已占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的能量值已成为寻找合适还原型成膜添加剂的重要指南[27-28],有助于提高研究效率,降低研究成本。图1为分解温度不同的三种三磷腈基阻燃剂。

图1 分解温度不同的三种三磷腈基阻燃剂
4 结语与展望
电解液对锂离子电池各方面性能有着重要影响,但是目前商用LiPF6基电解液存在诸多问题,这是导致锂离子电池性能仍不十分理想的重要方面。新型电解液的开发是进一步完善锂离子电池性能的重要途径,从而引起研究者的极大兴趣和关注。以往的研究显示,电解液某些性能之间往往存在相互制约的关系,在不根本变革现有有机电解液体系的前提下,很难获得性能十分完美的电解液。需要注意的是,不同场合对锂离子电池性能提出了不同的要求,从而对电解液也提出了不同的要求,因此开发各种功能型电解液是更为现实的目标。以往的研究往往仅侧重锂盐、溶剂、添加剂中的某一方面,三者之间存在相容性问题应该引起更多的重视。
随着对锂离子二次电池内部充放电机理研究的不断深入开展,相关理论与数学模型将不断被建立,以此为基础,通过分子设计、理论计算、计算机模拟仿真引导锂离子二次电池特别是电解液的开发与研究工作将变为现实,从而极大地促进该领域的研究进展。
[1]AURBACH D,EIN-ELI Y,MARKOVSKY B,et al.The Symposium on Rechargeable Lithium and Lithium-Ion Batteries[C].New Jersey:The Electrochemical Society,1995:26-42.
[2]AURBACH D,MARKOVSKY B,SALITRA G,et al.Review on electrode-electrolyte solution interactions,related to cathode mater-ials for Li-ion batteries[J].J Power Sources,2007,165:491-499.
[3]XU W,ANGELL C A.Weakly coordinating anions,and the exceptional conductivity of their nonaqueous solutions[J].Electrochem Solid-State Lett,2001,4(1):E 1-E 4.
[4]XU K,ZHANG S S,JOW T R,et al.LiBOB as salt for lithium-ion batteries,A possible solution for high temperature operation[J].Electrochem Solid-State Lett,2002,5(1):A 26-A 29.
[5]XU K.Tailoring electrolyte composition for LiBOB[J].J Electrochem Soc,2008,155:A 733-A 738.
[6]ZHANG S S.An unique lithium salt for the improved electrolyte of Li-ion battery[J].Electrochem Commun,2006,8(9):1423-1428.
[7]LI J,XIE K,LAI Y,et al.Lithium oxalyldifluoroborate/carbonate electrolytes for LiFePO4/artificial graphite lithium-ion cells[J].J Power Sources,2010,195:5344-5350.
[8]ZHANG S S,XU K,JOW T R.An improved electrolyte for the LiFePO4cathode working in a wide temperature range[J].J Power Sources,2006,159:702-707.
[9]LI M Q,QU M Z,HE X Y,et al.Electrochemical performance of Si/graphite/carbon composite electrode in mixed electrolytes containing LiBOB and LiPF6[J].J Electrochem Soc,2009,156(4):A 294-A 298.
[10]ZHANG Z,CHEN X,LI F,et al.LiPF6and lithium oxalyldifluoroborate blend salts electrolyte for LiFePO4/artificial graphite lithium-ion cells[J].J Power Sources,2010,195(21):7397-7402.
[11]GNANARAJ J S,ZINIGRAD E,ASRAF L,et al.On the use of LiPF3(CF2CF3)3(LiFAP)solutions for Li-ion batteries:Electrochemical and thermal studies[J].Electrochem Commun,2003,5(11):946-951.
[12]ZHANG S S,XU K,JOW T R.Study of LiBF4as an electrolyte salt for a Li-ion battery[J].J Electrochem Soc,2002,149(5):A 586-A 590.
[13]ABU-LEBDEH Y,DAVIDSON I.High-voltage electrolytes based on adiponitrile for Li-ion batteries[J].J Electrochem Soc,2009,156(1):A 60-A 65.
[14]MAROM R,HAIK O,AURBACH D,et al.Revisiting LiClO4as an electrolyte for rechargeable lithium-ion batteries[J].J Electrochem Soc,2010,157(8):A 972-A 983.
[15]胡传跃,李新海,郭军,等.高温下锂离子电池电解液与电极的反应[J].中国有色金属学报,2007,17(4):629-635.
[16]WANG L,HUANG Y,JIA D.LiPF6-EC-MPC electrolyte for Li-Mn2O4cathode in lithium-ion battery II[J].Solid State Ionics,Diffusion&Reactions,2006,177(17/18):1477-1481.
[17]SMART M C,RATNAKUMAR B V,BEHAR A,et al.Gel polymer electrolyte lithium-ion cells with improved low temperature performance[J].J Power Sources,2007,165(2):535-543.
[18]WRODNIGG G H,WRODNIGG T M,BESENHARD J O,et al.Ethylene sulfite as electrolyte additive for lithium-ion cells with graphitic anodes[J].Electrochem Commun,1999,1(3/4):148-154.
[19]YU B T,QIU W H,LI F S,et al.A study on sulfites for lithiumion battery electrolytes[J]. J Power Sources,2006,158(2):1373-1378.
[20]WANG X J,LEE H S,LI H,et al.The effects of substituting groups in cyclic carbonates for stable SEI formation on graphite anode of lithium batteries[J].Electrochem Commun,2010,12:386-389.
[21]ABOUIMRANE A,BELHAROUAK I,AMINE K.Sulfone-based electrolytes for high-voltage Li-ion batteries[J].Electrochem Commun,2009,11:1073-1076.
[22]ZHANG S S.A review on electrolyte additives for lithium-ion batteries[J].J Power Sources,2006,162:1379-1394.
[23]TSUJIKAWA T,YABUTA K,MATSUSHITA T,et al.Characteristics of lithium-ion battery with non-flammable electrolyte[J].J Power Sources,2009,189:429-434.
[24]CHEN Z,AMINE K.Bifunctional electrolyte additive for lithiumion batteries[J].Electrochem Commun,2007,9(4):703-707.
[25]FENG J K,CAO Y L,AI X P,et al.Tri-(4-methoxythphenyl)phosphate:A new electrolyte additive with both fire-retardancy and overcharge protection for Li-ion batteries[J].Electrochimica Acta,2008,53(28):8265-8268.
[26]ABE K,MIYOSHI K,HATTORI T,et al.Functional electrolytes:Synergetic effect of electrolyte additives for lithium-ion battery[J].J Power Sources, 2008,184(2):449-455.
[27]ABE K,YOSHITAKE H,KITAKURA T,et al.Additives-containing functional electrolytes for suppressing electrolyte decomposition in lithium-ion batteries[J].Electrochimica Acta,2004,49:4613-4622.
[28]MATHEW D H,KEN T.High-throughput quantum chemistry and virtual screening for Lithium ion battery electrolyte additives[J].J Power Sources,2010,195:1472-1478.

