硫酸钠对奶牛瘤胃发酵的影响
东北农业大学动物营养研究所 王 寅 孙满吉* 孙东峰朱继红 杨 琼 张永根
硫是反刍动物的必需营养素之一,但由于硫不能够被体内储存,必须由日粮供给,其主要的来源形式为硫酸盐和含硫氨基酸(May等,2009)。硫不足会抑制瘤胃微生物蛋白质的合成(Hristov等,2007)。已有研究表明,瘤胃微生物能利用有机硫和无机硫合成含硫的氨基酸产生菌体蛋白。瘤胃细菌对硫源具有选择性,通常硫酸盐 (如硫酸钠)是瘤胃细菌最主要的硫源(Kahlon等,1975;Bouchard和Conrad,1973)。日粮中适宜的硫水平可提高瘤胃内细菌蛋白质合成、改善氨基酸平衡、提高动物生产性能(Qi等,1993)。本试验旨为研究不同添加量的硫酸钠对奶牛瘤胃发酵的影响,为探讨其对瘤胃调控机理提供依据。
1 材料与方法
1.1 试验材料 无水硫酸钠由哈尔滨富康饲料厂提供。
1.2 试验动物 选用4头体况良好,体重、日产奶量均相近,安装有永久性瘤胃瘘管的泌乳中期荷斯坦奶牛。
1.3 试验设计与日粮 试验采用4×4拉丁方设计,分4个处理组,各组分别按日粮的0%、0.4%、0.8%和1.2%添加硫酸钠 (各组N∶S分别为 16.7∶1、11.9∶1、9.6∶1、7.8∶1)。试验分为 4 期,每期18 d(预试期15 d,正试期3 d)。试验于东北农业大学香坊实习基地进行。奶牛饲粮营养需要参照2004版《奶牛饲养标准》,饲粮精粗比为50∶50,基础日粮组成及营养水平见表1。
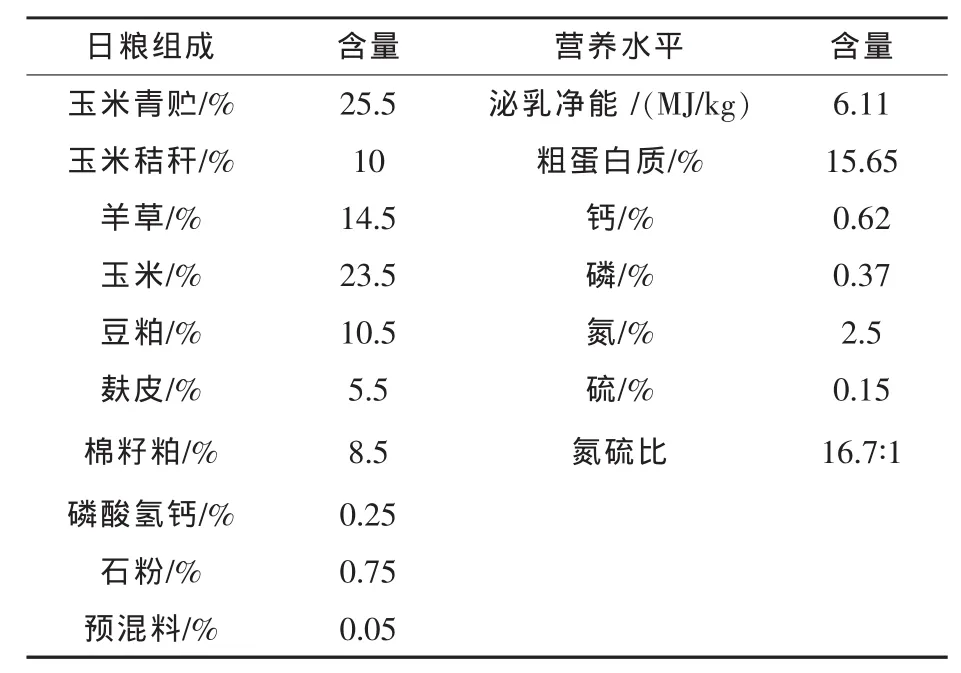
表1 日粮组成及营养水平(干物质基础)
1.4 饲养管理 试验牛拴系饲养,每天7∶30和19∶30分2次饲喂,先粗后精,自由饮水。将硫酸钠均匀添加到饲料中,混匀饲喂。
1.5 样品采集与指标测定 分别为饲喂后0、2、4、6、8、10、12、14、16、18、20、22、24 h (7∶30、9∶30、11∶30、13∶30、15∶30、17∶30、19∶30、21∶30、23∶30、1∶30、3∶30、5∶30、7∶30)取瘤胃液 50 mL,4 层纱布过滤,用于测定pH、原虫数、NH3-N和菌体蛋白浓度。
1.5.1 瘤胃液pH测定 取出瘤胃液后,用酸度计(Mettle MP 120)立即测定 pH。
1.5.2 瘤胃内原虫数测定 参照刘大程(2007)的方法配制MFS染液,采用Dehority(1984)原虫计数法,计数工具采用血球计数板。
1.5.3 瘤胃液NH3-N浓度测定 靛酚比色法测定(姜艳美等,2008)。
1.5.4 瘤胃液菌体蛋白(BCP)浓度测定 参考姜艳美等(2008)测定方法,略有改动。具体操作如下:过滤后的瘤胃液,经4000 r/min离心15 min,收集上清液于20000 r/min离心20 min,小心无损失的收集沉淀后,用FOSS(型号:2300)全自动凯氏定氮仪测定。
1.6 统计分析 试验数据采用Excel 2003软件进行整理,运用SPSS 17.0进行统计分析,结果以“平均值±标准差”表示,均值的多重比较采用Duncan’s法进行,(P < 0.05)为差异显著。
2 结果
2.1 硫酸钠对奶牛瘤胃液pH的影响 由表2可见,奶牛饲粮中添加不同水平的硫酸钠对奶牛瘤胃平均pH无显著影响(P>0.05)。各组pH的变化趋势一致,饲喂后均迅速下降,在 4 h(11∶30)、16 h(23∶30)后降低到最低点,而后缓慢上升,到下一次饲喂前达到最高,整个试验期内,各组瘤胃平均pH值均维持在6.24~6.75。

表2 硫酸钠对奶牛瘤胃液pH的影响
2.2 硫酸钠对奶牛瘤胃内原虫数的影响 由表3可知,奶牛饲粮中添加不同水平的硫酸钠后,瘤胃内平均原虫数均有所增加。其中,试验2组、3组与对照组相比均显著提高(P<0.05)。各组原虫数量饲喂前后的变化趋势基本相同,饲喂前较高,然后有所下降,为 6 h(13∶30)、18 h(1∶30)到达最高,而后又逐渐下降,到下一次饲喂前再次达到较高数量。
2.3 硫酸钠对奶牛瘤胃液NH3-N浓度的影响由表4可知,奶牛饲粮中添加不同水平的硫酸钠后,瘤胃液NH3-N平均浓度都有所降低,但与对照组相比无显著影响(P>0.05)。整个试验期内,各试验组瘤胃液NH3-N浓度的动态变化规律基本一致,均为饲喂后浓度开始逐渐上升,2 h(9∶30)达到高峰,之后逐渐下降,为下次饲喂后2 h(21∶30)再次达到高峰。
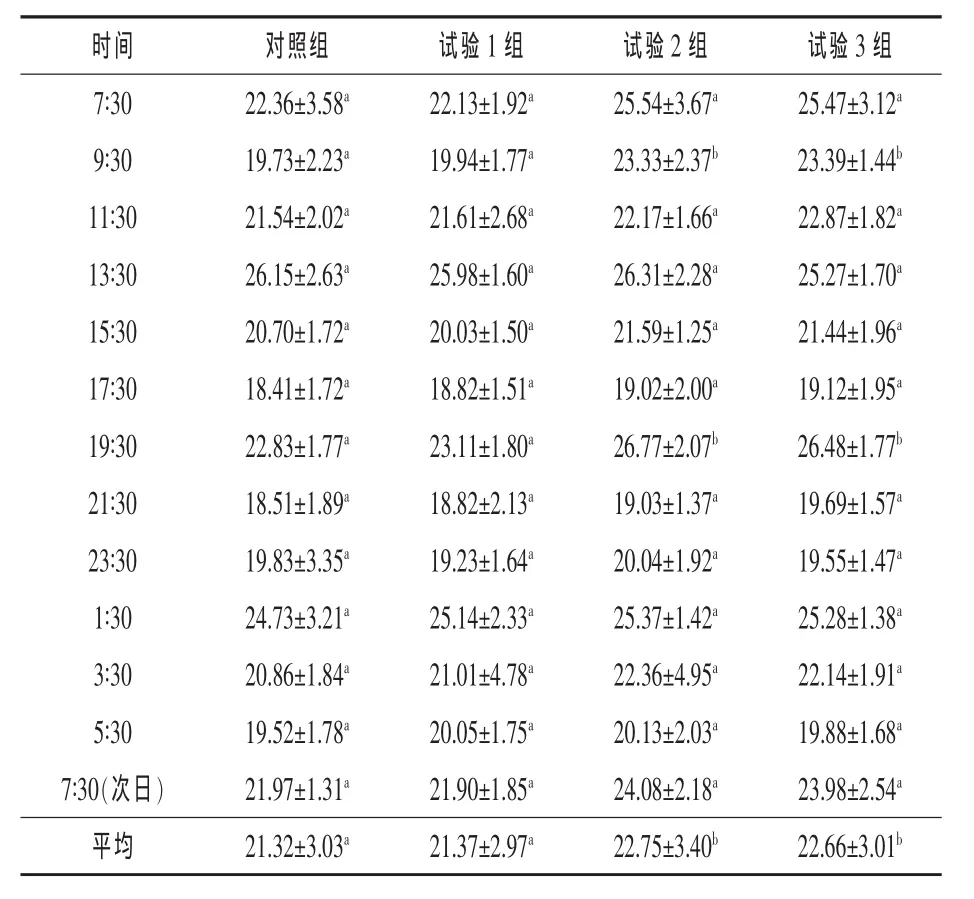
表3 硫酸钠对奶牛瘤胃内原虫数的影响105个/mL
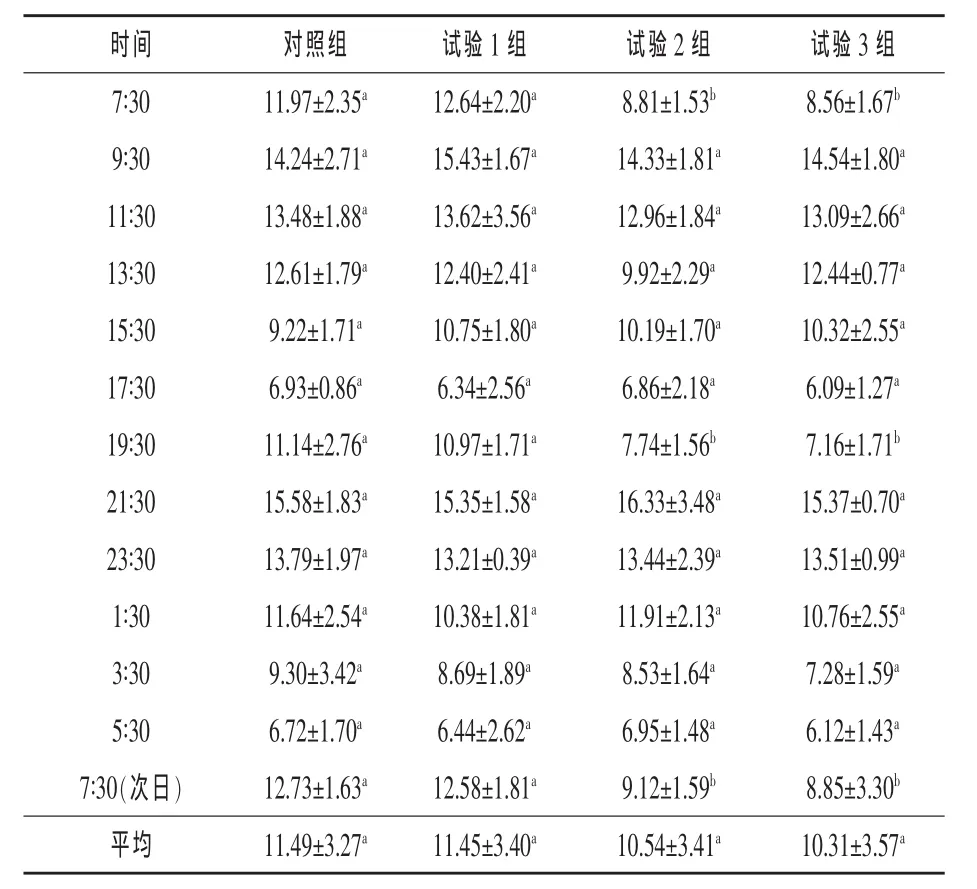
表4 硫酸钠对奶牛瘤胃液NH3-N浓度的影响mg/100 mL
2.4 硫酸钠对奶牛瘤胃液BCP浓度的影响 由表5可见,与对照组相比,试验1组、2组奶牛瘤胃液平均BCP浓度均有所提高,且试验2组差异显著(P<0.05)。试验3组与对照组比较有所降低,但差异不显著(P>0.05)。BCP浓度变化趋势显示,瘤胃液BCP浓度从饲喂后开始下降,到每次喂后 8 h,即 15∶30和 3∶30开始回升,直至再次饲喂达到高峰。
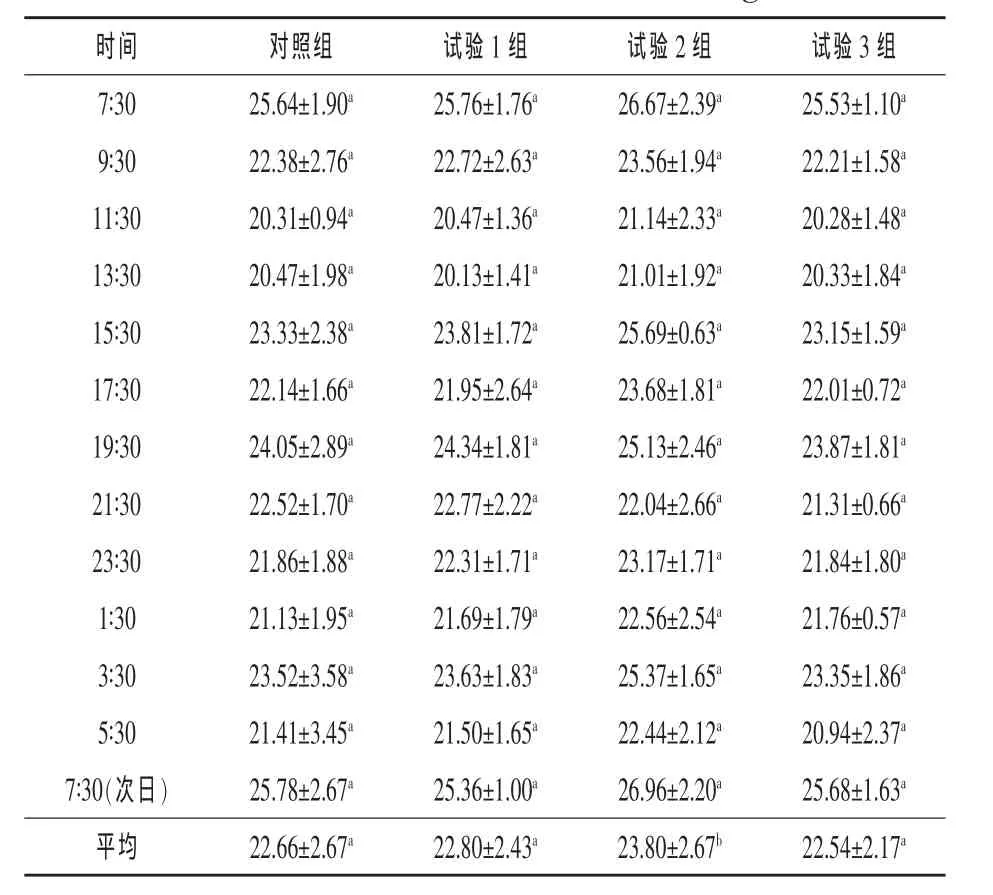
表5 硫酸钠对奶牛瘤胃液BCP浓度的影响mg/100 mL
3 讨论
3.1 硫酸钠对奶牛瘤胃液pH的影响 瘤胃液pH是评价瘤胃发酵水平的综合指标。研究表明,瘤胃液pH受唾液、日粮(性质、加工状态、处理方法)以及其降解物碱化和缓冲的影响 (刘敏雄,1991)。一般认为瘤胃液pH<6.2时,微生物蛋白质合成效率下降(王建平等,2010)。瘤胃液pH在一定范围内保持相对稳定,其变化范围为5.0~7.8(韩正康和陈杰,1988)。本试验中瘤胃液pH变化范围为6.24~6.75,且差异不显著(P>0.05),这与Zinn等(1997)报道的添加硫不影响瘤胃液pH的结论一致。说明为日粮中添加一定量的硫酸钠,对奶牛瘤胃液pH无显著影响,且对瘤胃内微生物蛋白合成效率没有负面影响。
3.2 硫酸钠对奶牛瘤胃内原虫数的影响 反刍动物瘤胃内存为大量的微生物,其中,原虫约占总数量的40%。一头健康的反刍动物瘤胃中,每毫升瘤胃液内容物约含原虫105~106个。本试验中,试验组与对照组相比原虫数量均有所增加,且试验2组、3组变化显著 (P<0.05)。Scholljegerdes等(2004)研究也表明,日粮中添加硫和尿素,结果不仅干物质和有机物的表观消化率提高,而且瘤胃内原虫的数量增加(P<0.05)并且添加硫酸钠还可以防止瘤胃微生物生长的抑制。因此本试验表明,日粮中添加适量的硫酸钠能够促进瘤胃原虫的生长,提高奶牛瘤胃微生物的活力。
3.3 硫酸钠对奶牛瘤胃液NH3-N浓度的影响奶牛瘤胃液NH3-N是瘤胃内合成菌体蛋白的主要前体物质,其适宜浓度是保证瘤胃微生物蛋白合成的首要条件(姜旭明等,2009)。氨浓度对微生物生长的临界范围是6~30 mg/100 mL(姜旭明等,2009;冯仰廉,2004)。 本试验中NH3-N 浓度为6.09~16.33 mg/100 mL,基本满足了微生物生长的需要。各添加组瘤胃液平均NH3-N浓度都有所降低(P>0.05)。各组饲喂后瘤胃NH3-N浓度均逐渐上升,而后逐渐下降,这是由于饲喂日粮后瘤胃内各种微生物迅速增加,降解日粮中的蛋白质,使NH3-N浓度快速上升,之后随着瘤胃微生物对NH3-N的利用和瘤胃壁对其的吸收,NH3-N浓度又开始逐渐下降。
3.4 硫酸钠对奶牛瘤胃液BCP浓度的影响 瘤胃微生物可以利用瘤胃发酵产生的氨基酸、氨态氮等合成微生物蛋白质,且占反刍动物蛋白质总需要量的 50% ~ 80%(Storm 和 Ørskov,1983),因此BCP的含量可以一定程度上反映瘤胃发酵的效果。本试验结果显示,试验1组和2组瘤胃液BCP浓度都有所提高,其中试验2组显著提高(P<0.05),这与原虫数的试验结果相符。可能是由于,添加一定量的硫酸钠使瘤胃内原虫数和其他微生物种群数量增加、活力增强,从而提高了瘤胃液BCP浓度。说明添加一定量的硫酸钠能够促进微生物的生长,提高微生物蛋白的合成。这与硫化物是合成菌体蛋白硫的主要来源的有关报道相符。王根林(2006)报道,一般奶牛日粮结构中氮硫比应维持为(10~12)∶1。试验3组瘤胃液BCP浓度低于其他组,可能是添加过多的硫使试验3组氮硫比较低,从而影响了BCP合成的原因。
4 结论
4.1 添加一定量的硫酸钠对奶牛瘤胃液pH影响较小。
4.2 添加适量的硫酸钠能促进瘤胃原虫的生长,其中,中、高添加量组的硫酸钠能够显著增加奶牛瘤胃内原虫数量。
4.3 添加一定量的硫酸钠会降低奶牛瘤胃液NH3-N浓度,但不显著。
4.4 适宜添加量的硫酸钠可以显著提高奶牛瘤胃液BCP浓度,而过高添加量可能会降低奶牛瘤胃液BCP浓度。
[1]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.241~336.
[2]韩正康,陈杰.反刍动物瘤胃的消化和代谢 [M].北京:科学出版社,1988.84~94.
[3]姜艳美,王加启,邓露芳,等.酵母培养物对瘤胃发酵的影响[J].动物营养学报,2008,20(1):92 ~ 97.
[4]姜旭明,齐智利,齐德生,等.不同蛋白质来源的日粮对瘤胃发酵特性及蛋白质消化的影响[J].草业科学,2009,26(1):74 ~ 80.
[5]刘大程.不同品质粗饲料日粮及添加酵母培养物对绵羊瘤胃发酵及纤维素分解菌的影响:[博士学位论文][D].呼和浩特:内蒙古农业大学,2007.
[6]刘敏雄.反刍动物消化生理学[M].北京:北京农业大学出版社,1991.113~127.
[7]王建平,王加启,卜登攀,等.高温条件下高产和中产奶牛产奶性能及瘤胃发酵的研究[J].动物营养学报,2010,22(1):51 ~ 56.
[8]王根林.养牛学学[M].北京:中国农业出版社,2006.227.
[9]Bouchard R,Conrad H R.Sulfur requirement of lactating dairy cows.I.Sulfur balance and dietary supplementation [J].J Dairy Sci,1973,56:1429 ~1438.
[10]Dehority B.Evaluation of subsampling and fixation procedures used for counting rumen protozoa [J].Applied and Environmental Microbiology,1984,48(1):182.
[11]Hristov A N,Hazen W,Ellsworth J W.Efficiency of use of imported magnesium,sulfur,copper,and zinc on idaho dairy farms[J].J Dairy Sci,2007,90:3034 ~ 3043.
[12]Kahlon J S,Meisk J C,Goodrich R D.Sulfur metabolism in ruminants.II.In vivo availability of various chemical forma of sulfur [J].J Animal Sci,1975,41:1154 ~ 1160.
[13]May M L,Quinn M J,Hales K E,et al.Effects of ionophores and antibiotics on in vitro hydrogen sulfide production,dry matter disappearance,and total gas production in cultures with a steam-flaked corn-based substrate with or without added sulfur[J].J Animal Sci,2009,87:1705 ~ 1713.
[14]Qi K,Lu C D,Owens F N.Sulfate supplementation of growing goats:Effects on performance,acid-base balance and nutrient digestibilite [J].J Animal Sci,1993,71:1579 ~ 1 587.
[15]Scholljegerdes E J,Ludden P A,Hess B W.Site and extent of digestion and amino acid flow to the small intestine in beef cattle consuming limited amounts of forage[J].J Animal Sci,2004,82:1146 ~ 1156.
[16]Storm E,Ørskov E R.The nutritive value of rumen microorganisms in ruminant.1.Large-scale isolation and chemical composition of rumen microorganisms[J].J Nutr,1983,50:463 ~ 470.
[17]Zinn R A,Alvarez E,Mendez M,et al.Influence of dietary sulfur level on growth performance and digestive function in feedlot cattle[J].J Animal Sci,1997,75:1723 ~ 1728.

