胶束电动毛细管色谱法同时测定何首乌中二苯乙烯苷和5种蒽醌类化合物*
吴虹 王炎 温棚 娄文勇 宗敏华
(华南理工大学轻工与食品学院,广东广州510640)
中药何首乌为蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根.生品具解毒、消痈、润肠通便之功效,炮制品则有补肝肾、益精血、乌须发、强筋骨等作用[1].近年来的研究表明,何首乌在抗衰老、调血脂、提高免疫力等方面亦有独到之处[2-3].由于野生资源紧缺,人工栽培品日益增多,对不同采集地何首乌的质量评价已引起人们广泛的重视.何首乌主要含有 2,3,5,4'-四羟基二苯乙烯-2-O-β-D葡萄糖苷(二苯乙烯苷)和蒽醌类活性成分[4].中国药典(2010年版)何首乌质量标准中仅对二苯乙烯苷进行定量控制,而何首乌的许多药理活性却与其含有的蒽醌类成分密切相关.目前,已有多种分别检测何首乌中二苯乙烯苷和蒽醌类成分的方法,如分光光度法[5]、薄层色谱法[6]、高效液相色谱法[1,7-8]和高效毛细管电泳法[9-11]等.但同时分离检测何首乌中二苯乙烯苷和蒽醌类成分的研究甚少[4,12-14],且采用的方法多是高效液相色谱法.迄今,有关同时分离检测何首乌中二苯乙烯苷和5种蒽醌类成分(大黄素、芦荟大黄素、大黄酸、大黄酚和大黄素甲醚)的毛细管电泳方法鲜见报道.对何首乌有效活性成分进行同时分离检测后,可以对其质量进行更科学、全面的评价.
毛细管电泳是20世纪80年代以来兴起的一种新的分离分析技术,具有分辨率高、分析时间短、溶剂和样品消耗量少、样品预处理简单、可同时分离测定多组分样品等优点,在药物分析中的应用日益广泛.二苯乙烯苷分子极性较强,易溶于水,而蒽醌类化合物极性较小,难溶于水.通过在运行缓冲液中加入浓度大于临界胶束浓度(CMC)的表面活性剂,胶束电动毛细管色谱法可以分离极性不同的中性物质,因此,文中旨在建立一种同时测定何首乌中二苯乙烯苷和5种蒽醌类化合物的胶束电动毛细管色谱法,为何首乌的质量控制提供新的分析手段.
1 材料与方法
1.1 仪器与试剂
P/ACETMMDQ毛细管电泳仪,配有二极管阵列检测器,美国Beckman公司生产,仪器控制、实验数据采集及处理采用仪器自带的32 Karat 7.0软件;未涂层熔融石英毛细管柱,57.0cm ×75.0 μm i.d.,有效长度为50.0cm,购自河北永年锐沣色谱器件有限公司;CP-225D电子天平和PB-10精密pH计,德国Sartorius公司生产.二苯乙烯苷、大黄素、芦荟大黄素、大黄酸、大黄酚、大黄素甲醚对照品购自中国药品生物制品检定所;产地为广东德庆的制何首乌样品由广东药学院严寒静赠送并鉴定;十二烷基硫酸钠(SDS),购自Alfa Aesar公司;其余试剂均为分析纯;水为双蒸水.
1.2 缓冲液、对照品和样品溶液的制备
分别配制浓度均为100 mmol/L的硼砂和SDS储备液,各取适量配成不同浓度、不同pH值的硼砂-SDS-甲醇混合运行缓冲液.
分别精确称取二苯乙烯苷、大黄素、芦荟大黄素、大黄酸、大黄酚和大黄素甲醚对照品4.00mg,用甲醇溶解并定容至10mL,得到质量浓度均为400mg/L的对照品储备液,于4℃冰箱中保存.
准确称取产地为广东德庆的制何首乌样品粉末(过100目筛)200.0mg,加入50mL甲醇,超声处理15min后过滤.残渣分别用10 mL甲醇洗涤2次,合并滤液减压蒸馏除去溶剂后,用少量甲醇溶解提取物,然后定容至10mL.
1.3 实验方法
新毛细管在使用前进行如下预处理:依次分别用甲醇冲洗10 min,蒸馏水冲洗2 min,0.1 mol/L盐酸冲洗10 min,蒸馏水冲洗2 min,0.1 mol/L氢氧化钠溶液冲洗10min,蒸馏水冲洗2min.每次操作之前,毛细管依次分别用0.1mol/L盐酸、蒸馏水、0.1mol/L氢氧化钠、蒸馏水和缓冲液各冲洗5 min;连续检测时,每次进样前毛细管用缓冲液冲洗2min.
采用压力进样方式,进样压力为0.5 PSI、时间为10s,检测波长为254 nm,实验在恒温(25℃)、恒湿(相对湿度为60%)的条件下进行.
2 结果与讨论
2.1 影响分离效果的因素分析
2.1.1 缓冲液的pH值对分离效果的影响
缓冲液的pH值不仅影响分析物的存在形式和状态,而且影响电渗流的大小.因此,通过选择合适pH值的电泳缓冲液来调节电渗流及被分析物的荷电状态,可改善分离度,使待测物得以有效分离.二苯乙烯苷和5种蒽醌类成分分子中都含有酚羟基,呈弱酸性,因此,采用较高pH值的缓冲液对分离有利.实验考察了运行缓冲液的pH值由8.8变化至10.4时对分离效果的影响,结果见图1.可以看出,当缓冲液的pH值从8.8上升到9.6时,分离度随pH值的增加而改善,在pH值为9.6时分离效果最好;当缓冲液的pH值大于9.6时,迁移时间明显延长,且大黄酸和大黄酚不能完全分离.因此适宜的缓冲液pH值为9.6.
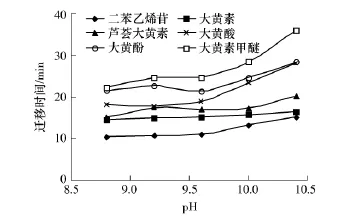
图1 缓冲液的pH值对二苯乙烯苷和5种蒽醌类化合物分离效果的影响Fig.1 Effect of of buffer solution pH value on separation of stilbene glucoside and five anthraquinones
2.1.2 缓冲液的SDS浓度对分离效果的影响
在胶束电动毛细管色谱(MECC)中,表面活性剂可影响待测组分在缓冲液中的分配特性和有效迁移率.缓冲液的SDS浓度对分离效果的影响如图2所示,在所考察的SDS浓度(10~50 mmol/L)下,各组分的迁移时间均随SDS浓度的增大而延长.当SDS浓度低于20 mmol/L时,大黄素和芦荟大黄素不能完全分离;当SDS浓度为30 mmol/L时,大黄素和芦荟大黄素的分离效果最佳;当SDS浓度超过30mmol/L后,迁移时间明显延长.综合考虑,选择适宜的SDS浓度为30mmol/L.
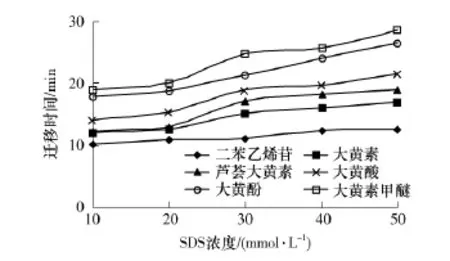
图2 SDS浓度对二苯乙烯苷和5种蒽醌类化合物分离效果的影响Fig.2 Effect of SDS concentration on separation of stilbene glucoside and five anthraquinones
2.1.3 缓冲液的硼砂浓度对分离效果的影响
硼砂浓度直接影响各组分的淌度,硼酸离子浓度增大时,有利于其与蒽醌类化合物形成配合物,提高分离效率.缓冲液的硼砂浓度对分离效果的影响如图3所示,各组分的迁移时间随硼砂浓度的增大而延长.当硼砂浓度低于15mmol/L时,大黄素和芦荟大黄素均不能很好地分离;当硼砂浓度大于15mmol/L时,各组分虽能很好地分离,但迁移时间大大延长;当硼砂浓度为15mmol/L时,各组分在最短的时间内得以有效分离,且峰形较理想.因此,为了提高分离效率,可认为适宜的缓冲液硼砂浓度为15mmol/L.
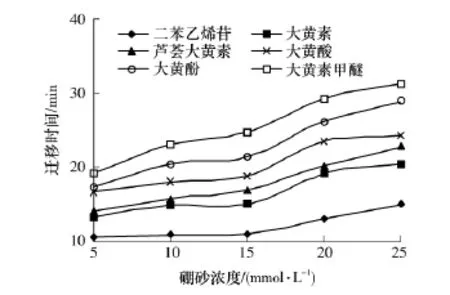
图3 硼砂浓度对二苯乙烯苷和5种蒽醌类化合物分离的影响Fig.3 Effect of Na2B4O7concentration on separation of stilbene glucoside and five anthraquinones
2.1.4 缓冲液的甲醇浓度对分离效果的影响
在MECC中,加入有机溶剂(如甲醇、乙腈、醋酸和二甲亚砜等)可以降低电渗流,增加分离有效距离,从而改善分离效果;但随着有机溶剂浓度的增加,待测物的表观电泳迁移速率逐渐减小.此外,有机溶剂还可以通过改变背景电解质的极性进而影响分离效果.缓冲液中甲醇浓度在0~20%(体积分数,下同)之间变化时对分离效果的影响如图4所示.当缓冲液不含甲醇时,大黄酚和大黄素甲醚的峰出现部分重叠;当甲醇浓度大于5%时,各组分均能很好地分离;当甲醇浓度大于15%后,各组分迁移时间显著增加,大黄素甲醚峰展宽,这可能是因为样品在毛细管内的迁移时间太长而发生了吸附或对流.综合考虑分离度和分离效率,选择适宜的甲醇浓度为10%.
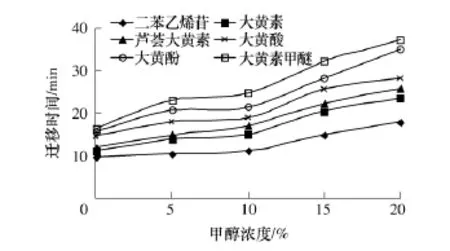
图4 甲醇浓度对二苯乙烯苷和5种蒽醌类化合物分离的影响Fig.4 Effect of methanol concentration on separation of stilbene glucoside and five anthraquinones
2.1.5 分离电压对分离效果的影响
毛细管长度固定后,分离电压决定了电场强度,对分离柱效、分离度和迁移时间产生影响[15].提高分离电压可以缩短分离时间,但在高电压下产生大量的焦耳热也会影响分离效果.文中考察了分离电压为15~25kV时对分离效果的影响.结果表明,各组分在所考察的分离电压下均分离良好,迁移时间随分离电压的增大而明显缩短.这可能是由于使用了甲醇作为添加剂,产生的焦耳热较低,即使在25kV下分析物也没有出现扩散现象.因此,选择25kV作为分离电压.
综上所述,适宜的分离检测条件为:运行缓冲液由15mmol/L硼砂、30mmol/L SDS、10%甲醇组成,pH值为9.6,分离电压为25kV.在此条件下,对含有6种对照品的混合液(各种对照品的质量浓度均为50mg/L)进样分析,二苯乙烯苷和5种蒽醌类化合物在18min内得以完全基线分离,毛细管电泳谱图见图5.
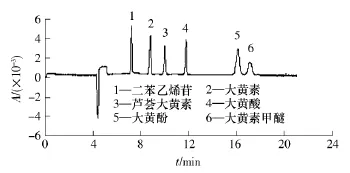
图5 最佳毛细管电泳条件下二苯乙烯苷和5种蒽醌类化合物的电泳谱图Fig.5 Electrogram of stilbene glucoside and five anthraquinones under the optimum capillary electrophoresis conditions
2.2 线性范围、检出限和重现性
在最佳分离检测条件下,分别以质量浓度均为50mg/L的二苯乙烯苷、大黄素、芦荟大黄素、大黄酸、大黄酚和大黄素甲醚对照品溶液重复进样6次,其迁移时间的相对标准偏差(RSD)分别为1.06%、1.31%、1.61%、1.51%、1.35%和 1.15%,峰面积的RSD分别为1.46%、1.69%、1.94%、2.01%、2.87%和2.53%.精密配制一系列不同质量浓度的二苯乙烯苷、大黄素、芦荟大黄素、大黄酸、大黄酚、大黄素甲醚对照品溶液和空白溶液,以最佳实验条件分别进样,以分析物的质量浓度为横坐标,净峰面积(待测组分峰面积减去空白溶液峰面积)为纵坐标,考察文中方法的线性关系和检出限(S/N=3),结果见表1.
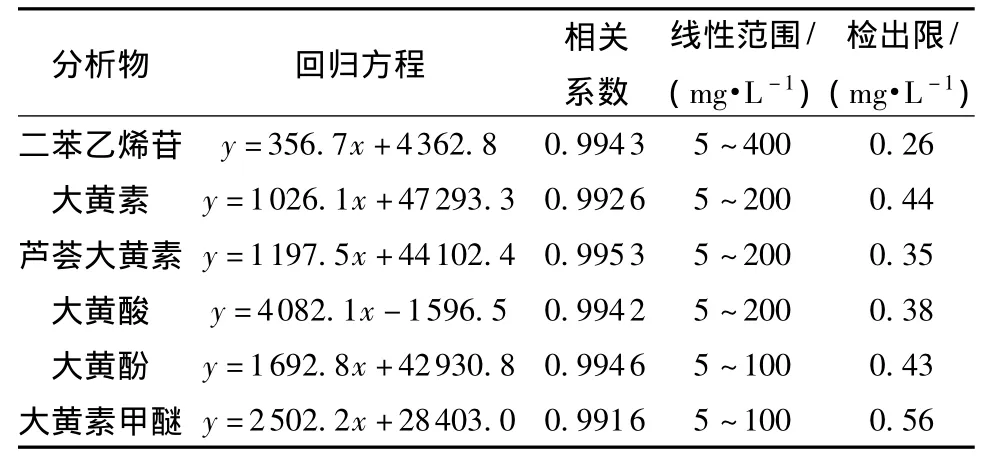
表1 二苯乙烯苷和5种蒽醌类化合物的线性回归方程、线性相关系数、线性范围和检出限(S/N=3)Table 1 Linear regression equations,linear correlation coefficients,linear ranges and detection limits(S/N=3)of stilbene glucoside and five anthraquinones
2.3 样品分析及回收率
在最佳分离条件下测定何首乌样品提取液中所含的活性成分,结果见表2.为检验该方法的可靠性,文中还进行了加标回收率实验.首先准确称取产地为广东德庆的制何首乌样品粉末(过100目筛)200mg,然后加入一定量的质量浓度为400 mg/L的各种对照品溶液,按照1.2节的方法提取活性成分并进行测定,毛细管电泳谱图见图6,各成分分析结果见表2,二苯乙烯苷和5种蒽醌类化合物的回收率为97.2% ~103.2%.
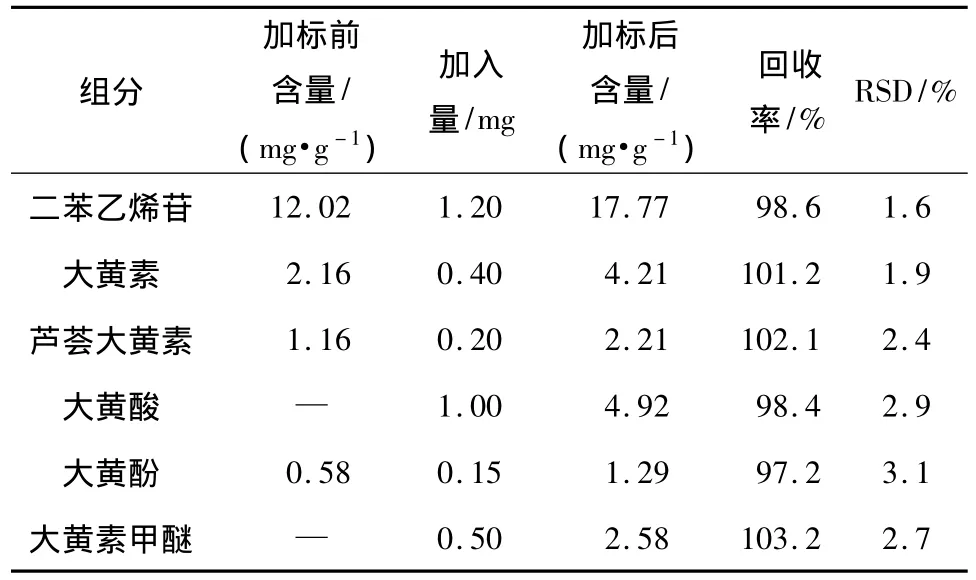
表2 样品的成分分析结果及回收率Table 2 Component analysis results of sample and recoveries
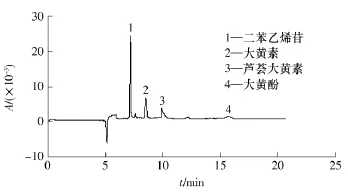
图6 何首乌样品中二苯乙烯苷和5种蒽醌类化合物的电泳谱图Fig.6 Electrogram of stilbene glucoside and five anthraquinones in Polygonum multiflorum Thunb.sample
目前,已有利用高效液相色谱法同时测定何首乌中二苯乙烯苷和5种游离蒽醌类化合物(大黄素、芦荟大黄素、大黄酸、大黄酚和大黄素甲醚)的报道[13],与其20min的测定时间相比,文中建立的胶束电动毛细管色谱法缩短了测定时间,仅需18min,并明显降低了溶剂消耗量.
3 结语
文中建立的胶束电动毛细管色谱法可同时分离检测何首乌中的二苯乙烯苷和5种游离蒽醌类化合物(大黄素、芦荟大黄素、大黄酸、大黄酚和大黄素甲醚).在优化的电泳条件下,二苯乙烯苷和5种蒽醌类化合物在18 min内完全基线分离,检出限为0.26~0.56mg/L,回收率为97.2% ~103.2%.该方法检测精度高、稳定性好、重复性高,而且简单、快速、检测成本低,适用于何首乌药材中二苯乙烯苷和蒽醌类活性成分的测定,可为何首乌的质量控制提供参考.
[1]郭青,鲁静.高效液相色谱法测定何首乌及其炮制品中蒽醌类成分的含量[J].药物分析杂志,2000,20(5):326-328.Guo Qing,Lu Jing.HPLC determination of anthraquinone in Radix polygoni multiflori and Radix polygoni multiflori preparata[J].Chinese Journal of Pharmaceutical Analysis,2000,20(5):326-328.
[2]谭凯丽,廖海民.何首乌的药理作用研究进展[J].山地农业生物学报,2010,29(1):72-75.Tan Kai-li,Liao Hai-min.The advances in pharmacological effects in Polygonum multiflorum [J].Journal of Mountain Agriculture and Biology,2010,29(1):72-75.
[3]韩晓,吴成爱,王伟,等.何首乌二苯乙烯苷降血脂作用机理研究[J].中华中医药学刊,2008,26(8):1687-1689.Han Xiao,Wu Cheng-ai,Wang Wei,et al.Mechanism research of stilbene glucoside from Polygonum multiflorum Thunb on hyperlipemia[J].Chinese Archives of Traditional Chinese Medicine,2008,26(8):1687-1689.
[4]Zhang F,Chen W S,Sun L N.LC-VWD-MS determination of three anthraquinones and one stilbene in the quality control of crude and prepared roots of Polygonum multiflorum Thunb [J].Chromatographia,2008,67(11/12):869-874.
[5]王玉霞,刘斌,石任兵,等.何首乌二苯乙烯部位质量控制方法研究[J].中华中医药杂志,2009,24(10):1277-1280.Wang Yu-xia,Liu Bin,Shi Ren-bing,et al.Research on quality control method of stilbene fraction of Polygonum multiflorum Thunb [J].China Journal of Traditional Chinese Medicine and Pharmacy,2009,24(10):1277-1280.
[6]张雪.薄层色谱法检测何首乌中的活性成分[J].食品工业科技,2008,29(9):271-272.Zhang Xue.Analysis of emodin in Polygonum mutiflorum Thunb by TLCS [J].Science and Technology of Food Industry,2008,29(9):271-272.
[7]粟力杰.HPLC法测定何首乌中二苯乙烯苷的含量[J].中国当代医药,2010,17(18):41-42.Su Li-jie.HPLC determination of stilbene glucoside in Polygonum multiflorum content determination of content of 2,3,5,4'-tetrahydroxystilbene-O-β-D-glucoside in Radix polygoni multiflori[J].China Modern Medicine,2010,17(18):41-42.
[8]刘燕,晁若冰.HPLC同时测定不同何首乌中的两种蒽醌类成分[J].华西药学杂志,2009,24(3):285-287.Liu Yan,Chao Ruo-bing.Determination of two anthraquinones in different Polygonum multiflorums by HPLC[J].West China Journal of Pharmaceutical Sciences,2009,24(3):285-287.
[9]袁海龙,贺承山,肖小河,等.高效毛细管电泳法测定何首乌中二苯乙烯苷的含量[J].解放军药学学报,2000,16(3):151-154.Yuan Hai-long,He Cheng-shan,Xiao Xiao-he,et al.Determination of stilbene in Polygonum multiflorum Thunb by capillary electrophoresis[J].Pharmaceutical Journal of Chinese People’s Liberation Army,2000,16(3):151-154.
[10]Tian K,Zhang H G,Chen X G,et al.Determination of five anthraquinones in medicinal plants by capillary zone electrophoresis with beta-cyclodextrin addition[J].Journal of Chromatography A,2006,1123:134-137.
[11]李伟,柴金玲,阿里木江·艾拜都拉,等.区带毛细管电泳分离测定大黄提取液中游离蒽醌化合物[J].分析科学学报,2006,22(1):68-70.Li Wei,Chai Jin-ling,Alimjan Abaydulla,et al.Separation and determination of anthraquinone compounds in Chinese herb Rhubarb extracts by capillary zone electrophoresis[J].Journal of Analytical Science,2006,22(1):68-70.
[12]陈晓颖,严寒静,傅军.薄层色谱法评价不同产地何首乌的品质[J].时珍国医国药,2007,18(8):1934-1935.Chen Xiao-ying,Yan Han-jing,Fu Jun.Quality evaluation of Radix polygoni multiflori from different areas by TLC-fingerprint [J].Lishizhen Medicine and Materia Medica Research,2007,18(8):1934-1935.
[13]朱培芳,赵荣华,施扬宪.HPLC法同时测定何首乌中二苯乙烯苷和5种蒽醌类化合物的方法[J].中华中医药杂志,2012,27(2):463-465.Zhu Pei-fang,Zhao Rong-hua,Shi Yang-xian.Determination of stilbeneglycoside and 5 kinds of anthraquinone in Polygonum multiflorum Thunb by HPLC stimultaneously[J].China Journal of Traditional Chinese Medicine and Pharmacy,2012,27(2):463-465.
[14]吴娴,陈冠华,王坤,等.胶束电动毛细管色谱法测定何首乌中的二苯乙烯苷、大黄素和大黄酚[J].河北科技大学学报,2011,32(5):426-430.Wu Xian,Chen Guan-hua,Wang Kun,et al.Determination of stilbene glycoside,emodin and chrysophanol in Radix polygoni muliflori by micellar electrokinetic capillary chromatography[J].Journal of Hebei University of Science and Technology,2011,32(5):426-430.
[15]杨桂娣,郑进平,黄红霞,等.毛细管电泳紫外吸收法分离检测海洋生物样品中不同形态的砷化合物[J].分析化学,2009,37(4):532-536.Yang Gui-di,Zheng Jin-ping,Huang Hong-xia,et al.Speciation analysis of arsenic in sea foods with capillary electrophoresis-ultraviolet detection[J].Chinese Journal of Analytical Chemistry,2009,37(4):532-536.

