扇脉杓兰AFLP反应体系的建立
李全健 ,王彩霞 ,田 敏 ,李翠新
(1.西南林业大学,云南 昆明 650224;2.中国林业科学研究院亚热带林业研究所,浙江 富阳 311400)
扇脉杓兰(Cypripedium japonicum Thunb.)属兰科(Orchidaceae)杓兰属(Cypripedium Linn.),生于海拔1 000~2 000 m的灌木林下、林缘、荫蔽山坡等湿润和腐殖质丰富的土壤上[1]。目前对于扇脉杓兰的研究主要集中在传粉生态学[2]方面,有关扇脉杓兰分子生物学相关的研究尚未见报道。
扩增片段长度多态性(amplified fragment length polymorphism,AFLP)是限制性片断长度多态性(RFLP)技术和聚合酶链式反应(PCR)技术的结合[3],是一种理想的分子标记技术。已经在杜仲[4]、苹果[5]、葡萄[6]等多种植物[7-8]上建立了AFLP体系,并对菊花[9]、红花[10]等多种植物进行了遗传多样性研究。尽管AFLP标记技术应用广泛,但是其操作复杂,操作中的影响因素较多。建立扇脉杓兰AFLP体系,对进一步研究其种质资源多样性和分子标记辅助育种有重要意义。
1 材料与方法
1.1 材料
试验材料为野生扇脉杓兰嫩叶,取材后立即放入冰盒中带回实验室,保存在-80℃冰箱中。
1.2 方法
SDS 法[11]、高盐低 pH 法[12]、常规 CTAB 法[11]、高盐CTAB法(将常规CTAB法提取缓冲液中的Na-Cl的浓度由 1.4mol/L增至 2.0mol/L,其它和常规CTAB法相同)和改良CTAB法。
试验步骤:将材料研磨成粉末后,取约50 mg的冻粉于离心管中再加入CTAB(50mmol/L Tris-HCl、10 mmol/L EDTA、0.7 mol/L NaCl)200 μL 和10μLβ-巯基乙醇,充分混匀后加入800μL 65℃预热的CTAB和10μL蛋白酶K,颠倒数次,65℃恒温水浴 60 min,10 min/次摇匀;取出冷却后加入800 μL 酚∶氯仿∶异戊醇(体积比为 25∶24∶1),颠倒混匀 2 min,静置 5 min后12 000 r/min离心 15 min;取上清液,加等体积的氯仿∶异戊醇(体积比为24∶1)颠倒 2 min,静置5min后12 000 r/min离心 15 min;取上清液,加1/10体积5mol/L的醋酸钠和等体积的异丙醇,沉淀15 min。8 000 r/min离心10 min,去上清;70%乙醇洗涤两次,风干后溶于400 μL去离子水;加入10μL RNase,37℃消化 1 h,65℃水浴20min,稍冷却加入等体积的氯仿∶异戊醇(24∶1),混匀后 12 000 r/min 离心 15 min;取上清液,加入1/10体积5mol/L的醋酸钠和两倍体积-20℃无水乙醇,-20℃ 沉淀 20 min;8 000 r/min 离心10min;70% 乙醇洗涤两次(10min/次),风干后加40μL去离子水,置-20℃冰箱保存备用。
1.3 DNA纯度及浓度检测
取 5μL DNA 样品,加 1 μL 6×Loading buffer,在1.0%的琼脂糖凝胶电泳;用紫外分光光度计检测总DNA在260 nm和280 nm处的吸光值。根据电泳谱带和A260/A280值判断DNA的纯度,根据公式:DNA 浓度(μgmL-1)=A260×50 μg/mL×稀释倍数,计算总DNA的浓度。
1.4 限制性内切酶酶切分析
1.4.1 酶切体系 酶切反应体系为20μL,各组份为:模板 DNA 1μg,10×NEB 缓冲液 2.0 μL,EcoRⅠ(10 U/L)0.5 μL,MseⅠ(10 U/L)0.5 μL,BSA 0.2 μL,加双蒸水至20μL。为了获得扇脉杓兰DNA酶切的最佳反应时间,酶切时间分别设为 1、2、3、4、5 h。酶切消化后,65℃ 灭活20min。1.5%琼脂糖凝胶电泳检测酶切效果。
1.4.2 连接体系 在20μL反应体系中加入10 μL酶切产物,T4 DNA连接酶反应缓冲液2.0μL,MseⅠ接头 1.0μL,EcoRⅠ接头 1.0 μL,T4 DNA连接酶(400 U/L)1.0 μL,灭菌双蒸水5 μL。16℃连接反应90min,连接反应结束后,65℃灭活20min。
1.4.3 扩增体系 初始扩增体系参照相关研究论文和常规的PCR反应中各组分的量,确定扇脉杓兰AFLP初始反应体系为:反应总体积50μL,内含0.25 μL Ex Taq,5.0 μL 10×Ex Taq buffer,4.0 μL dNTPMixture,4μLMg2+,模板 DNA 2.5 ng,M00 和E00各2.0μL,加灭菌蒸馏水至 50μL。对AFLP反应体系中的5种反应成分分别进行单因素试验(见表1),确定合适反应条件。

表1 PCR反应体系中处理因素和水平
预扩增程序为95℃预变性5 min;然后进行30个循环:95℃变性 30 s,56℃复性 30 s,72℃ 延伸 60 s;循环后 72℃延伸 10min;10℃保存。
选择性扩增程序为:94℃ 5 min;94℃变性30 s,65℃复性 30 s,72℃延伸 70 s;65~56℃ (每个循环降0.7℃)退火30 s,72℃延伸70 s,共13个循环;94℃变性 30 s,56℃退火 30 s,72℃延伸 70 s,共 24个循环;72℃延伸10min,10℃ 保存。
1.4.4 聚丙烯酰胺凝胶电泳 取6μL(含上样缓冲液)样品,6%聚丙烯酰胺凝胶电泳2 h(80W 恒功率)。电泳结束后,银染、拍照,从中选择谱带清晰和容易计数的引物作为AFLP反应的最佳引物。
2 结果与分析
2.1 电泳检测结果
图1所示为改良CTAB法提取基因组DNA 1%琼脂糖凝胶电泳电泳图,DNA电泳条带清晰无拖尾,点样孔无污染,DNA无降解,大小在23 000 bp左右。
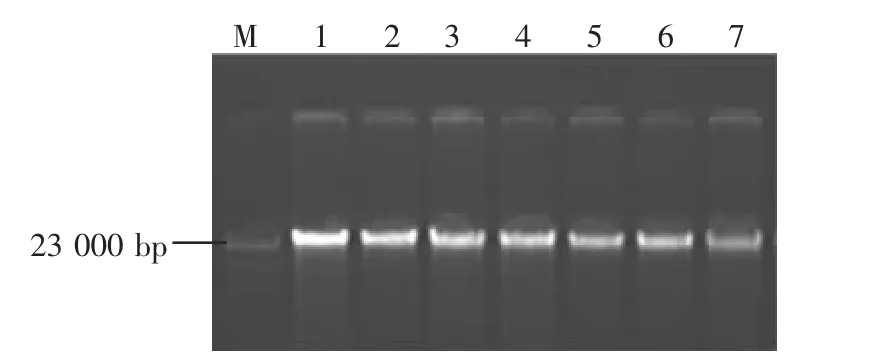
图1 改良CTAB法提取的基因组DNA琼脂糖电泳图
2.2 紫外检测结果
由表2所示:5种提取方法在去除蛋白质、多糖及酚类等污染物方面存在差异。改良CTAB法得到的DNA A260/A280在1.8~2.0之间,说明污染物去除较为完全,DNA纯度高。如果A260/A280<1.8,说明DNA被蛋白质或多糖污染。A260/A280>2.0,说明RNA未去除干净。
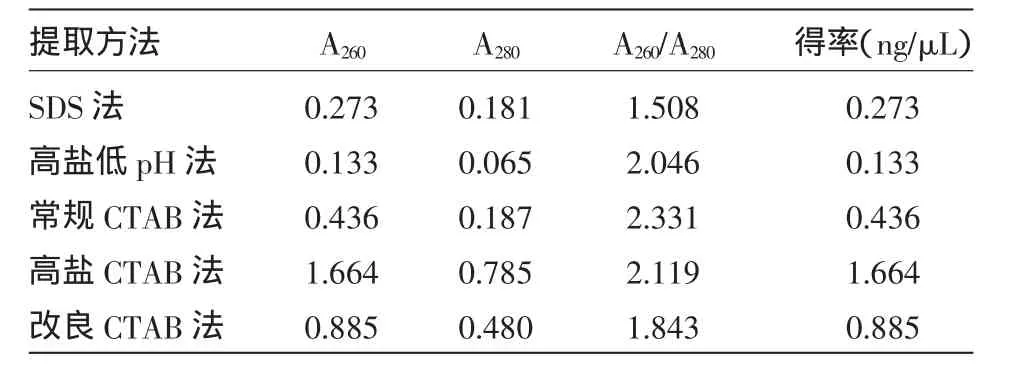
表2 不同方法提取总DNA结果的比较
2.3 限制性内切酶酶切结果
AFLP分析中基因组 DNA常采用双酶切,通常一个为稀有碱基切点酶,另一个为常见碱基切点酶。根据图2可知,酶切产物电泳均匀,无主条带,主要分布在100~1 000 bp之间,说明酶切消化良好,可以用于分子标记。
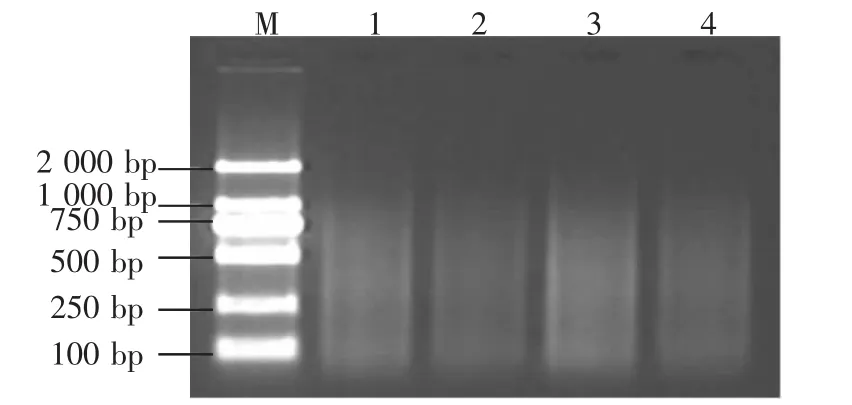
图2 酶切效果
2.4 AFLP选择性扩增反应体系的优化结果
2.4.1 预扩增产物的稀释倍数对扩增结果的影响由图3可知,在设定的6个稀释倍数范围内均能扩增出清晰谱带,然而,浓度较大时(稀释5~20倍),小片段的谱带较清晰,当浓度较小时(稀释40~80倍),大片段的谱带清晰可见,而小片段的谱带变弱。因此选定产物稀释20倍为模板DNA。
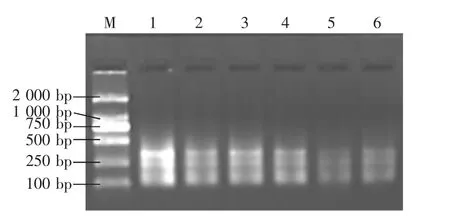
图3 预扩增产物稀释倍数对选择性扩增的影响
2.4.2 dNTP用量对扩增的影响 由图 4可知dNTP使用量对扩增的影响较大。当dNTP的用量为3.0~4.0μL时扩增条带均清晰稳定,扩增的产物浓度较高;用量少于2.0μL时扩增条带较弱,而用量多于4.0μL(4.0~10μL)时扩增产物变化不大,而且扩增条带减少且不清晰。说明dNTP浓度太低或太高都会使扩增产物减少,影响扩增效果。因此选择3.0~4.0μL为dNTP的适宜用量。
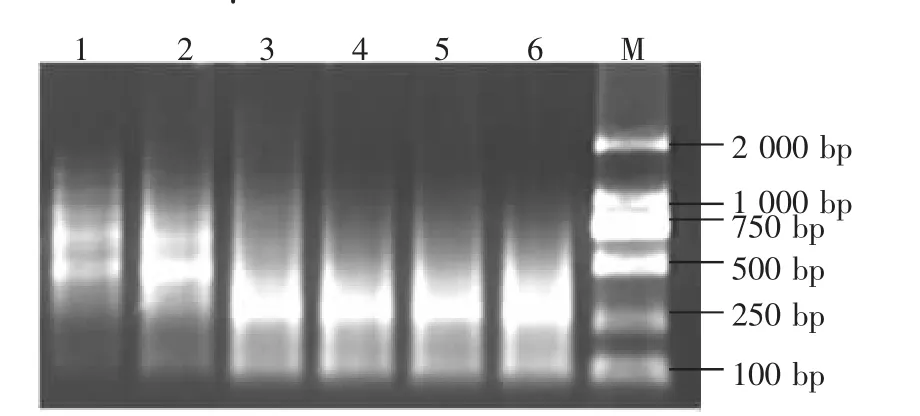
图4 dNTP浓度对选择性扩增的影响
2.4.3 Mg2+用量对扩增的影响 图5显示不同Mg2+使用量条件下的PCR扩增结果。结果显示,2.0 μL的Mg2+用量太低,影响了DNA聚合酶的活性,基本上没有产物或者产物的量较少;用量为3.0~10 μL下扩增条带均清晰稳定,考虑到Mg2+用量过大时容易出现非特异性条带,因此,选择3.0~4.0μL作为Mg2+最优使用量。
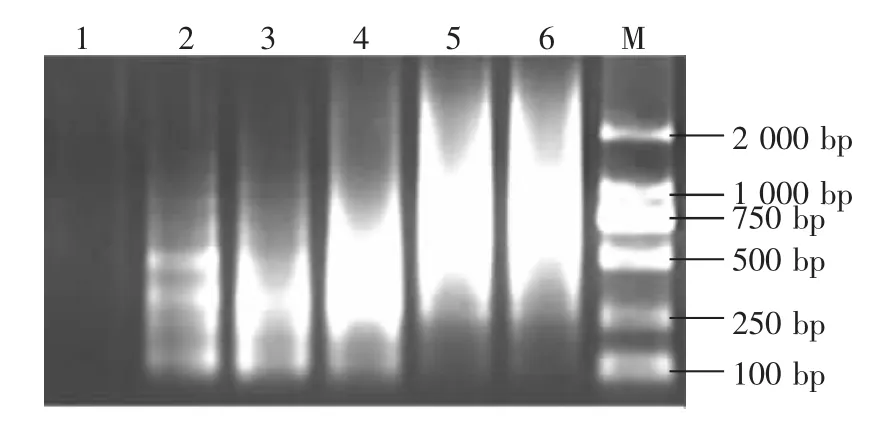
图5 Mg2+浓度对选择性扩增的影响

图6 引物用量对选择性扩增结果的影响
2.4.4 引物用量对扩增的影响 引物使用量对扩增的影响较为显著。由图6可见,引物用量为1.5~2.0μL时扩增谱带较为清晰,少于1.5μL时谱带变弱甚至无扩增产物,而用量大于2.0μL(4~6μL)时,谱带出现特异性条带,且位点发生变异,可能是引物浓度过高产生的错配现象。因此,选择1.5~2.0 μL为引物的最佳使用量。
2.4.5 Taq DNA聚合酶用量对扩增的影响 图7表明,随着Taq DNA聚合酶用量的增加,谱带也越来越明亮,Taq聚合酶的用量少时(0.1μL),扩增条带亮度小,说明产物浓度小;但使用量在0.2~0.6 μL的范围内谱带明亮,扩增产物浓度较高,之间亮度在增加但差异不明显。在节省又不影响试验结果的前提下,选取用量0.2~0.3μL可达到试验要求。
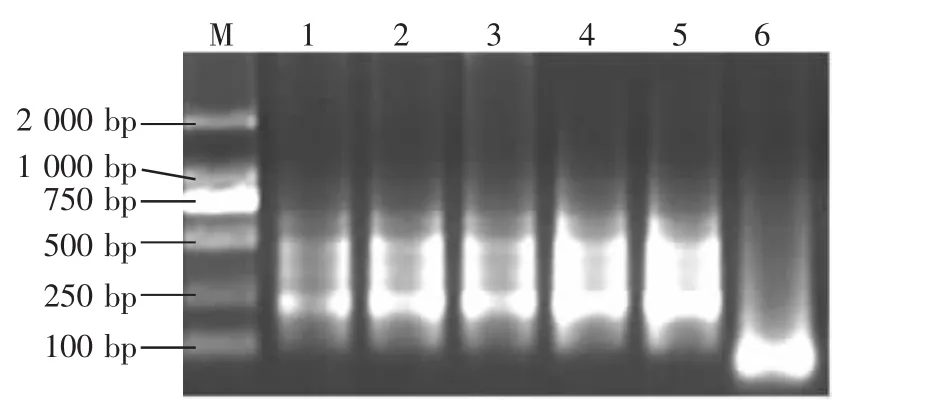
图7 Taq DNA聚合酶用量对选择性扩增的影响
2.5 AFLP反应体系稳定性的鉴定
图8为24对引物对优化体系的验证,引物编码记为 E11/M1,E11/M2,E11/M12 和 E12/M1,E12/M2……E12/M12。体系各组分的最佳用量为预扩增产物稀释20倍液4.0μL,dNTP 3.0μL,引物1.5 μL,Taq DNA 聚合酶 0.3 μL,Mg2+4.0 μL,每对引物一个重复,以鉴定扇脉杓兰AFLP反应体系的稳定性。结果如图8所示,24对引物在2个DNA中均能扩增出清晰可辨的谱带,经反复试验表明,利用优化后的反应体系能有效地对扇脉杓兰7个不同群体DNA进行AFLP扩增,而且具有较好的稳定性和可重复性,可以推断,优化后的AFLP反应体系是稳定可靠的。

图8 不同引物选择性扩增电泳图
3 讨 论
植物组织中的多糖、酚、酯和萜等次生代谢物质会对DNA的提取造成较大的困难,样品不纯,会影响后续酶解和PCR反应,研究发现扇脉杓兰叶片中多糖、蛋白质、酚类化合物、等次生代谢产物的含量较高。在提取过程中加入β-巯基乙醇,能够与多酚物质竞争可防止叶片中的多酚物质氧化而使DNA呈褐色。高浓度醋酸钠的引入及相应的低温冰冻,可以提高扇脉杓兰基因组DNA的纯度和得率,建议在提取扇脉杓兰次生代谢物质含量高的植物基因组DNA时采用。
AFLP反应是先进行酶切消化,再对连接产物进行选择性扩增。酶切时间过短,则消化不完全,接头难以连接;时间过长,不仅会延长整个试验周期,而且容易出现星号活性。酶切与连接的时间应控制适当,以确保酶切消化完全和连接充分。预扩增产物的浓度对选择性扩增影响很大,模板浓度过高会引起非特异性扩增;稀释倍数过大,PCR产物过少,影响统计分析。并且体系各组分的多少都会对选择性扩增产生影响。只有对各因素的用量筛选后,才能建立具有较高稳定性的AFLP反应体系。
[1] 陈心启,吉占和,郎楷永,等.中国植物志(第十七卷)[M].北京:科学出版社,1999.42.
[2] 孙海琴.独花兰和扇脉杓兰的传粉生态学[D].中国科学院植物研究所,2005.54-75.
[3] Vos P,Hogers R,Bleeker M.AFLP:a new technique for DNA fingerprinting[J].Nucleic Acids Res,1995,23:4407-4414.
[4] 王大玮,李 煜,周 玮,等.杜仲AFLP反应体系的建立及优化[J].西北农林科技大学学报(自然科学版),2010,38(6):88-94.
[5] 祝 军,王 涛,赵玉军,等.应用AFLP分子标记鉴定苹果品种[J].园艺学报,2000,27(2):102-106.
[6] 鲍 露,徐昌杰,江文彬,等.葡萄AFLP技术体系建立及其在超藤与藤稔葡萄品种鉴别中的应用[J].果树学报,2005,22(4):422-425.
[7] 李晓楠,狄晓艳,王孟本.椰子AFLP分子标记反应体系的建立[J].江西农业学报,2010,22(1):66-68.
[8] 李晓楠,狄晓艳,王孟本.华北落叶松AFLP反应体系的建立和优化[J].安徽农业科学,2011,39(02):697-700.
[9] 韩 洁,胡 楠,李玉阁,等.菊花品种资源遗传多样性的AFLP 分析[J].园艺学报,2007,34(4):1041-1046.
[10] 张 磊,黄蓓蓓,开国银,等.中国红花遗传多样性的AFLP分子标记[J].药学学报,2006,41(1):91-96.
[11] 王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002.742-744.
[12] 邹喻苹,汪小全,雷一丁,等.几种濒危植物及其近缘类群总DNA 的提取与鉴定[J].植物学报,1994,36(7):528-533.

