叶酸对超早期断奶宫内发育迟缓仔猪肝脏结构和细胞凋亡相关基因表达的影响
姚 英 陈代文 刘静波 毛湘冰 毛 倩 余 冰
(四川农业大学动物营养研究所,动物抗病营养四川省重点实验室,雅安 625014)
作为多胎家畜,猪发生先天性宫内发育迟缓(intrauterine growth retardation,IUGR)的概率最大,养殖场的经济效益严重受损,因此是否能通过营养手段缓解该症状和促进IUGR个体正常生长对于养殖业的发展具有重要意义。肝脏作为机体最大的代谢器官之一,在养分代谢、生物合成和免疫防御等方面具有重要作用。IUGR发生时,细胞增殖较快的器官首先显著受损,从而保证脑等器官的发育及机体的存活[1]。肝脏等器官的养分供应减少、质量减轻、结构和功能受损[1-3]。研究发现IUGR会导致机体凋亡相关基因表达改变[4],并可通过改变基因甲基化程度影响基因的表达和机体的生理代谢[5]。促凋亡相关基因肿瘤蛋白53(p53)是细胞凋亡的关键调控因子,当它被激活可影响细胞周期停滞和诱导凋亡相关基因的表达,而其中B细胞淋巴瘤蛋白2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)是研究较多的 p53下游效应分子[6]。毛细血管扩张性共济失调症突变蛋白(ataxia telangiectasia mutated,ATM)和脱嘌呤嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease-1,APE-1)也可通过调节细胞周期关卡从而参与DNA损伤修复和细胞凋亡过程[7-8]。
叶酸作为重要的B族维生素,参与调控与蛋白质和DNA的合成、生物甲基化和基因表达等相关的一碳单位转运[9],在体内的代谢受到DNA甲基转移酶 1(DNA methyltransferase 1,DNMT-1)、亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)和甜菜碱高半胱氨酸甲基转移酶(betaine homocysteine methyltransferase,BHMT)等的影响。叶酸缺乏可导致细胞脱氧核苷酸库不平衡、凋亡相关基因Bcl-2、Bax和p53等的表达出现异常,最终引起细胞DNA损伤、增殖减少、凋亡率增加和生长抑制;而补充叶酸可逆转这些负面效应[10]。大鼠上的研究发现补充叶酸可增加肝细胞的再生能力,维持肝脏的正常形态和功能[11]。此外,叶酸可影响基因甲基化程度,从而改变基因的表达量[12]。生命早期机体的可塑性较强[13],且出生后早期营养对于机体全期生长较为关键[1],因此在这一阶段实施营养干预可能改变机体已有的发育程序化。超早期断奶后补充叶酸是否能在一定程度上缓解出生前环境对IUGR个体肝脏结构和功能的影响尚有待进一步的研究。因此,本试验以自然发生IUGR的公仔猪为模型,考察超早期断奶后补充不同水平的叶酸对仔猪肝脏结构和凋亡相关基因表达的影响,为IUGR仔猪的养殖提供理论依据,同时也为婴儿营养临床应用提供思路。
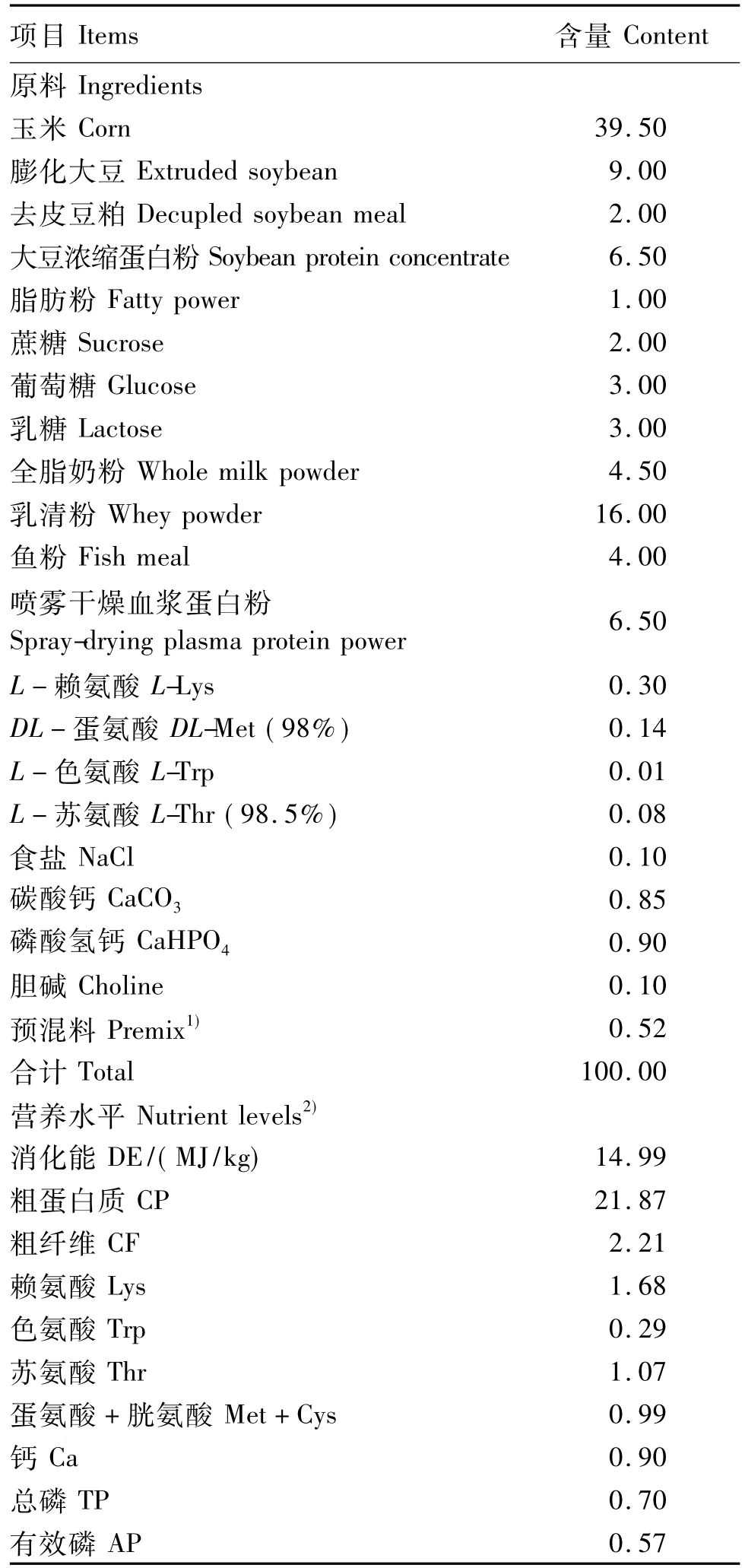
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1 材料与方法
1.1 试验设计
选取体况相近、产期接近的初产长白×约克夏母猪(配种采用同一头大白公猪精液)所产初生体重为0.9~1.1 kg的33头仔猪,体重低于该养殖厂仔猪平均出生体重的2倍标准差定义为IUGR。14日龄断奶时,选取其中24头平均体重为(2.79±0.34)kg的仔猪随机分为3个处理,分别饲喂基础饲粮中添加0、5和10 mg/kg叶酸的试验饲粮,每个处理8个重复,每个重复1头猪。试验期21 d。
1.2 试验饲粮
妊娠期和哺乳期母猪饲喂相同饲粮。断奶仔猪基础饲粮组成及营养水平见表1,饲粮营养水平参考美国NRC(1998)猪营养需要配制。在基础饲粮中分别添加0、5和10 mg/kg叶酸配制成试验饲粮。叶酸纯度≥98%,购于帝斯曼维生素(上海)有限公司。
1.3 饲养管理
仔猪14日龄断奶,单笼饲养,自由采食和饮水,饲喂量以采食后料槽略有余料为准。试验期第1~14天室内温度控制在25~28℃,第15~21天室内温度为23~26℃。试验第1天和结束后第1天08:00(空腹12 h以上)对试验猪进行称重。
1.4 样品收集与处理
1.4.1 血清样品制备
试验结束后第1天仔猪空腹称重后,前腔静脉采血10 mL,静置30 min后3 000 r/min离心10 min,分离血清,-20℃冰箱保存待测。
1.4.2 组织样品的采集
采血后仔猪进行麻醉,取出肝脏称湿重后取部分组织样品,用生理盐水冲洗干净后,迅速放入4%中性福尔马林固定液中固定,保存待制组织切片。另速取部分肝脏组织样品于液氮中速冻,并及时将样品放入-80℃中保存待测。
1.5 测定指标与方法
1.5.1 血清葡萄糖和甘油三酯
血清葡萄糖浓度采用葡萄糖氧化酶-4-氨基安替比林(GOD-PAP)法测定,血清甘油三酯浓度采用甘油磷酸氧化酶-过氧化物酶-4-氨基安替比林和酚(GPO-PAP)法测定,均使用全自动生化分析仪(日立7020,日本)进行,试剂盒购于四川迈克生物科技股份有限公司,具体操作按试剂盒说明书进行。
1.5.2 肝细胞和肝小叶直径
取置于4%中性福尔马林固定液中的肝脏组织,经脱水、浸蜡、包埋、切片等处理,再经苏木精-伊红染色(hematoxylin and eosin staining,HE染色),在显微成像系统(尼康D70s,日本)下进行观察(目镜10倍、物镜40倍),每个样本选择8~10个切片,每个切片选4~5个视野,测量肝细胞和肝小叶直径。
1.5.3 肝脏凋亡相关和叶酸代谢相关基因的表达量
实时定量PCR(real-time PCR)法测定肝脏Bcl-2、Bax、p53、ATM、APE-1、DNMT-1、BHMT、MTHFR的基因相对表达量。
肝脏组织总RNA提取按照试剂盒(Trizol Reagent,TaKaRa,日本)操作说明进行,提取的总RNA溶解于无RNA酶水(RNase Free dH2O,TaKaRa,日本)中。琼脂糖凝胶电泳检查RNA的完整性。核酸蛋白检测仪(Beckman Du-800,CA,美国)于260 nm检测RNA浓度。
cDNA合成采用逆转录试剂盒(PrimeScriptTMreagent kit,TaKaRa,日 本)。反 应 体 系 10 μL:2 μL 5 × PrimeScriptTMBuffer,0.5 μL Prime-ScriptTMRT Enzyme Mix,0.5 μL Oligo dT Primer,0.5 μL Random 6 mers,4.5 μL RNase Free dH2O,2 μL总RNA。反应参数:37℃ 15 min;85℃ 5 s。反应结束后-20℃保存备用。
用实时定量PCR仪(CFX-96 Real-Time PCR System,Bio-Rad,美国)进行测定,反应荧光染料为SYBR®GreenⅠ(TaKaRa,日本)。反应体系 为 10 μL:5 μL SYBR Premix Ex TaqTMⅡ(2 × ),1 μL上游引物,1 μL 下游引物,2 μL 双蒸水,1 μL cDNA模板。利用NCBI搜索目的基因片段,运用 Primer 5、Oligo 6.0进行引物设计,由大连宝生物公司合成,引物序列见表2。反应程序:95℃预变性10 s;95℃变性5 s,目的基因特异性退火温度(表2)条件下退火25 s,40个循环。用于检测基因扩增产物特异性的熔解曲线反应程序为:95℃ 10 s;65℃ 25 s;95℃ 0 s(温度变化速率为0.1℃/s)。表达量计算采用ΔΔCt和标准曲线扩增效率校正法,参照 Pfaffl等[14],标准曲线采用10倍梯度稀释法制作,每个样品3个重复,试验内参基因选用β-肌动蛋白。
1.6 数据处理和统计分析
所有数据采用SPSS 13.0进行单因素方差分析和Duncan氏法多重比较。结果以平均值±标准差表示,以P<0.05为差异显著标准,以 P<0.01为差异极显著标准。
2 结果
2.1 叶酸对仔猪血清葡萄糖和甘油三酯浓度的影响
由表3可知,添加叶酸对35日龄仔猪血清葡萄糖浓度无显著性影响(P>0.05),饲粮添加5和10 mg/kg叶酸血清葡萄糖浓度分别下降了5.38%和5.91%。血清甘油三酯受叶酸水平的影响较大,与0 mg/kg组相比,5和10 mg/kg组分别显著(P <0.05)和极显著(P <0.01)地降低。

表2 实时定量PCR引物序列及参数Table 2 Sequences and parameters of primers for the real-time PCR

表3 叶酸添加水平对35日龄仔猪血清葡萄糖和甘油三酯浓度的影响Table 3 Effects of folic acid supplemental level on concentrations of glucose and TG in serum of piglets at 35 days of age mmol/L
2.2 叶酸对仔猪肝脏结构的影响
由图1和表4可知,0 mg/kg组肝细胞直径最大;与0 mg/kg组相比,5 mg/kg组肝细胞直径显著减小(P<0.05);10 mg/kg组肝细胞直径与其余2组相比无显著性差异(P>0.05)。添加叶酸对肝小叶直径无显著性影响(P>0.05),但饲粮添加5和10 mg/kg叶酸使仔猪肝小叶直径分别下降了 5.78%和 7.57%。
2.3 叶酸对肝脏凋亡相关和叶酸代谢相关基因表达的影响
由表5可知,与0 mg/kg组相比,5 mg/kg组Bcl-2的基因表达量显著升高(P<0.05),Bax和p53的基因表达量极显著降低(P<0.01);10 mg/kg组Bcl-2的基因表达量与其他2组无显著差异(P>0.05),而Bax和p53的基因表达量分别极显著(P <0.01)和显著(P <0.05)地降低了,但与5 mg/kg组无显著差异(P>0.05)。
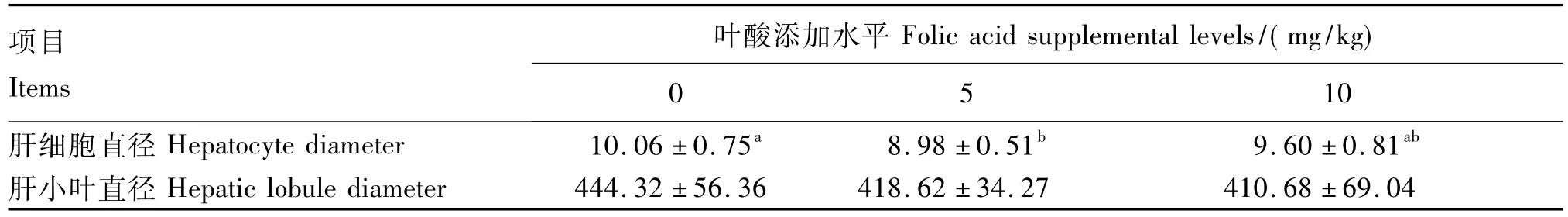
表4 叶酸添加水平对35日龄仔猪肝脏结构的影响Table 4 Effects of folic acid supplemental level on liver structure of piglets at 35 days of age μm
添加叶酸对ATM和APE-1的基因表达无显著影响(P >0.05);与0 mg/kg组相比,5 mg/kg组ATM和APE-1的基因表达量分别降低了11%和21%。叶酸和蛋氨酸循环的关键酶编码基因DNMT-1、BHMT和MTHFR的表达量未受饲粮叶酸水平的显著影响(P>0.05)。
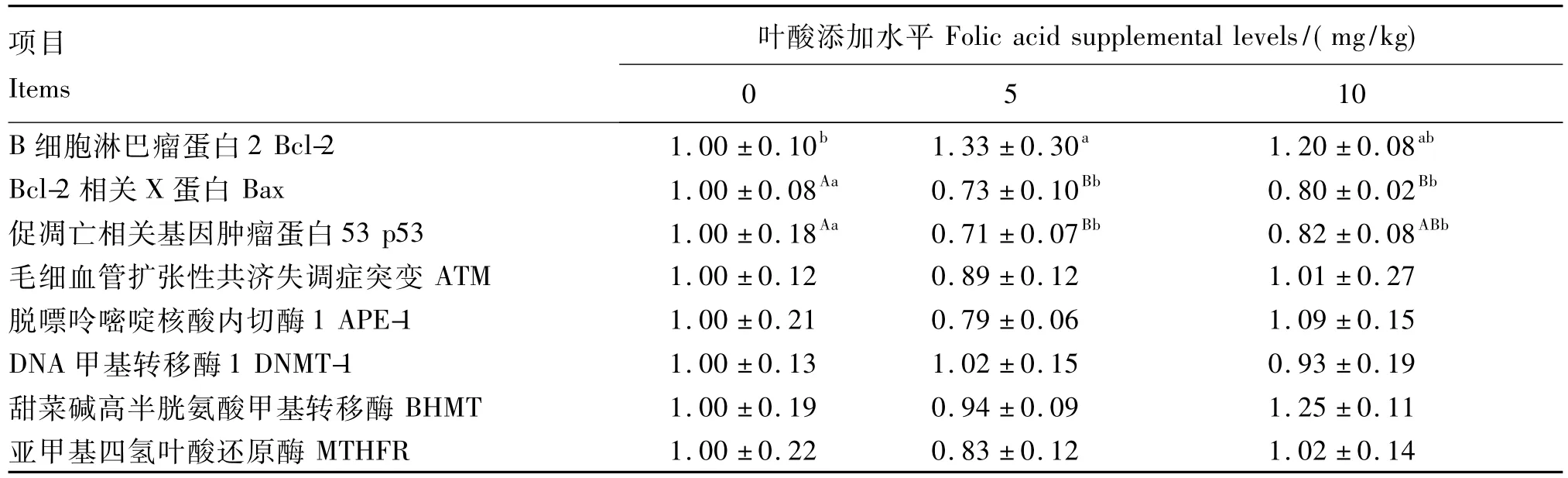
表5 叶酸添加水平对35日龄仔猪肝脏凋亡相关和叶酸代谢相关基因相对表达的影响Table 5 Effects of folic acid supplemental level on the relative expression level of apoptosis-related and folic acid metabolism-related genes in the liver of piglets at 35 days of age
3 讨论
IUGR可导致新生儿高死亡率和畸形率,并影响机体组成和长期健康,造成重大经济损失,目前对于IUGR的研究主要集中在IUGR的危害及预防措施上[15],通过营养干预和饲养管理改善IUGR个体的存活和健康方面仍少有报道。IUGR对器官结构和功能、机体生理代谢的深远影响提示IUGR个体通过表观遗传学调控着相关基因的表达[16]。机体在出生后早期细胞大量增殖、生长迅速[17],同时拥有较强的发育可塑性[13],叶酸作为一碳单位载体,其在体内的代谢与核酸合成、蛋白质代谢和生物甲基化等过程密切相关[9]。因此本试验以IUGR仔猪为模型,研究在出生后早期饲粮中添加叶酸对肝脏结构和功能的影响。
Burdge等[5]在大鼠上的研究表明,对蛋白质不足母大鼠后代,28日龄断奶后饲粮添加5 mg/kg叶酸对血清葡萄糖和甘油三酯浓度无显著影响,而妊娠期母大鼠饲粮补充5 mg/kg叶酸则可显著降低后代血清葡萄糖和甘油三酯浓度[18]。本试验结果表明,IUGR仔猪超早期断奶后饲粮添加5和10 mg/kg叶酸对血清葡萄糖水平无显著影响,但分别显著和极显著降低了血清甘油三酯浓度。结果出现差异的原因可能与实施营养干预时机体所处状态、模型动物自身生理状态和叶酸处理时间长短的差异有关。
本试验发现,饲粮添加5和10 mg/kg叶酸有降低肝小叶直径的趋势,且5 mg/kg组显著降低了肝细胞直径,而10 mg/kg组肝细胞直径无显著变化,提示添加5 mg/kg叶酸能够促进肝细胞数量的增加,而10 mg/kg叶酸有减少肝细胞数量的趋势。提示出生后早期饲粮添加5 mg/kg叶酸有利于肝细胞的增殖,而10 mg/kg叶酸对肝细胞增殖无正面效应。Roncales等[11]也发现补充叶酸可以改善大鼠肝细胞的再生能力,增加肝细胞核密度和肝细胞数目,维持肝脏的正常形态。IUGR仔猪生长缓慢,超早期断奶后肝脏细胞数量可能仍在变化。那么肝细胞数量的差异是否与细胞凋亡有关呢?
Bcl-2和Bax是Bcl家族中研究最为广泛的抗凋亡蛋白和促凋亡蛋白,通过信号途径激活细胞半胱氨酰天冬氨酸特异性蛋白酶-3(caspase-3),促进细胞凋亡过程中的染色质凝聚和DNA断裂。Bcl-2参与细胞凋亡抑制过程,缓解Bax的促凋亡效应,对正常细胞起保护作用[19]。p53是凋亡过程的关键调控因子,是凋亡级联途径的有效元件,也是一个转录因子。正常情况下,p53低水平表达,且蛋白质周期较短。应激、缺氧和DNA受损时,细胞核中p53出现蓄积,并作为转录因子被激活,负调控 Bcl-2的表达,与 Bax的表达呈正相关[6,20]。正常生理条件下,一方面,APE-1 可抑制氧化应激,保护细胞免遭凋亡;另一方面,APE-1可通过氧化还原与非氧化还原的方式活化p53,从而促进p53靶基因Bax等的转录活化[8]。DNA损失可激活ATM,后者通过磷酸化反应激活DNA修复相关蛋白、损失应激蛋白及p53等,以促进细胞凋亡、细胞修复或细胞周期抑制[7]。叶酸参与了DNA前体物质嘌呤、嘧啶的形成,与DNA复制、修复和稳定性相关。有研究表明,叶酸缺乏会导致机体或细胞DNA损伤、细胞增殖减少、凋亡增加[21]。本实验室的前期研究也发现,母体补充叶酸可以缓解IUGR仔猪Bcl-2、Bax和p53的基因表达发生变化[4,22]。本试验结果发现,5 mg/kg叶酸显著增加了Bcl-2的基因表达,降低了Bax和p53的基因表达,而ATM和APE-1的基因表达呈下降的趋势;添加10 mg/kg叶酸并未进一步改善肝脏结构和细胞凋亡相关基因的表达。近年研究发现,长期过量补充叶酸可能损伤机体神经功能、免疫功能和蛋白质代谢,并与一些癌症的发生有关,机体的叶酸代谢相关生化指标与叶酸缺乏时类似[23-25]。迄今为止,关于叶酸过量产生负面效应的具体机制仍不明确,有待进一步研究。
DNMT-1是DNA甲基化的关键酶,其表达直接影响DNA甲基化状态。在叶酸介导的一碳单位代谢中,BHMT利用甜菜碱催化同型半胱氨酸转化为蛋氨酸,与蛋氨酸合酶(methionine synthasse,MS)的作用一致;MTHFR调控5-甲基四氢叶酸的形成,而后者是叶酸的活化形式,被MS利用从而促进同型半胱氨酸的再甲基化。本试验中,肝脏 DNMT-1、BHMT和MTHFR的基因表达量未受叶酸水平的显著影响,而细胞凋亡相关基因出现差异性表达,这可能与甲基化的基因特异性有关。Engeham等[26]的研究也表明母体补充叶酸时,DNMT-1、MTHFR和MS的基因表达未受影响。叶酸介导的一碳单位代谢是一个复杂的相互作用的系统,系统内大范围的调节机制使机体整体的叶酸和蛋氨酸循环处于稳态。过多叶酸会与叶酸结合蛋白结合,这些叶酸结合蛋白是叶酸循环过程中的催化酶,具有变构效应,叶酸的结合使变构酶的反应速率下降;过量叶酸可导致5-甲基四氢叶酸蓄积。有研究指出过量5-甲基四氢叶酸(5-MTHF)会向胞外转移,导致胞内叶酸库容量下降,即叶酸过量的效应与叶酸缺乏症状相似。当5-MTHF利用减少时,肝脏动用BHMT途径以缓解该效应[26-28]。
4 结论
①饲粮补充一定水平的叶酸有助于改善超早期断奶IUGR仔猪35日龄时肝脏结构和细胞凋亡相关基因Bcl-2、Bax和p53的表达。
②本试验条件下,饲粮添加5 mg/kg叶酸效果较好。
[1]DESAI M,CROWTHER N J,LUCAS A,et al.Organ-selective growth in the offspring of protein-restricted mothers[J].British Journal of Nutrition,1996,76(4):591 -603.
[2]MORTENSEN O H,OLSEN H L,FRANDSEN L,et al.Gestational protein restriction in mice has pronounced effects on gene expression in newborn offspring’s liver and skeletal muscle:protective effect of taurine[J].Pediatric Research,2009,67(1):47 -53.
[3]BUFFAT C,BOUBRED F,MONDON F,et al.Kidney gene expression analysis in a rat model of intrauterine growth restriction reveals massive alterations of coagulation genes[J].Endocrinology,2007,148(11):5549 -5557.
[4]刘静波,姚英,余冰,等.叶酸对初产母猪繁殖性能和宫内发育迟缓仔猪肾脏功能基因表达的影响[J].动物营养学报,2010,22(2):278 -284.
[5]BURDGE G C,LILLYCROP K A,PHILLIPS E S,et al.Folic acid supplementation during the juvenilepubertal period in rats modifies the phenotype and epigenotype induced by prenatal nutrition[J].The Journal of Nutrition,2009,139(6):1054 -1060.
[6]BASERGA M,HALE M A,MCKNIGHT R A,etal.Uteroplacental insufficiency alters hepatic expression,phosphorylation,and activity of the glucocorticoid receptor in fetal IUGR rats[J].The American Journal of Physiology,2005,289(5):1348 -1353.
[7]CORTEZ D,WANG Y,QIN J,et al.Requirement of ATM-dependent phosphorylation of brca1 in the DNA damage response to double-strand breaks[J].Science,1999,286:1162 -1166.
[8]汤显斌,谭云山.脱嘌呤嘧啶核酸内切酶与肿瘤相关性研究进展[J].国外医学:肿瘤学分册,2003,30:249 -251.
[9]BAILEY L B,GREGORY J F.Folate metabolism and requirements[J]. The Journal of Nutrition,1999,129(4):779 -782.
[10]HUANG R F S,HO Y H,LIN H L,et al.Folate deficiency induces a cell cycle-specific apoptosis in HepG2 cells[J].The Journal of Nutrition,1999,129(1):25 -31.
[11]RONCALES M,ACHON M,MANZARBEITIA F,et al.Folic acid supplementation for 4 weeks affects liver morphology in aged rats[J].The Journal of Nutrition,2004,134(5):1130 -1133.
[12]KOTSOPOULOS J,SOHN K J,KIM Y I.Postweaning dietary folate deficiency provided through childhood to puberty permanently increases genomic DNA methylation in adult rat liver[J].The Journal of Nutrition,2008,138(4):703 -709.
[13]GODFREY K M,GLUCKMAN P D,HANSON M A.Developmental origins of metabolic disease:life course and intergenerational perspectives[J].Trends in Endocrinology&Metabolism,2010,21(4):199-205.
[14]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):e45.
[15]孔祥峰,吴国耀,印遇龙.猪宫内发育迟缓及其防治研究进展[J].畜牧与兽医,2009(10):96 -101.
[16]PINNEY S E,SIMMONS R A.Epigenetic mechanisms in the development of type 2 diabetes[J].Trends in Endocrinology and Metabolism,2009,21(4):223 -229.
[17]WHITTEMORE C T,TULLIS J B,EMMANS G C.Protein growth in pigs[J]. Animal Production,1988,46(3):437 -445.
[18]BURDGE G C,LILLYCROP K A,JACKSON A A,et al.The nature of the growth pattern and of the metabolic response to fasting in the rat are dependent upon the dietary protein and folic acid intakes of their pregnant dams and post-weaning fat consumption[J].British Journal of Nutrition,2008,99(3):540 -549.
[19]KORSMEYER S J,SHUTTER J R,VEIS D J,et al.Bcl-2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J].Seminars in Cancer Biology,1993,4(6):327 -332.
[20]PHAM T D,MACLENNAN N K,CHIU C T,et al.Uteroplacental insufficiency increases apoptosis and alters p53 gene methylation in the full-term IUGR rat kidney[J].American Journal of Physiology,2003,285(5):962 -970.
[21]BAGNYUKOVA T V,POWELL C L,PAVLIV O,et al.Induction of oxidative stress and DNA damage in rat brain by a folate/methyl-deficient diet[J].Brain Research,2008,1237:44 -51.
[22]LIU J,CHEN D,MAO X,et al.Effects of maternal folic acid supplementation on morphology and apoptosis-related gene expression in jejunum of newborn intrauterine growth retarded piglets[J].Archives of Animal Nutrition,2011,65(5):376 -385.
[23]ACHON M,REYES L,ALONSO-APERTE E,et al.High dietary folate supplementation affects gestational development and dietary protein utilization in rats[J].The Journal of Nutrition,1999,129(6):1204-1208.
[24]CARNEY E,CANADA T.Dietary folate and vitamin B12 intake and cognitive decline among community-dwelling older persons[J].Nutrition in Clinical Practice,2006,21(2):188 -189.
[25]ULRICH C M,POTTER J D.Folate supplementation:too much of a good thing?[J]Cancer Epidemiology Biomarkers&Prevention,2006,15(2):189-193.
[26]ENGEHAM S F,HAASE A,LANGLEY-EVANS S C.Supplementation of a maternal low-protein diet in rat pregnancy with folic acid ameliorates programming effects upon feeding behaviour in the absence of disturbances to the methionine-homocysteine cycle[J].British Journal of Nutrition,2010,103(7):996 -1007.
[27]REED M C,NIJHOUT H F,NEUHOUSER M L,et al.A mathematical model gives insights into nutritional and genetic aspects of folate-mediated one-carbon metabolism[J].The Journal of Nutrition,2006,136(10):2653 -2661.
[28]NIJHOUT H F,REED M C,BUDU P,et al.A mathematical model of the folate Cycle[J].Journal of Biological Chemistry,2004,279(53):55008 -55016.
[29]ULRICH C M,REED M C,NIJHOUT H F.Modeling folate,one-carbon metabolism,and DNA methylation[J].Nutrition Reviews,2008,66:27 -30.

