不同填饲量对北京鸭生长性能、血清生化指标和肝脏组织学的影响
闻治国 侯水生谢 明 黄 苇 喻俊英
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
在填鸭生产中,为了达到快速沉积脂肪的目的,鸭子在短期内被人工强制填饲大量以玉米为主的高能饲料。其主要原因是碳水化合物进入动物机体后,通过磷酸戊糖和糖酵解等途径转化为甘油三酯(triglycerides,TG),最终形成脂肪组织内的脂肪沉积[1]。北京鸭在填饲大量富含碳水化合物饲粮的刺激下,胰脏发育加速,胰淀粉酶活性也增加,但填饲后胰淀粉酶的活性增加与填饲量的增加不成比例,有部分淀粉未能充分消化而排出体外[2]。同时,玉米细胞壁中大量抗营养因子的存在也影响了蛋白质和淀粉等营养物质的消化和吸收[3],而生产中过量或过少填饲必然会造成饲料消化率低、脂肪沉积差和饲养周期长等问题。因此,本试验通过研究最适填饲量、血清脂肪代谢相关指标与填饲量的关系以及填饲鸭肝脏组织学特点,来探究不同填饲量对北京鸭生长性能、血清生化指标以及肝脏组织学的影响,以期为填鸭生产提供科学依据。
1 材料与方法
1.1 试验动物及饲粮
试验选用96只35日龄健康、体重相近的雄性北京鸭(中国农业科学院北京畜牧兽医研究所选育),1~34日龄饲喂基础饲粮,试验期填饲试验饲粮(玉米-豆粕型饲粮),试验饲粮组成及营养水平见表1,试鸭自由饮水,填饲期为7 d。

表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the experimental diet(air-dry basis) %
1.2 试验设计及饲养管理
试验设8个组(对照组、Ⅰ~Ⅶ组),每组6个重复,每个重复2只鸭。对照组试鸭自由采食,平均日采食量为(259.55±18.59)g;整个试验期填饲组填饲量不同,第1天和第2天为预填饲期,第3天到第7天为正式填饲期,每只北京鸭每天填饲量见表2。饲粮与水按1∶1.2混合均匀,每天分4次(06:00、12:00、18:00和 23:00)用机械填饲。
试鸭采用网上平养,每个重复单圈饲养,自由饮水。填饲期鸭舍温度为22~25℃,湿度为60% ~72%,采用人工补光制度,24 h光照,其他按常规饲养管理进行。
1.3 测定指标及方法
1.3.1 生长性能
试验开始和结束时,以重复为单位记录空腹鸭体重,计算各组平均日增重和料重比。
1.3.2 血清生化指标
当试验结束时,对所有试鸭整夜禁食,期间自由饮水。第2天早上对所有试鸭翅静脉采血10 mL,放置于经抗凝处理的采血管中,4℃3 000 r/min离心10 min制备血浆,-20℃冷冻保存备用。然后用半自动生化分析仪(TECHBICON RA-1000型)测定血清生化指标:葡萄糖(glucose,Glu)用 Glu Assay Kit的 GOD-PAP酶学分析法测定;TG用TG Kit的酶比色法(GPO-PAP法)测定;总胆固醇(cholesterol,CHO)用 CHO Kit的酶比色法(COD-PAP法)测定;谷丙转氨酶(glutamate pyruvate transaminase,GPT)用 GPT Kit的速率法测定;谷草转氨酶(glutamate oxaloacetate transaminase,GOT)用 GOT Kit的速率法测定;γ -谷氨酰基转移酶(γ-glutamyltransferase,GGT)用GGT Kit的连续监测法测定。试剂盒由北京中生北控生物科技股份有限公司提供。
1.3.3 肝脏组织学检测
从各组中随机选取2只北京鸭,取肝后迅速于肝最大叶距边缘8 mm处切取小块肝组织,于10%的福尔马林固定24 h,经浸洗、脱水、透明、浸蜡、包埋、切片、染色等步骤制作组织切片,切片厚度为6 μm,显微镜下观察组织学特点并拍照。
1.4 数据处理
试验数据采用SAS 8.0中One-way ANOVA进行统计分析,各组间平均值的比较采用Duncan氏多重比较进行差异显著性检验,结果以平均值±标准差(mean±SD)表示,以P<0.05作为差异显著性判断标准。
采用直线折线模型对填鸭的最佳填饲量进行估算,直线折线模型[4]如下:

其中,Y为生长性能(平均日增重、料重比),X为试验饲粮中对应的填饲量(g/d),R为最佳填饲量(g/d),L为当达到最佳填饲量时对动物的生长效应,U为模型的斜率。

表2 每只北京鸭每天填饲量Table 2 Daily force-feeding amount for each Pekin duck g
2 结果与分析
2.1 不同填饲量对北京鸭生长性能的影响
由表 3可知,各组始重在(2 522.58±29.21)g和(2 559.25 ±50.43)g 之间,差异不显著(P>0.05)。试验结束时,经差减法得出对照组自由采食量为(259.55±18.59)g/d。除 300 g/d填饲组外,其他填饲组北京鸭末重和平均日增重显著高于对照组(P<0.05)。末重和平均日增重随填饲量水平的提高而逐渐提高,当填饲量为420 g/d时,平均日增重比对照组提高了47.86%,填饲量继续增大,末重和平均日增重基本保持稳定。填饲组料重比与对照组相比差异不显著(P>0.05)。
以平均日增重为评定指标,建立直线折线模型估计填鸭的最佳填饲量,结果如下:

以上模型可以看出,填鸭的最佳填饲量为414.2 g/d,当填饲量大于 414.2 g/d 时,填鸭的平均日增重基本趋于稳定。
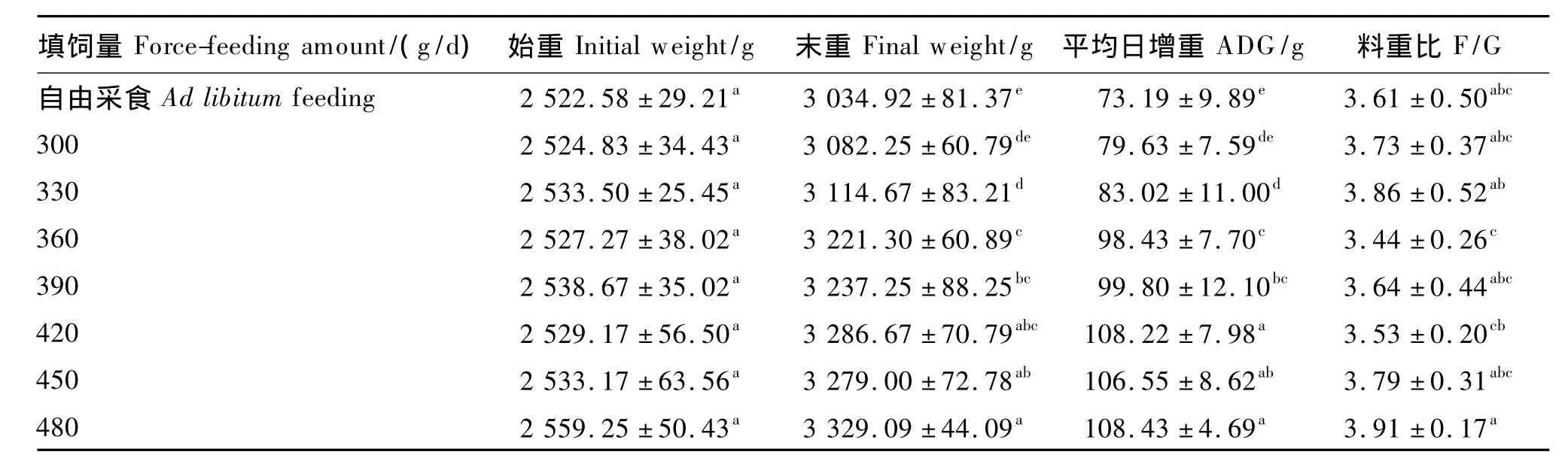
表3 不同填饲量对北京鸭生长性能的影响Table 3 Effects of different force-feeding amounts on growth performance of Pekin ducks
2.2 不同填饲量对北京鸭血清生化指标的影响
2.2.1 对血清Glu、TG和CHO 的影响
由表4可知,不同填饲量对北京鸭血清中Glu浓度的影响各组之间差异不显著(P>0.05),这说明北京鸭在不同填饲量下,血清中Glu浓度经过隔夜禁食后能够恢复到自由采食的状态。不同填饲量显著提高血清TG和CHO的浓度(P<0.05),随填饲水平的升高,血清中TG和CHO浓度逐渐升高。在填饲量为 300、330、360、390、420 g/d时,血清中TG浓度没有显著差异(P>0.05),在填饲量为450 g/d时,TG浓度达到最大,显著高于其他各组(P<0.05)。当填饲量为480 g/d时,血清CHO浓度达到最大,显著高于其他各组(P<0.05),且与对照组相比,提高了77.4%。

表4 不同填饲量对北京鸭血清Glu、TG和CHO浓度的影响Table 4 Effects of different force-feeding amounts on serum Glu,TG and CHO concentration of Pekin ducks mmol/L
2.2.2 对血清GPT、GOT和GGT的影响
由表5可知,血清GPT活性随填饲量的升高而逐渐升高,当填饲量大于360 g/d时,GPT活性显著高于对照组(P<0.05)。而填饲对血清GOT和GGT活性影响不大,除450 g/d填饲组血清GGT活性显著高于对照组(P<0.05)外,其他填饲组与对照组差异均不显著(P>0.05)。
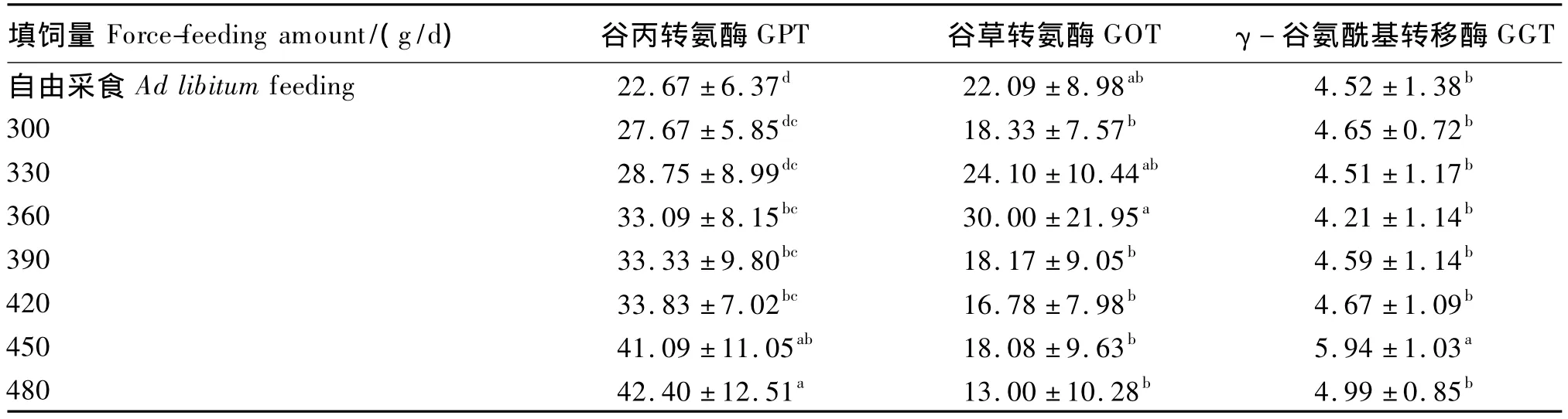
表5 不同填饲量对北京鸭血清GPT、GOT和GGT活性的影响Table 5 Effects of different force-feeding amounts on serum GPT,GOT and GGT activity of Pekin ducks U/L
2.3 不同填饲量对北京鸭肝脏组织学的影响
填鸭屠宰后分离肝脏,观察肝脏的外观和组织结构。对照组北京鸭肝脏呈红褐色,表面光滑,切面无油脂渗出。而420、450和480 g/d填饲组北京鸭大部分肝脏肿大,表面色泽呈灰黄色,部分肝脏变硬,切面有油脂渗出。分别对8组试鸭进行肝脏苏木精-伊红(HE)染色,观察其肝脏脂肪的沉积情况(图1)。对照组肝脏呈现规则的肝细胞形态,肝细胞呈多角形,细胞核清晰可见,细胞质中有部分脂滴,但数量较少,不影响肝细胞的大小和形态(图1-A)。填饲量为360 g/d时,肝细胞脂肪沉积情况与对照组相比,变化不明显(图1-B)。当填饲量达到390 g/d时,肝脏脂肪沉积量有明显的不同,脂肪组织增多,能清楚辨认完整的肝细胞(图1-C)。填饲量进一步提高到420 g/d时,肝细胞内出现大小不等的油滴,且有部分油滴融合成了油囊,肝脏细胞胀大变型,但肝细胞完整(图1-D)。450和480 g/d填饲组脂肪沉积差异不明显,共同特点是脂肪空泡明显增多,有的脂肪滴连成一片,将细胞核挤压到一侧,但并未发现肝细胞严重受损。

图1 北京鸭肝脏组织学切片图Fig.1 Histological slices of liver tissue of Pekin ducks
3 讨论
3.1 不同填饲量对北京鸭生长性能的影响
在水禽生产上,填饲的主要目的是快速沉积脂肪以及生产肥肝,关于填饲对动物生长性能的影响已经有了比较深入的研究。许多研究表明,对水禽进行填饲后,其生长性能有了很大的提高[5-6]。本试验中,除300 g/d填饲组外,其他填饲组北京鸭试验末重和平均日增重均显著高于对照组(P<0.05),420 g/d填饲组与对照组相比,平均日增重提高了47.86%,以上结果说明填饲能够提高北京鸭生长性能,这与Zanusso等[7]在番鸭上和Chartrin等[8-9]在骡鸭上的研究结果一致。北京鸭沉积脂肪主要通过2个途径:一是饲粮中的碳水化合物在糖酵解过程生成大量的脂肪酸,脂肪酸经酯化生成TG存储在体内;二是饲粮中的脂肪进入消化道后,被肠上皮细胞内的脂肪分解酶分解为甘油和脂肪酸后进入血液,进一步生成TG。而本试验中填鸭主要通过第1个途径沉积脂肪,填饲造成脂肪酸合成代谢大于分解代谢,从头合成的TG就会储存在肝脏和脂肪组织中[10-12]。另一方面,填饲大量碳水化合物饲粮对北京鸭机体刺激增强,从而引起消化系统发育加速,有利于为机体发育输送更多的营养物质,这也是填鸭增重的原因[13]。
本试验中,当填饲量从420 g/d增加到480 g/d时,末重和平均日增重基本保持稳定,再结合试验期间观察420 g/d到480 g/d填饲组北京鸭排泄物的情况,发现有大量黄色玉米颗粒未能充分消化而直接排出体外,说明填饲量达到某一值时,北京鸭已不能继续充分消化饲料中更多的营养物质而只能使体重保持稳定。李琨瑛等[2]研究也表明,北京鸭填饲后胰淀粉酶的活性增长与饲料量的增加不成比例,有部分淀粉未能充分消化。一般来说,饲喂食物越多,肠道与食物接触面积越小,必然会造成食物消化率低[14]。Tafaj等[15]也曾研究报道,奶牛和绵羊的饲喂量是自由采食的3倍时,2种动物的营养物质利用率都降低,体重增加不明显。本试验结果显示,北京鸭体重和平均日增重随填饲量的增加而逐渐增加,当填饲量继续增大时体重保持稳定,该结果与上述研究一致。
目前直线折线模型已经广泛应用于动物氨基酸和维生素需要量的估算上。Luo等[16]和Yuan等[17]在水产上也应用直线折线模型来确定鱼类饲喂量的研究报道,但还没有相关填鸭填饲量的研究报道。本试验中,以填鸭平均日增重为评定指标,建立直线折线模型估算填鸭的最适填饲量为414.2 g/d,与本试验平均日增重结果较好的420 g/d相似,可为填鸭生产提供更好的技术方法。
3.2 不同填饲量对北京鸭血清生化指标的影响
血糖在动物机体的能量代谢中起着重要的作用,它是维持机体稳定的首要物质,而水禽肝脏又是调节血糖平衡的主要器官[18]。家禽脂肪发育和脂肪沉积的程度主要取决于血清中TG和CHO水平[19],而血清中的脂质主要来源于肝脏和饲粮。本试验研究结果显示,不同填饲量对填鸭血清中Glu浓度没有显著影响(P>0.05),显著影响血清TG和CHO浓度(P<0.05)。在填饲量为300、330、360、390、420 g/d 时,血清中 TG 浓度没有显著差异(P>0.05),在填饲量为450 g/d时,TG浓度达到最大;而在填饲量为480 g/d时,CHO浓度达到最大,与对照组相比提高了77.4%。这说明当饲粮中的碳水化合物经北京鸭肠道消化进入血液后,大部分会被肝脏摄取用于脂肪的合成[20],最终导致血清中TG和CHO浓度升高,而Glu浓度没有变化。有研究表明,北京鸭被填饲或注射Glu以后,其糖耐量变大,但血糖最终在110 min内恢复到正常水平[21]。过量的脂肪进入肝脏会使脂肪以极低密度脂蛋白(VLDL)的形式运输到外围脂肪组织和肌肉中,当脂肪含量进一步增加时,诱发脂肪肝的形成,血清中TG和CHO浓度也随之增加[22]。Armstrong 等[23]和 van den Brand 等[24]给母猪饲喂不同能量水平的饲粮,母猪空腹后血清中Glu浓度没有任何变化。Davail等[25]研究也表明,对番鸭、骡鸭和北京鸭填饲后,血清中的TG和CHO浓度急速升高,Glu浓度却是先升高再降低,而后基本保持稳定,Glu浓度没有TG和CHO浓度变化明显,这与李翔[26]在朗德鹅上和 Molee等[27]在骡鸭上的研究结果一致。
肝脏是机体内含酶最丰富的器官,肝脏受损时,会发生肝细胞通透性增加和细胞坏死等症状,致使血清酶量发生变化,因此,血清酶检查是评估肝细胞损伤的重要途径。当肝细胞破坏、细胞通透性增高及线粒体损伤时,GPT、GOT活性增高,并且GPT、GOT活性的高低变化与肝细胞受损的程度相一致。血清中GGT含量很少,主要来自肝脏,当动物发生病毒性肝炎、肝硬化和肝脏肿瘤等疾病时,血清GGT才有不同程度升高。而GOT与GPT活性的比值(GOT/GPT值)有助于估计患者肝细胞损伤的严重程度和肝脏疾病的鉴别[28]。慢性肝炎时GOT/GPT值小于1,肝细胞严重受损时GOT/GPT值大于1,并且随着病情发展,GPT活性逐渐增大[29]。本试验中,GOT/GPT值小于1,并且GPT随填饲量增加而逐渐增加,差异显著。这说明填饲导致北京鸭发生慢性肝炎,但肝细胞是否受到严重损伤还需从肝脏切片观察进一步验证。Babilé等[30]也研究表明,填鸭的肝脏并未发生坏死,填饲停止后肝脏可以恢复到正常状态。本试验也验证了Davail等[25]的研究结果,北京鸭比番鸭、骡鸭肥肝易感性弱,肝脏变性和坏死的比率较小,这可能与北京鸭脂蛋白酯酶(LPL)活性维持在一定的水平,而番鸭与骡鸭填饲后LPL活性显著降低有关,这说明与骡鸭和番鸭相比,北京鸭肝脏可能具有相对较强的脂质分泌功能。
本试验结果显示,填饲组北京鸭血清中TG、CHO浓度和GPT活性显著高于对照组,与Fournier等[11]和苏胜彦等[31]研究结果一致。
3.3 填鸭肝脏组织学观察
肝脏中合成的TG主要通过VLDL和高密度脂蛋白(HDL)运送,当肝脏合成TG的速度高于VLDL和HDL的分泌速度和脂肪酸β氧化速度时,造成肝脏中TG的大量沉积,形成肥肝。本试验中,随着填饲量的升高,北京鸭肝脏组织中脂肪沉积量逐渐增加,在填饲量在420 g/d以上时,肝细胞充满大小不等的脂滴,部分小脂滴融合成大脂滴,有的甚至连成一片,肝细胞虽急剧增大,但结构仍保持完整,组织中没有坏死和破裂的现象,与苏胜彦等[31]和朱丽慧等[32]在朗德鹅上肝细胞变化趋势一致,同时也验证了上述肝细胞未受到严重损伤的结论。而瞿浩等[33]研究还发现,肝脏除了脂肪滴的沉积和肝细胞体积的增大之外,还包含细胞数量的增多。本试验结果显示,肝脏细胞数量并未增多。
4 结论
①本试验条件下,与对照组相比,填饲能显著提高北京鸭平均日增重。当继续提高填饲量至420 g/d以上时,末重和平均日增重基本保持稳定。用平均日增重建立直线折线模型估算填鸭的最佳填饲量为414.2 g/d,与本试验平均日增重结果较好的420 g/d相近。
②填饲能明显提高北京鸭血清中TG、CHO浓度和GPT活性,造成肝脏细胞沉积大量脂肪,发生慢性炎症,但肝细胞未受到严重损伤。
[1]LECLERCQ B,DURAND G,DELPECH P,et al.Note préliminaire sur l'évolution des constituants biochimiques du foie au cours du gavage del'oie[J].Annales de Biologie Animale Biochimie Biophysique,1968,8(4):549-556.
[2]李琨瑛,刘敏雄,王柱三.填饲对北京鸭胰淀粉酶活性的影响[J].中国畜牧杂志,1983(4):15-16.
[3]刘强,冯学琴.非淀粉多糖酶制剂的研究与应用进展[J].动物营养学报,1999,11(2):6-11.
[4]ROBBINS K R,SAXTON A M,SOUTHERN L L.Estimation of nutrient requirements using broken-line regression analysis[J].Journal of Animal Science,2006,84(13):E155-E165.
[5]MOUROT J,GUY G,LAGARRIGUE S,et al.Role of hepatic lipogenesis in the susceptibility to fatty liver in the goose(Anser anser)[J].Comparative Biochemistry and Physiology-Part B:Biochemistry&Molecular Biology,2000,126(1):81-87.
[6]VAN HAM E H,BERNTSSEN M H G,IMSLAND A K,et al.The influence of temperature and ration on growth,feed conversion,body composition and nutrient retention of juvenile turbot(Scophthalmus maximus)[J].Aquaculture,2003,217(1/2/3/4):547-558.
[7]ZANUSSO J,RÉMIGNON H,GUY G,et al.The effects of overfeeding on myofibre characteristics and metabolical traits of the breast muscle in Muscovy ducks(Caïrina moschata)[J].Reproduction Nutrition and Development,2003,43(1):105-115.
[8]CHARTRIN P,BERNADET M D,GUY G,et al.Effects of genotype and overfeeding on fat content of adipose and muscle tissues in ducks[J].Animal Research,2006,55:231-244.
[9]CHARTRIN P,SCHIAVONE A,BERNADET M D,et al.Effects of genotype and overfeeding on lipid deposition in myofibres and intramuscular adipocytes of breast and thigh muscles of ducks[J].Reproduction Nutrition and Development,2005,45(1):87-99.
[10]HERMIER D,SAADOUN A,SALICHON M R,et al.Plasma lipoproteins and liver lipids in two breeds of geese with different susceptibility to hepatic steatosis:changes induced by development and force-feeding[J].Lipids,1991,26(5):331-339.
[11]FOURNIER E,PERESSON R,GUY G,et al.Relationship between storage and secretion of hepatic lipids in two breeds of geese with different susceptibility to liver steatosis[J].Poultry Science,1997,76(4):599-607.
[12]GUY G,HERMIER D,DAVAIL S,et al.Meat production and force-feeding ability of different types of ducks[C]//Proceedings of the 1st World Waterfowl Conference.Taichung:[s.n],1999:462-468.
[13]王柱三,刘敏雄,李琨瑛.不同饲养水平下北京鸭的体发育和消化器官的发育[J].中国畜牧杂志,1981(5):11-12.
[14]HENKEN A M,KLEINGELD D W,TIJSSEN P A T.The effect of feeding level on apparent digestibility of dietary dry matter,crude protein and gross energy in the African catfish Clarias gariepinus(Burchell,1822)[J].Aquaculture,1985,51(1):1-11.
[15]TAFAJ M,STEINGASSB H,DROCHNERC W.Influence of hay particle size at different concentrate and feeding levels on digestive processes and feed intake in ruminants.2.Passage,digestibility and feed intake[J].Archives of Animal Nutrition,2001,54(3):243-259.
[16]LUO Z,LIU Y J,MAI K S,et al.Effects of feeding levels on growth performance,feed utilization,body composition,and apparent digestibility coefficients of nutrients for grouper Epinephelus coioides juveniles[J].Journal of the World Aquaculture Society,2006,37(1):32-40.
[17]YUAN Y C,YANG H J,GONG S Y,et al.Effects of feeding levels on growth performance,feed utilization,body composition and apparent digestibility coefficients of nutrients for juvenile Chinese sucker,Myxocyprinus asiaticus[J].Aquaculture Research,2010,41(7):1030-1042.
[18]JONES C E,KOSHIBU K,DECAMBER M,et al.The kidney’s role in glucose balance following partial hepatectomy[J].The Journal of Surgical Research,1998,79(2):136-140.
[19]HERMIER D.Lipoprotein metabolism and fattening in poultry[J].The Journal of Nutrition,1997,127(5):805S-808S.
[20]DAVAIL S,GUY G,ANDRE J M,et al.Metabolism in two breeds of geese with moderate or large overfeeding induced liver-steatosis[J].Comparative Biochemistry and Physiology-Part A:Molecular&Integrative Physiology,2000,126(1):91-99.
[21]李琨瑛,刘敏雄,王柱三.填饲对北京鸭糖耐量的影响[J].中国畜牧杂志,1984(1):15-16.
[22]HERMIER D,GUY G,GUILLAUMIN S,et al.Differential channelling of liver lipids in relation to susceptibility to hepatic steatosis in two species of ducks[J].Comparative Biochemistry and Physiology-Part B:Biochemistry&Molecular Biology,2003,135(4):663-675.
[23]ARMSTRONG J D,BRITT J H,KRAELING R R.Effect of restriction of energy during lactation on body condition,energy metabolism,endocrine changes and reproductive performance in primiparous sows[J].Journal of Animal Science,1986,63(6):1915-1925.
[24]VAN DEN BRAND H,DIELEMAN S J,SOEDE N M,et al.Dietary energy source at two feeding levels during lactation of primiparous sows:Ⅰ.Effects on glucose,insulin and luteinizing hormone and on follicle development,weaning-to-estrus interval,and ovulation rate[J].Journal of Animal Science,2000,78(2):396-404.
[25]DAVAIL S,RIDEAU N,GUY G,et al.Hormonal and metabolic responses to overfeeding in three genotypes of ducks[J].Comparative Biochemistry and Physiology-Part A:Molecular&Integrative Physiology,2003,134(4):707-715.
[26]李翔.糙米型饲粮对鹅鸭肥肝性能影响及朗德鹅肥肝脂肪沉积规律的研究[D].博士学位论文.武汉:华中农业大学,2005:47-48.
[27]MOLEE W,BOUILLIER-OUDOT M,AUVERGNE A,et al.Changes in lipid composition of hepatocyte plasma membrane induced by overfeeding in duck[J].Comparative Biochemistry and Physiology-Part B:Biochemistry& Molecular Biology,2005,141(4):437-444.
[28]孙晓洁,杨沛,田怡.血清常规酶学检查及B超在诊断肝纤维化的价值[J].安徽医药,2002,6(4):37-39.
[29]马景德.生化酶类比值测定与肝胆胰疾病[J].临床荟萃,1991,6(4):175-177.
[30]BABILÉ R,AUVERGNE A,DUBOIS J P,et al.Réversibilité de la stéatose hépatique chez l'oie[M]//3èmes Journées de la Recherche sur les Palmipèdes à Foie Gras.Bordeaux:Institut Technique de l'AVIculture,1998:45-48.
[31]苏胜彦,李齐发,陈睿,等.填饲对朗德鹅产肝性能、肝脏组织学和脂生成基因表达水平的影响[J].中国农业科学,2009,42(7):2523-2530.
[32]朱丽慧,武艳军,关佳佳,等.填饲对朗德鹅血液指标、组织营养成分以及肝脏组织学的影响[J].中国家禽,2010,32(3):28-31.
[33]瞿浩,王继文.鹅肥肝形成的分子机理研究进展[J].四川畜牧兽医,2003,30(5):33-34.

