特比萘芬与其他抗真菌药物对外阴阴道念珠菌病病原菌的体外相互作用研究
季雅娟 王爱平 刘伟 万喆 李若瑜
(北京大学第一医院皮肤性病科北京大学真菌和真菌病研究中心,北京100034)
外阴阴道念珠菌病 (vulvovaginal candidiasis,VVC)是一种由念珠菌引起的阴道黏膜的真菌感染。有些患者为VVC无症状的携带者,而一些患者则可能发展为顽固难治的慢性复发性外阴阴道念珠菌病 (RVVC)。治疗VVC常用的抗真菌药物主要为唑类药物,包括氟康唑 (fluconazole,FLU)、伊曲康唑 (itraconazole,ITR)、咪康唑 (miconazole,MCZ)、克霉唑 (clotrimazole,CMZ),其次为制霉菌素 (nystatin,NYS)。大量的临床研究已经证明,长期应用单一的唑类药物治疗VVC容易诱导耐药菌株的出现,而联合用药则能减少耐药性的发生并减少使用大剂量单一药物带来的副作用。特比萘芬 (terbinafine,TEB))是丙烯胺类抗真菌药物,具有广谱抗真菌作用,对皮肤癣菌、酵母菌和其他霉菌有抗菌活性,对于皮肤癣菌具有杀菌效应;而对于酵母菌,根据菌种的不同特比萘芬具有杀菌或抑菌效应,对近平滑念珠菌呈杀菌效应[1]。基于TEB的药效学特点,在临床上TEB主要用于皮肤癣菌病的治疗。而在国外并未开发其妇科产品,在我国则开发出了盐酸特比萘芬阴道泡腾片 (50 mg/片),临床研究显示其治疗VVC的临床疗效与硝酸咪康唑栓的疗效相似[2]。因此,为了更好的了解TEB与妇科常用的五种抗真菌药物在体外对分离自VVC患者的念珠菌的抗菌活性以及联合药敏试验,我们应用CLSI(Clinical Laboratory Standard Institute)M27-A3[3]方案推荐的微量液体稀释法对念珠菌的酵母相进行了研究,希望为临床治疗提供帮助。
1 材料与方法
1.1 实验菌株
保存于北京大学真菌与真菌病研究中心的46株念珠菌均来自VVC患者分离的临床菌株,其中白念株菌 (Candida albicans)20株,热带念珠菌(Candida tropical)14株,光滑念珠菌 4株(Candida glabrata),克柔念珠菌 (Candida krusei)3株,近平滑念珠菌 (Candida parapsilosis)3株,季也蒙念珠菌 (Candida guilliermondii)1株。质控株为近平滑念珠菌ATCC 22019。菌株的活化用改良的SDA转种菌株2次,以保证菌株的活力。
1.2 实验药物
抗真菌药物由厂家提供或购买原粉。TEB由山东齐鲁制药有限公司提供,批号960111,纯度为99.9%。伊曲康唑购自山东省寿光富康制药公司,批号20050902,纯度为99.7%。咪康唑购自中国药品生物制品检定所,批号100213-200705,纯度为99.7%。克霉唑购自美国Sigma-Aldrich公司,批号16H0194,纯度为99%。制霉菌素购自美国Sigma-Aldrich公司,批号087k14693V,纯度为99%。上述5种药物均用100%二甲基亚砜(DMSO)溶解,药物浓度为1 600μg/mL。氟康唑购自美国Sigma-Aldrich公司,批号200406040,纯度为98.83%,用无菌蒸馏水溶解,药物浓度为3 200μg/mL。配好的药物贮存液置-20℃冰箱备用。
1.3 培养基
改良沙堡固体培养基(SDA),RPMI 1640液体培养基。
1.4 主要试剂和器材
RPMI 1640粉,MOPS缓冲液粉剂,DMSO,96孔细胞培养板,麦氏比浊管和比浊仪。
1.5 方法
菌悬液制备 从SDA培养基上用无菌生理盐水收集念珠菌的孢子,并进一步用RPMI 1640液体培养基稀释至终浓度为 (1~2.5)×104CFU/mL。
药物敏感测试板的制备 标准的液体培养基RPMI 1640中加入0.165 mol/L MOPS,调pH 至7.0。将 FLU、ITR、MCZ、CMZ 和 NYS的药物母液用RPMI 1640液体培养基进行10级倍比稀释,FLU的药物浓度范围是128~0.25μg/mL,ITR和NYS的药物浓度是32~0.06μg/mL,MCZ的药物浓度范围是16~0.03μg/mL,CMZ药物浓度范围是4~0.007 5μg/mL。将TEB的药物母液进行7级倍比稀释,浓度范围是256~4μg/mL(除近平滑念珠菌所用的药敏板浓度范围是4~0.06μg/mL以外)。配置药敏板时以上各药物浓度均为4倍应测试药物浓度。每次配制药敏板时均制备质控菌药敏板进行质控,配好的药敏板密封后放置-20℃冰箱贮存备用。
棋盘式微量稀释法 药物在体外的相互作用是通过棋盘微量液基稀释法进行评价的,包括判读各个单药的MIC值并在相同药敏板上读出联合用药后的MIC值。根据抗真菌药物的浓度范围将药物分别加入到药敏板中。培养板横向以1~12列表示,即有12孔;纵向以A~H行表示,即有8孔。第1列及第H行为单独药敏试验区,第2~11列及A~G行为联合药敏试验区。6种药物的储存液分别用RPMI 1640培养基进行倍比稀释,取50μL各稀释浓度TEB药液分别加入A~G行各孔,取50 μL各稀释浓度其他药物加入1~11列。第12列加入200μL培养基作为阴性对照[4]。之后各孔接种制备好的菌悬液100μL,将药敏板放置35℃恒温培养箱,48 h观察结果。
最低抑菌浓度 (minimal inhibitory concentration,MIC)的判定 采用终点判读法观察与生长对照相比90%[5-6]生长受抑制的最低药物浓度为单药的MIC值和与其他药物联合后的MIC值。实验重复2次。
联合用药的效果评价 分数抑菌浓度指数(fractional inhibitory concentration,FICI)被用于评价药物间的相互作用。FICI值的计算方法是每一种药物联合用药后的MIC值除以该单药的MIC值,然后相加,计算出的值即为FICI值。判读标准是[7]:当 FICI值≤0.5 时,为协同;当 0.5 < FICI≤4.0,为无关;当 FICI>4.0 时为拮抗。并计算各药物单独和联合用药时MIC的几何均数GM。
2 结 果
2.1 抗真菌药物对念珠菌的MIC值
TEB单药的MIC范围是0.5~256μg/mL,C.parapsilosis的MIC值是0.5~1 μg/mL,其余念珠菌均为256μg/mL。FLU的MIC范围是0.5~128 μg/mL。ITR的MIC范围是0.5~32μg/mL。MCZ的MIC范围是0.125~16μg/mL。CMZ的MIC范围为0.03~4μg/mL。NYS的 MIC范围为2~8 μg/mL(见表1)。
2.2 TEB与其他5种抗真菌药物体外药物相互作用
对C.albicans,TEB 分别与 FLU、ITR、MCZ 和CMZ联合,表现为协同作用所占比例分别为100%(20/20)、80%(16/20)、55%(11/20)和 90%(18/20)。1株 C.guilliermondii对TEB与上述四种唑类药物的联合均表现为协同;C.tropical对TEB与FLU、ITR、MCZ、CMZ联合表现为协同作用的分别为 67%(10/15)、60%(9/15)、20%(3/15)、20%(3/15)。对 C.glabrata,C.krusei和 C.parapsilosis,联合药敏的结果显示TEB与唑类药物均无协同作用。TEB与NYS联合对所有菌株均无协同作用(见表2)。

表1 6种抗真菌药物对念珠菌的MIC值范围及GM值(μg/mL)Tab.1 MIC ranges and geometric mean of six antifungi drugs against Candida spp(μg/mL)
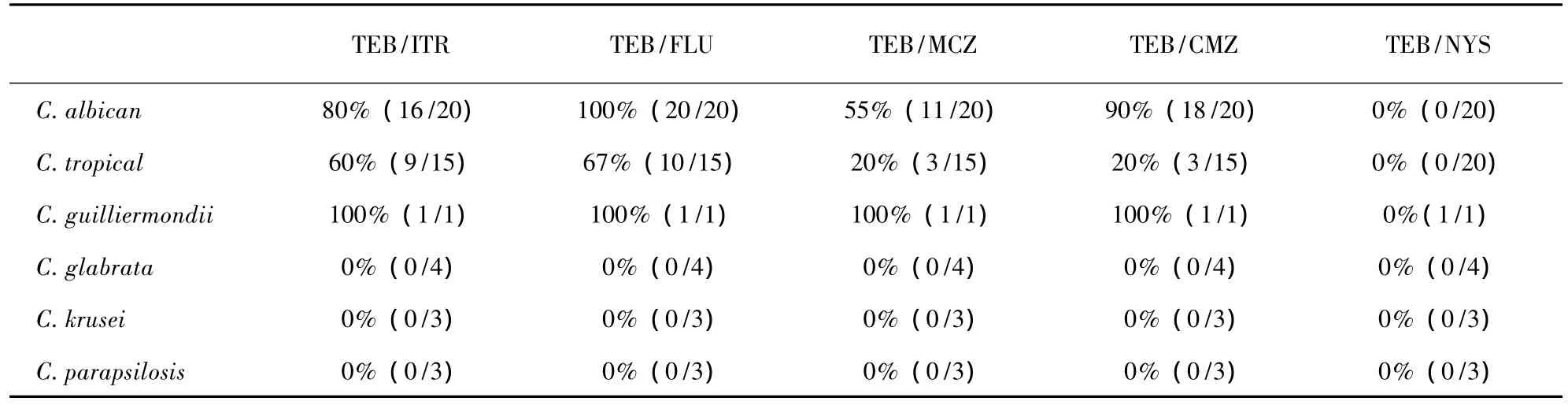
表2 特比萘芬与其他药物联合对念珠菌协同作用的百分比 (n,%)Tab.2 Synergistic interaction of terbinafine and other drugs to Candida spp(n ,%)
3 讨 论
TEB是丙稀胺类抗真菌药物,对多种丝状菌和其他的病原菌有良好的抗真菌活性[8]。由于有比较高的亲脂特性并在皮肤组织中广泛分布,TEB被广泛用于多种皮肤癣菌病的治疗[9-10]。但其对念珠菌属,包括C.albicans的作用则以抑菌效应为主,且MIC值较高。因此,临床上对于TEB是否可以用于治疗C.albicans感染还缺乏统一的认识。三唑类药物,包括FLU、ITR等,通过抑制真菌细胞膜上与麦角固醇生物合成有关的C14-羊毛甾醇脱甲基酶来发挥抗真菌作用[11]。FLU已广泛应用于多种念珠菌属引起的真菌感染[12]。ITR已用于多种侵袭性真菌感染,包括念珠菌血症[13]。MCZ和CMZ属咪唑类抗真菌药,作用机制是影响真菌甾醇或脂肪酸的代谢,引起毒性产物在细胞内聚集,造成代谢障碍等,从而达到抗真菌的作用。NYS可与胞膜上的固醇相结合,由此导致菌膜的通透性改变,胞质内容物外漏,导致菌体死亡。不同种类的药物由于药物作用靶点的不同,联合后可能显示为协同作用。
本实验结果提示:TEB与唑类药物联合,对C.albicans产生协同作用,与国内的一些研究结果吻合[14-15]。对 C.tropical,TEB 与唑类药物联合表现为部分协同。对于 C.glabrata,C.krusei 和 C.parapsilosis,联合药敏无协同作用;而 C.guilliermondii则表现为协同作用。但由于这些非白念株菌株数目较少,可能不能完全体现真实情况。因此,不同种属的念珠菌可能对相同的药物联合表现出不同的效应,临床医生可以根据菌种鉴定的结果来选择合适的抗真菌药物。
本实验采用M27-A3方法测定MIC值,TEB判定值临界点明显,无拖尾现象。FLU和ITR在低浓度时对真菌起抑制作用,高浓度时才呈现出杀菌作用,容易出现拖尾现象。我们参考国外文献[5-6],对TEB和唑类药物的单药和联合用药后的MIC值均读取与生长对照相比90%生长抑制所对应的药物浓度。
本研究采用念珠菌的酵母形态进行了体外抗菌活性研究,而在临床中念珠菌真正的致病状态为菌丝形态。我们曾经的体外研究结果显示TEB对念珠菌的菌丝相MIC值明显低于酵母相[16],本研究亦显示类似的结果。今后有待对念珠菌的菌丝相状态进行相关研究,这样的结果可能更接近临床疾病发病的真实过程。尽管抗真菌药物体外MIC值与体内实际抗菌效能相关,但并非完全平行,因此还需进一步用动物模型和临床疗效来评价联合用药的疗效。
[1] 刘伟,李若瑜.特比萘芬的体外抗真菌活性及药物动力学特征[J].中国新药与临床杂志,2000,19(7):8-11.
[2] 卞美璐,陈庆云,张友忠,等.盐酸特比萘芬阴道泡腾片治疗外阴阴道假丝酵母菌病71例[J].中国新药杂志,2005,14(9):1184-1186.
[3] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of Yeasts;Approved standard-Third Edition[S].CLSI Document M27-A3.
[4] 王爱平,高那,刘伟,等.伊曲康唑联合特比萘芬治疗孢子丝菌病疗效及其对病原真菌体外抗菌活性研究[J].中国真菌学杂志,2011,2(6):5-8.
[5] Barchiesi F,Spreghini E,Maracci M,et al.In vitro activities of voriconazole in combination with three other antifungal agents against Candida glabrata [J] .Antimicrob Agents Chemother,2004,48(9):3317-3322.
[6] Perea S,Gonzalez G,Fothergill AW.In vitro activities of terbinafine in combination with fluconazole,itraconazole,voriconazole,and posaconazole against clinical isolates of Candida glabrata with decreased susceptibility to azoles[J].J Clin Microbiol,2002,40(5):1831-1833.
[7] Odds FC.Synergy,antagonism,what the chequerboard puts between them[J].J Antimicrob Chemother,2003,52(1):1.
[8] Krishnan-Natesan S.Terbinafine:a pharmacological and clinical review[J].Expert Opin Pharmacother,2009,10(16):2723-2733.
[9] Neoh CY,Tan SH,Perera P.Cutaneous phaeohyphomycosis due to Cladophialophora bantiana in an immunocompetent patient[J].Clin Exp Dermatol,2007,32(5):539-540.
[10] Revankar SG.Therapy of infections caused by dematiaceous fungi[J].Expert Rev Anti Infect Ther,2005,3(4):601-612.
[11] Espinel-Ingroff A.Mechanisms of resistance to antifungal agents:yeasts and filamentous fungi[J].Rev Iberoam Micol,2008,25(2):101-106.
[12] Hope WW,Billaud EM,Lestner J,et al.Therapeutic drug monitoring for triazoles[J].Curr Opin Infect Dis,2008,21(6):580-586.
[13] St-Germain G,Laverdiere M,Pelletier R,et al.Epidemiology and antifungal susceptibility of bloodstream Candida isolates in Quebec:report on 453 cases between 2003 and 2005[J].Can J Infect Dis Med Microbiol,2008,19(1):55-62.
[14] 陈宏,温海,徐红,等.伊曲康唑和特比萘芬体外联合药敏试验分析[J].中国皮肤性病学杂志,2003,17(2):99-102.
[15] 陈宏,温海,徐红,等.氟康唑和特比萘芬对新生隐球菌及念珠菌体外联合药敏试验分析[J].中国麻风皮肤病杂志,2004,20(1):17-19.
[16] 燕华玲,王爱平,万喆,等.特比萘芬对白念珠菌菌丝相和酵母相敏感性的比较[J].中华皮肤科杂志,2005,38(8):515.

