miR-222与MBD2在结肠癌组织中的表达及其临床意义
黄建军 戈立东△ 周秀田 谢金龙 胡正超 周波 许威华
1.解放军第169医院肿瘤科,△病理科,湖南 衡阳 421002;2.南华大学肿瘤研究所,湖南 衡阳 421001
miR-222与MBD2在结肠癌组织中的表达及其临床意义
黄建军1戈立东1△周秀田2谢金龙1胡正超1周波1许威华1
1.解放军第169医院肿瘤科,△病理科,湖南 衡阳 421002;2.南华大学肿瘤研究所,湖南 衡阳 421001
背景与目的:MicroRNAs是一类19~25 bp内源非编码的小分子RNA,通过靶向抑制基因的转录和翻译水平。本文旨在探讨miR-222与甲基结合结构域蛋白2(methyl-CpG binding domain protein 2,MBD2)在结肠癌组织中的表达及其临床意义。方法:收集2008年1月—2010年6月结肠癌患者手术标本76例,癌旁组织作为正常对照,分别运用原位杂交、免疫组化检测结肠癌组织及癌旁组织中miR-222、MBD2的表达水平,分析其与结肠癌临床病理参数的关系。结果:原位杂交检测显示,在76例结肠癌组织中miR-222阳性表达率为92.1%,与癌旁对照组28.9%相比,差异有显著统计学意义(P<0.01);光密度值检测发现,miR-222的表达随着结肠癌临床分期的演进而增加,且结肠癌中有淋巴结转移的miR-222的表达显著高于无淋巴结转移组(P<0.01);免疫组化结果显示,在76例结肠癌组织中MBD2蛋白阳性表达率为19.7%,与癌旁对照组81.6%相比,差异有显著统计学意义(P<0.01);光密度值检测发现,MBD2的表达随着结肠癌临床分期的演进而下调,结肠癌中有淋巴结转移的MBD2的表达显著低于无淋巴结转移组(P<0.01);相关性分析表明,miR-222表达与MBD2的表达呈负相关(P<0.05)。结论:高表达的miR-222可通过靶向抑制MBD2的表达参与结肠癌的发生、发展、侵袭和转移,miR-222及MBD2可成为结肠癌治疗、预后判断的潜在生物学指标。
微小RNA; 甲基结合结构域蛋白2; 结肠癌; 临床意义
MiRNA为长度约19~25个核苷酸的非编码RNA,能够与mRNA的3’-UTR区碱基不完全或完全配对,并在转录后水平通过促进靶mRNA的降解和(或)抑制翻译过程而发挥负调控基因表达的作用,参与细胞的分化、增殖、凋亡。研究表明,miR-222在肝癌、胃癌、前列腺癌、胶质瘤组织或细胞中表达上调[1-3]。而甲基结合结构域蛋白2 (methyl-CpG binding domain protein 2,MBD2)在胃癌组织中表达下调[4],在结肠癌中MBD2因启动子甲基化修饰而表达下调[5]。在肝门部胆管癌中miR-373可靶向抑制MBD2参与肿瘤的发生[6]。本研究采用原位杂交和免疫组化技术,分析miR-222和MBD2在结肠癌组织中的表达差异,探讨二者与结肠癌临床病理参数的关系,为进一步阐明结肠癌发生、发展、侵袭和转移的分子机制并为寻找治疗方法提供实验依据。
1 资料和方法
1.1 临床资料
收集解放军第169医院病理科2008年—2010年结肠癌切除标本76例,患者术前均未接受化疗及放疗。按照WHO结肠癌组织学分类及分级标准,其详细资料见表1。
1.2 试剂
地高辛标记的miR-222原位杂交探针为Exiqon公司产品,MBD2单克隆抗体为Santa cruz公司产品,ElivisionTMplus二步法免疫组化试剂盒、DAB显色剂购自福州迈新生物技术开发有限公司。
1.3 原位杂交检测miR-222在结肠癌和癌旁组织中的表达
切片脱蜡至水,原位杂交用PBS漂洗3次,每次5 min;3%柠檬酸新鲜稀释的胃蛋白酶,室温消化15~20 min,原位杂交用PBS漂洗3次,每次5 min;1%多聚甲醛室温固定10 min,DEPC水漂洗3次。预杂交液56 ℃预杂交4 h;将miR-222探针按说明添加于预杂交液中,混匀,56 ℃杂交过夜;室温封闭30 min。然后用生物素化鼠抗地高辛室温温育2 h,原位杂交用PBS漂洗4次,每次5 min;DAB显色剂,苏木素复染,脱水,二甲苯透明,中性树胶封片。
1.4 免疫组化检测结肠癌和癌旁组织MBD2的表达
采用ElivisionTMplus二步法免疫组化检测MBD2抗体在各组中的表达情况。
1.5 原位杂交及免疫组化结果判断
miR-222和MBD2表达的阳性染色均为棕黄色颗粒,位于细胞质内,综合染色强度和分布范围进行半定量处理,阳性强弱的标准判断按光镜下观察阳性染色的细胞比例(5个高倍视野下的均数):⑴染色细胞数少于10%为阴性;⑵染色细胞数在10%~50%为阳性;⑶染色细胞数多于50%为强阳性。显微摄像并用图像分析仪进行光密度值检测。
1.6 统计学处理
应用SPSS 13.0统计软件行相关数据分析,计量资料采用表示,均数两两比较应用双样本t检验,以及Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-222在结肠癌组织与癌旁组织的表达
原位杂交结果显示,76例结肠癌组织中miR-222阳性表达70例(92.1%),76例癌旁对照组织中miR-222阳性表达22例(28.9%),差异有显著统计学意义(P<0.01,图1)。
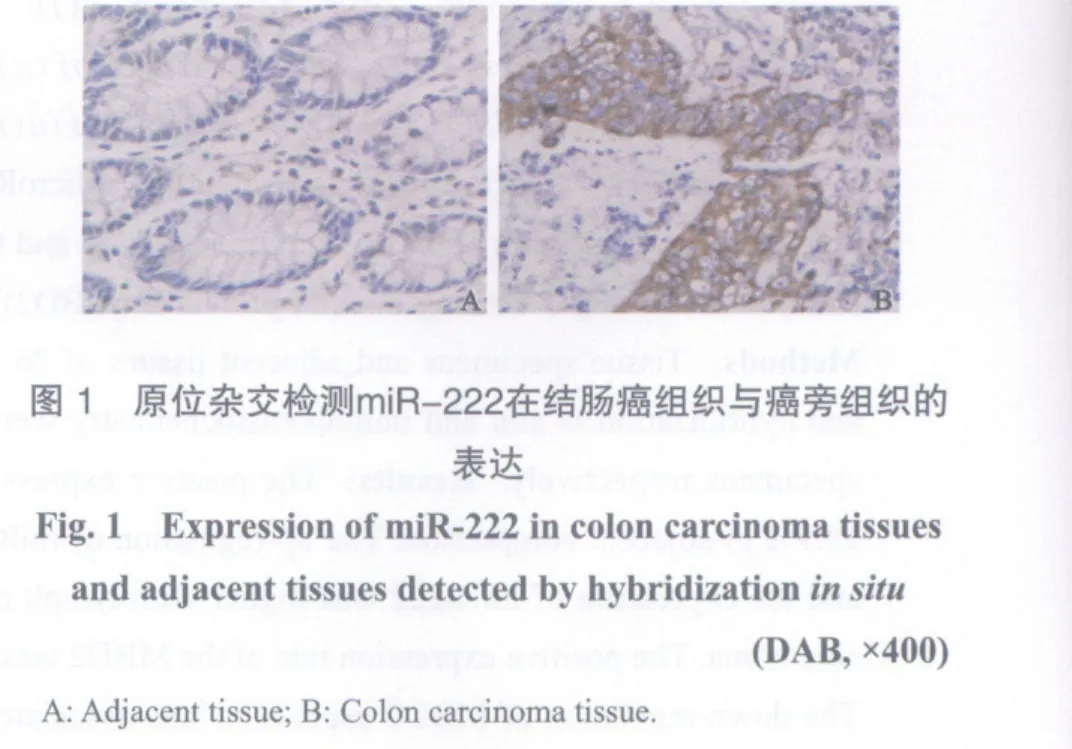
2.2 MBD2在结肠癌组织与癌旁组织的表达
免疫组化结果显示,76例结肠癌组织中MBD2阳性表达15例(19.7%),76例癌旁对照组织中MBD2阳性表达62例(81.6%),差异有显著统计学意义(P<0.01,图2)。
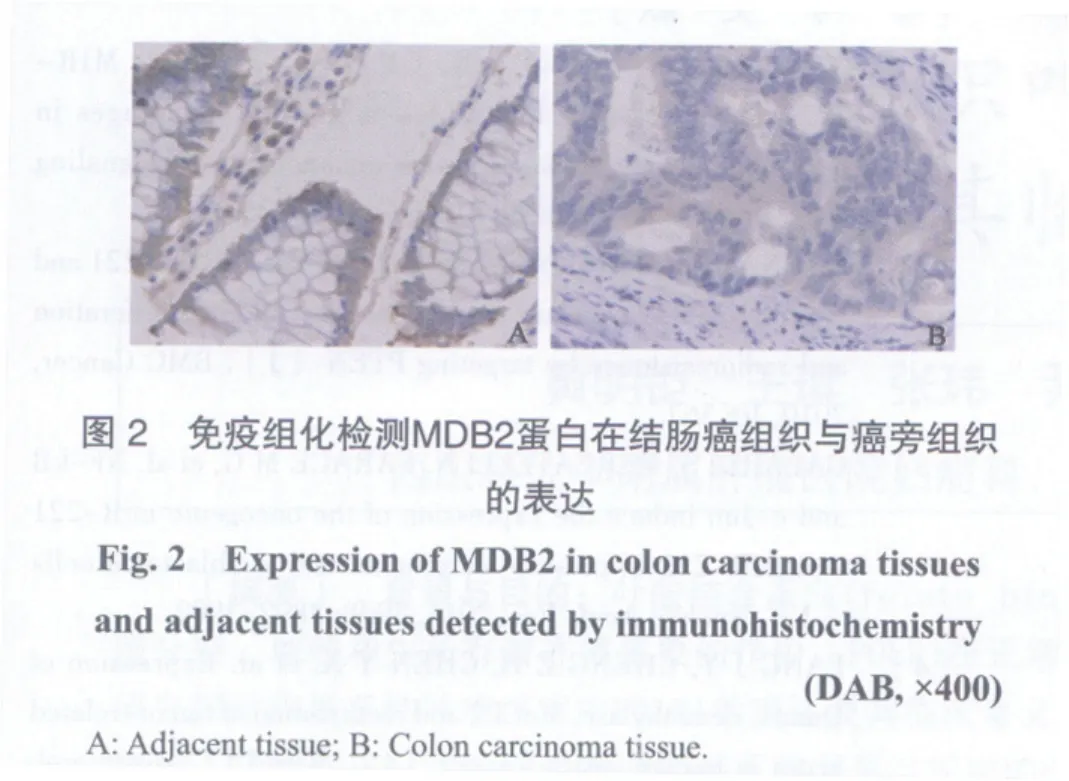
2.3 结肠癌组织中miR-222和MBD2的表达与结肠癌临床病理参数的关系
原位杂交及免疫组化结果经光密度值检测,miR-222和MBD2的表达与患者性别、年龄、肿瘤浸润深度、分化程度无显著相关(P>0.05),miR-222表达在结肠癌有淋巴结转移组显著高于无淋巴结转移组(P<0.01),且随着临床分期增高而增加,临床各期与癌旁对照组比差异均有显著统计学意义(P<0.01);MBD2表达在结肠癌有淋巴结转移组显著低于无淋巴结转移组(P<0.01),且随着临床分期增高而表达下调,临床各期与癌旁对照组比差异均有统计学意义(P<0.05,表1)。
2.4 miR-222和MBD2表达的相关性
经Spearman等级相关分析发现,在结肠癌中miR-222和MBD2表达呈显著负相关(r=-0.678,P=0.013)。随着miR-222表达增强,MBD2的表达减弱。
3 讨 论
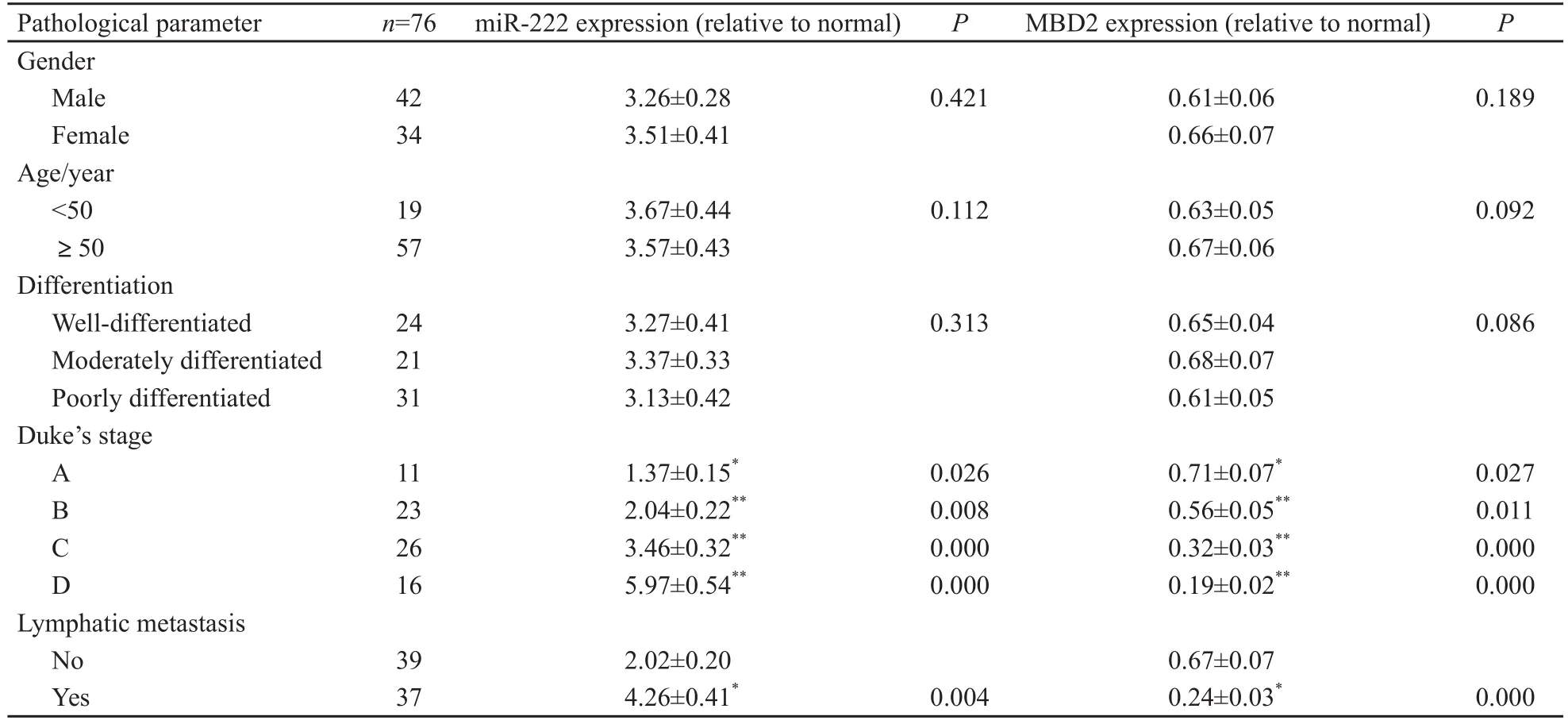
表 1 结肠癌组织中miR-222和MBD2的表达与结肠癌临床病理参数的关系Tab. 1 Correlations of miR-222 and MBD2 expression with pathological parameters in colon carcinoma
miRNA作为一种重要的转录后调控因子广泛参与了肿瘤发生、发展的过程。在多种肿瘤中均伴随有miRNA表达的失调,一些miRNA家族显示出类似癌基因或抑癌基因的功能[7]。针对miRNA在结肠癌中的研究,国内外报道比较常见[8-11]。本课题组的前期工作运用miRNA芯片技术筛选二烯丙基二硫(diallyl disulfide,DADS),处理人结肠癌SW480细胞的差异miRNA,miRNA芯片分析发现,差异的miRNA中表达下调miRNA 7个,并经实时荧光定量PCR(qRT-PCR)验证发现,DADS处理后以miR-222下调最为显著,而DADS能显著抑制人结肠癌细胞的生长、增殖[12]。研究表明,miR-222在多种肿瘤组织中表达上调[1-3]。经在线软件http://www.targetscan.org/预测发现MBD2是miR-222的靶基因,MBD2基因位于人类染色体18q21.2上,是MBD家族(甲基结合结构域蛋白家族)的一个重要成员,含有MBD和与之重叠的TRD区域,其N端含有GR重复序列,该基因能特异性结合甲基化CpG位点而发挥其转录抑制作用[13]。基因的表观遗传修饰在个体生长发育和维持正常细胞生理活动中起着重要的调控作用。肿瘤细胞常表现为基因组整体甲基化水平低,而抑癌基因启动子区甲基化水平高;基因组整体甲基化水平降低可诱发染色体的不稳定,而区域特异性甲基化水平升高则是抑癌基因失活的主要机制之一[14]。
对于组织和细胞miRNA的检测方法,目前主要以qRT-PCR和原位杂交检测。qRT-PCR检测miRNA在组织和细胞中的表达情况,是对miRNA表达的定量分析,而原位杂交是对miRNA表达的定性分析,同时可根据灰度扫描进行定量分析。本实验结果发现,在76例结肠癌组织中miR-222阳性表达率为92.1%,与癌旁对照组28.9%相比,差异有显著统计学意义(P<0.01);miR-222的表达随着结肠癌临床分期演进而增加,且结肠癌中有淋巴结转移的miR-222的表达显著高于无淋巴结转移组(P<0.01);而免疫组化结果显示,在76例结肠癌组织中MBD2蛋白阳性表达率为19.7%,与癌旁对照组81.6%相比,差异有显著统计学意义(P<0.01);MBD2蛋白的表达随着结肠癌临床分期的演进而下调,结肠癌中有淋巴结转移的MBD2的表达显著低于无淋巴结转移组(P<0.01);相关性分析表明,miR-222表达与MBD2的表达呈显著负相关(P<0.01)。本研究结果表明,高表达的miR-222可通过靶向抑制MBD2的表达参与结肠癌的发生、发展、侵袭和转移。提示两者在结肠癌的发展及侵袭转移中起到重要作用,对结肠癌的预后判断有其重要意义。
在转录后水平上,miRNA广泛参与基因表达的调控,miRNA表达的改变可以导致遗传信息表达的改变,miRNA在恶性肿瘤中具有特定的表达模式,且miRNA表达随着临床病理的进展而发生改变,从而可以更准确地监测肿瘤的变化[15]。本研究发现高表达的miR-222可通过靶向抑制MBD2的表达参与结肠癌的发生、发展、侵袭和转移,因此可成为结肠癌治疗、预后判断的潜在生物学指标。
[1]WONG Q W, CHING A K, CHAN A W, et al. MiR-222 overexpression confers cell migratory advantages in hepatocellular carcinoma through enhancing AKT signaling[J]. Clin Cancer Res, 2010, 16(3): 867-875.
[2]CHUN-ZHI Z, LEI H, AN-LING Z, et al. MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN [J]. BMC Cancer,2010, 10: 367.
[3]GALARDI S, MERCATELLI N, FARACE M G, et al. NF-kB and c-Jun induce the expression of the oncogenic miR-221 and miR-222 in prostate carcinoma and glioblastoma cells[J]. Nucleic Acids Res, 2011, 39(9): 3892-3902.
[4]FANG J Y, CHENG Z H, CHEN Y X, et al. Expression of Dnmt1, demethylase, MeCP2 and methylation of tumor-related genes in human gastric cancer [J]. World J Gastroenterol,2004, 10(23): 3394-3398.
[5]DERKS S, BOSCH L J, NIESSEN H E, et al. Promoter CpG island hypermethylation- and H3K9me3 and H3K27me3-mediated epigenetic silencing targets the deleted in colon cancer (DCC) gene in colorectal carcinogenesis without affecting neighboring genes on chromosomal region 18q21[J]. Carcinogenesis, 2009, 30(6): 1041-1048.
[6]CHEN Y, LUO J, TIAN R, et al. miR-373 negatively regulates methyl-CpG-binding domain protein 2 (MBD2) in hilar cholangiocarcinoma [J]. Dig Dis Sci, 2010, 56(6): 1693-1701.
[7]ZHANG L, DENG T, LI X, et al. microRNA-141 is involved in a nasopharyngeal carcinoma-related genes network [J].Carcinogenesis, 2010, 31(4): 559-566.
[8]YAMAKUCHI M, YAGI S, ITO T, et al. MicroRNA-22 regulates hypoxia signaling in colon cancer cells [J]. PLoS One, 2011, 6(5): 20291.
[9]TANG J T, WANG J L, DU W, et al. MicroRNA 345,a methylation-sensitive microRNA is involved in cell proliferation and invasion in human colorectal cancer [J].Carcinogenesis, 2011, 32(8): 1207-1215.
[10]IBRAHIM A F, WEIRAUCH U, THOMAS M, et al.MicroRNA replacement therapy for miR-145 and miR-33a is efficacious in a model of colon carcinoma [J]. Cancer Res,2011, 71(15): 5214-5224.
[11]OBERG A L, FRENCH A J, SARVER A L, et al. miRNA expression in colon polyps provides evidence for a multihit model of colon cancer [J]. PLoS One, 2011, 6(6): 20465.
[12]廖前进, 苏坚, 何洁, 等. 二烯丙基二硫对人结肠癌SW480细胞周期的阻滞作用 [J]. 癌症, 2009, 28(2): 138-141.
[13]颜斌, 曹仁贤, 文格波. DNA甲基化与基因转录抑制 [J].国际病理科学与临床杂志, 2006, 26(6): 524-526.
[14]ESTELLER M. Cancer epigenomics: DNA methylomes and histone-modification maps [J]. Nat Rev Genet, 2007, 8(4):286-298.
[15]谭志琴, 刘伏香, 唐海林, 等. 子宫内膜癌患者血清中hsamiR-155的表达及其临床意义 [J]. 中华妇产科杂志,2010, 45(10): 772-774.
Expression and their clinical significance of miR-222 and MBD2 in tissues of colon carcinoma
HUANG Jian-jun, GE Li-dong, ZHOU Xiu-tian, XIE Jin-long, HU Zheng-chao, ZHOU Bo, XU Wei-hua(Department of Oncology, the 169th Hospital of PLA, Hengyang Hunan 421002, China)
ZHOU Xiu-tian E-mail:xiutianzhou@yahoo.com.cn
Background and purpose:MicroRNAs are 19 to 25-nucleotide noncoding RNA molecules that regulate gene expression at the level of transcription and translation. This study investigated the expression of the miR-222 and methyl-CpG binding domain protein 2 (MBD2) in tissues of colon carcinoma and their clinical significance.Methods:Tissue specimens and adjacent tissues of 76 cases as control from Jan. 2008 to Jun. 2010 were collected,and hybridizationin situand immunohistochemistry were used to detect the miR-222 and MBD2 expression in those specimens respectively.Results:The positive expression rate of the miR-222 was 92.1% in colon carcinoma and 28.9% in adjacent comparison. The up-regulation of miR-222 expression was associated with advanced clinical stage,and the expression of miR-222 was higher with lymph node metastasis than without lymph node metastasis in colon carcinoma. The positive expression rate of the MBD2 was 19.7% in colon carcinoma and 81.6% in adjacent comparison.The down-regulation of MBD2 expression was associated with advanced clinical stage, and the expression of MBD2 was lower with lymph node metastasis than without lymph node metastasis in colon carcinoma. The expression of miR-222 had a close negative correlation to that of MBD2 in colon carcinoma (P<0.01).Conclusion:Overexpression of miR-222 might be associated with the tumorigenesis, development and metastasis by targeting MBD2, and they could be the indicators in the diagnosis and prognosis of colon carcinoma.
miR-222; MBD2; Colon carcinoma; Clinical significance
10.3969/j.issn.1007-3969.2012.01.005
R735.3+5
A
1007-3639(2012)01-0021-04
周秀田 E-mail:xiutianzhou@yahoo.com.cn
2011-05-10
2011-12-21)

