精氨酸酶在大鼠实验性牙周炎牙周组织中的表达变化
孙继军,王爱芹,高 艳
(滨州医学院附属医院口腔内科,山东 滨州 256603)
精氨酸酶(arginase,Arg)是一种双核含锰金属酶,能够催化L-精氨酸代谢生成鸟氨酸和尿素。Arg可参与细胞免疫应答和炎症反应进程,其活性和表达的增加与血管功能紊乱及由此发生的疾病有密切的关系[1]。有研究发现,牙周炎病人唾液中Arg活性明显高于健康者,而经基础治疗后其活性明显降低,但是患牙部位牙龈组织中Arg的活性在治疗后却显著升高[2]。
由于牙周组织取材困难,目前关于牙周炎中Arg表达的研究多集中在牙周炎病人的唾液和牙周炎患牙的牙龈组织中,且仅仅局限在观察Arg活性的变化方面,至今没有关于Arg在牙周炎部位的牙周组织分布及水平的相关报道。本研究通过建立不同时期、不同严重程度的大鼠牙周炎模型,获得牙周炎的病变组织,对Arg进行免疫组化定位及半定量分析,以期进一步确定Arg在牙周炎发生发展中的作用及其与牙周炎炎症程度的相关性。
1 材料和方法
1.1 主要实验材料和实验动物
兔抗人、大鼠Arg多克隆抗体以及生物素标记羊抗兔IgG、辣根酶标记链酶卵白素、胰酶消化液(上海蓝基生物科技有限公司);40只5周龄SPF级雌性Wistar大鼠(山东中医药大学实验动物中心提供,许可证号:SCXK鲁20060099,合格证号:0009576)。
1.2 牙周炎模型的建立
取体质量(200±10)g Wistar大鼠40只,按建模时间(1、2、4、6周)随机分4组,每组10只。水合氯醛(200 mg/kg腹腔注射麻醉后,以每只大鼠的右侧下颌第一磨牙为实验牙,分别用3-0丝线结扎其颈部并压入龈沟内,采用自身对照的原则,左侧同名牙不予处理作为正常对照。术后喂以Keyes 2000高糖粘性软食(果糖56%,脱质奶粉28%,面粉6%,酵母4%,苜宿粉3%,动物肝粉1%,食盐2%及少量蔬菜)[3]和高糖粘性牛奶(牛奶、水和白沙糖的体积与质量比为50∶30∶20)[4]。每日观察记录各组大鼠的活动状态、体质量、饮食、粪便等变化,同时检查结扎丝线的稳固情况及牙周状况。
1.3 临床指标观察和评价标准[5]
分别于建模后1、2、4、6周各时间点取相应组大鼠,按上述方法腹腔注射水合氯醛麻醉后,分别测量所有建模牙的松动度(TB)、龈沟出血指数(SBI)、牙周探诊深度(PD)、牙槽骨吸收值(ABL)。测量由同一实验者完成,每牙测量3次,取平均值,记录结果。
1.3.1 牙的松动度(Tooth mobility,TB)
颊舌向松动者为1;颊舌向、近中远中向均松动者为2;颊舌向、近中远中向和垂直向均松动者为3。
1.3.2 牙龈出血指数(Sulus bleeding index,SBI)
用牙周探针轻探牙龈10s,不出血为0,出血为1。
1.3.3 牙周探诊深度(probing depth,PD)
用牙周探针分别在颊侧和腭侧的近中、中间、远中6个位点测量,取平均值。
1.3.4 牙槽骨吸收值(Alveolar bone loss,ABL)
40 g/L多聚甲醛心脏灌注处死各组大鼠后取头颅,10 g/L亚甲基蓝染色,体视显微镜下(4倍)测量从釉牙骨质界到牙槽嵴顶的距离,每个牙分别测量近颊、中颊、远颊、近腭、中腭、远腭6个位点,取均值作为该牙的牙槽骨丧失值。
1.4 病理组织学观察
分别从建模1、2、4、6周,各组大鼠中各随机抽取2只大鼠,40 g/L多聚甲醛液心脏灌注内固定,取左侧下颌骨(连同受试牙及其牙周组织),甲醛固定,甲酸脱钙,乙醇梯度脱水,石蜡包埋,沿牙体长釉制成颊舌向5 μm厚的组织切片,HE染色,光学显微镜下观察牙周组织病理变化。
1.5 免疫组化观察
确定模型建立后,分别于结扎后 1、2、4、6周分批处死各组剩余8只大鼠,取双侧下颌骨组织块,甲醛固定,冲洗,置100 g/L EDTA液中脱钙1个月,漂洗,乙醇梯度脱水,石蜡包埋,沿牙体长轴制作颊舌向组织切片,片厚5μm。切片经30mL/L过氧化氢液封闭内源性酶30 min,0.01 mol/L PBS洗,羊血清封闭非特异结合位点,滴加1∶100稀释的兔抗Arg,4℃过夜,PBS洗,SP法标记相应特异性抗原,DAB显色,苏木素复染,常规脱水,透明,封片。阴性对照和空白对照分别用一抗同种血清和PBS代替一抗。
结果判定:巨噬细胞或血管内皮细胞细胞浆中出现淡黄色至棕黄色颗粒,且着色高于背景底色者为阳性,细胞胞浆内不着色或呈浅棕色背景颜色者为阴性。400倍显微镜下连续拍照,每个标本随机取5个不同视野应用图像分析系统进行阳性细胞计数,取均值。
1.6 统计学分析
2 结果
2.1 大体观察
肉眼观察,各组大鼠对照侧牙龈无红肿,无糜烂,探诊不出血,牙齿无松动,无骨丧失;各组结扎侧1周时可观察到结扎处牙龈发红、探诊易出血,无骨丧失,为牙龈炎期;2周时炎症进一步加重,部分结扎牙齿牙龈糜烂,此时可探及牙周袋,牙松动Ⅰ度,可观察到根分叉暴露,为轻度牙周炎期;4周时牙槽骨吸收加重,到根尖2/3,松动Ⅱ度,为重度牙周炎期;6周时牙周组织损害不再加重,为慢性牙周炎期。各组结扎侧临床观察指标(表1)。
表1 各组大鼠结扎侧各临床观察指标()

表1 各组大鼠结扎侧各临床观察指标()
牙龈指数 牙松动度 牙槽骨吸收值 牙周探诊深度牙龈炎炎症分期 结扎时间(周)0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 0.00 ±0.00轻度牙周炎 2 2.64 ±0.26 1.34 ±0.46 3.19 ±0.12 4.25 ±0.39重度牙周炎 4 3.23 ±0.44 2.41 ±0.57 3.89 ±0.19 5.01 ±0.48慢性牙周炎1 6 2.85 ±0.59 2.55 ±0.44 3.71 ±0.30 4.79 ±0.52
2.2 组织病理学观察结果
正常对照组:附着上皮无病理性改变,牙周膜纤维排列整齐,成牙骨质细胞排列整齐,牙槽嵴无吸收,牙槽骨无破坏。牙龈结合上皮无增生,固有层极少量炎细胞浸润(图1)。
牙龈炎期(1周):牙龈上皮无明显糜烂或溃疡,结合上皮轻度增生,固有层可见明显炎性细胞浸润,牙周膜纤维排列正常(图2)。
轻度牙周炎期(2周):牙龈组织炎症明显,结合上皮附着丧失,部分区域牙周袋壁上皮溃疡形成,固有层大量炎细胞浸润,牙周膜纤维排列紊乱,牙槽骨边缘可见明显破骨细胞和骨吸收陷窝(图3~4)。
重度牙周炎期(4周):结合上皮附着丧失,固有层内炎性细胞浸润,牙槽骨吸收严重,达根尖1/3(图5)。
慢性牙周炎期(6周)时:牙槽骨吸收超于稳定,骨边缘清晰,由于大鼠再生能力强,甚至可见部分新生牙槽骨(图6)。
2.3 免疫组化结果(图7~10)
正常对照组牙周组织中没有或偶见精氨酸酶(Arg)的阳性表达,而各实验组牙周组织中,尤其是巨噬细胞中Arg的阳性表达明显增高,阳性细胞数随炎症程度加重而增多 ,结扎4周(重度牙周炎)时达高峰,6周时有所下降。各组间两两比较差异均有统计学意义(P<0.05)(表2)。
表2 各组牙周组织中Arg阳性细胞数比较()

表2 各组牙周组织中Arg阳性细胞数比较()
不同字母组间P<0.05
阳性细胞数正常对照组 0 0.53 ±0.43组别 结扎时间(周)A牙龈炎 1 0.73 ±0.56B轻度牙周炎 2 3.28 ±1.02C重度牙周炎 4 6.36 ±0.97D慢性牙周炎 6 4.08 ±1.10E

图1 正常牙龈(HE,×100)
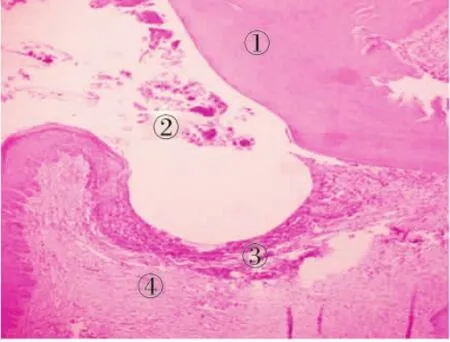
图2 牙龈炎症期(HE,×100)

图3 牙周炎症期,箭头示固有层大量炎细胞浸润(HE×200)

图4 牙周炎症期,箭头示破骨细胞和骨吸收陷窝(HE,×200)
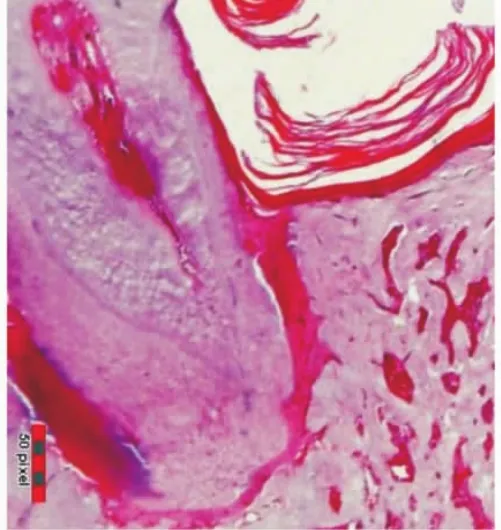
图5 重度牙周炎期,牙槽骨吸收达根尖1/3(HE,×100)

图6 慢性牙周炎期,破骨细胞和骨吸收陷窝明显减少(HE,×100)

图7 阴性对照表皮及固有层精氨酸酶阴性(×100)

图8 固有层散在阳性细胞(×100)

图9 重度牙周炎组,牙龈固有层大量阳性细胞(×200)

图10 轻度牙周炎组,牙龈固有层散在阳性细胞(×200)
3 讨论
人体内的Arg分为ArgⅠ型和ArgⅡ型,其中ArgⅠ主要存在于肝脏中,ArgⅡ作为线粒体酶在很多细胞中都有不同程度的表达[6]。本结果显示,Arg主要在巨噬细胞和血管内皮细胞中表达,其变化趋势为:健康牙周组织中偶有表达,牙龈炎、牙周炎时强阳性表达,到慢性牙周炎时期,表达较急性期有所降低。这主要是因为Arg的催化底物是L-精氨酸,而一氧化氮合酶 (Nitric oxide Synthase,NOS)也能够催化L-精氨酸生成NO,也就是说Arg与NOS竞争同一底物而相互抑制:NOS分解精氨酸产生NO过程中会生成羟基-精氨酸,而羟基-精氨酸可有效抑制Arg含量;同样,Arg可使精氨酸数量减少,而NOS的聚合和二聚均依赖精氨酸,如没有精氨酸就会产生无活性的酶和不完整的二聚酶分子。龚斌等发现,牙龈组织内NO含量与牙龈炎症程度呈明显负相关[7],本实验中Arg含量与牙周炎症程度呈正相关,提示Arg在牙周炎的发病机制中有重要作用。可能与以下方面有关:NO是一种毒性强、不稳定、易扩散、化学性质极其活泼、半衰期极短的自由基,参与循环、消化、免疫等多种系统的生理和病理过程[8]。在牙周炎时,局部活化的中性多形核白细胞能抑制NO的产生或生物学活性,导致内环境稳定调节障碍,血管内皮破坏和微循环障碍,使牙周炎进一步发展[9]。因为NO本身具有抗菌、抗炎活性,不仅能阻止血小板凝集,调节血管平滑肌反应,保持血管间隔完整性,还可增强口腔内一些组织的血管传导性;并能调节或调整机体的免疫功能,对维持口腔内正常菌群与宿主的共生关系及增强口腔和消化道抵抗病原微生物的能力均起到重要作用[9]。
本结果提示,牙周炎时牙龈组织中Arg的阳性计数升高,含量增加,使得牙龈组织中NO生成减少,细菌易感性升高,抵抗病原微生物的能力下降,血小板凝集,血管通透性增高,炎症渗出物增加,加重牙龈组织的炎症。同时Arg参与尿素循环,可催化L-精氨酸代谢产生鸟氨酸和尿素,而鸟氨酸是多胺的前体,多胺是许多细菌的营养物质[10],牙周炎时牙龈组织中的Arg增加,会使代谢产物鸟氨酸含量增加,最终导致多胺生成增多,从而促进细菌生长,加重牙周炎症疾病的进程。
[1]刘兰兰,王友群.精氨酸酶对血管功能的影响及相关药物研发[J].药学进展,2009,33(12):536 -541.
[2]Ugar-Cankal D,Ozmeric N.A multifaceted molecule,nitric oxide in oral and periodontal diseases[J].Clinica Chimica Acta,2006,366(2):90 -100.
[3]Caillon P,Saffar JL.Improvement of gingival and alveolar bone status in periodontitis-affected hamsters treated with 15 -methyl prostaglandin E1[J].J Periodont Res,1994(3),29:138 -142.
[4]邵长江,马永秀,张成安,等.内毒素滴注法建立牙周炎动物模型[J].临床口腔医学杂志,2010,26(9):531-533.
[5]曹采方.牙周病学[M]北京:人民卫生出版社,2000:126-127.
[6]Jenkinson CP,Grody WW,Cederbaum SD.Comparative properties of arginases[J].Comp Biochem Physiol B Biochem Mol Biol,1996,114(1):107 -132.
[7]龚斌,徐立平,欧炯光,等.实验性牙周炎动物模型牙龈组织一氧化氮含量的检测分析[J].医学研究杂志,2007,36(8):66-67.
[8]戚慧,龚斌,雷雅燕.一氧化氮及一氧化氮合酶与牙周组织疾病[J].昆明医学院学报,2009,S1,112 -115.
[9]袁晓琴,孙莲芬.一氧化氮及其合酶在口腔疾病中的作用研究进展[J].新医学,2008 ,39(11):756-757.
[10]Grandvaux NF,Gaboriau J,Harris BR,et al.Regulation of arginaseⅡby interferon regulatory factor 3 and the involvement of polyamines in the antiviral response[J].FEBS J,2005,272(12):3120-3131.

