合成甘脲和四羟甲基甘脲工艺条件的研究
刘爱花,薛永强
(太原理工大学 化学化工学院,太原030024)
甘脲和四羟甲基甘脲主要用于水性涂料的交联剂、工业防霉剂、混凝土外加剂。添加了甘脲(或)甘脲衍生物涂料的附着力、脱脂亲水性和分散性都有明显提高,涂膜的稳定性能也有显著提高[1]。另外,在涂料中甘脲和四羟甲基甘脲往往还可以做增白剂和增光剂,同时增强涂料的耐磨性[2]。
由于甘脲及其衍生物的分子结构组成具有多样性,因而可以应用于多种领域[10],如分子药物胶囊[11]、分子修剪[12]、多酮生物合成[13]等,特别是在超分子化学中甘脲的应用越来越广泛。
在国外,甘脲和四羟甲基甘脲已经进行了规模化生产,但是在国内研究得比较少,还没有规模化生产的厂家。关于四羟甲基甘脲的研究还处于空白。本研究的目的在于找出合成甘脲和四羟甲基甘脲的最佳工艺条件。
1 实验部分
1.1 甘脲的合成原理
以尿素和乙二醛为原料,在酸性条件下合成甘脲,反应方程式如下:
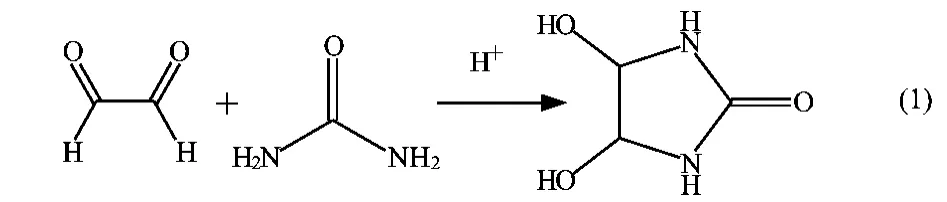

由反应式(1)和反应式(2)可见,甘脲的合成经历了两个过程:首先是一个尿素分子和一个乙二醛分子在酸性条件下反应,形成带有两个相邻羟基手臂的五元环;接着这个五元环继续和另外一个尿素分子反应脱水得到甘脲。整个过程为酸催化脱水缩合反应,这个反应易发生副反应生成线形缩脲。副反应的反应方程式如下:

结合反应式(1),(2),(3)可以看出,尿素过量有利于抑制副反应的进行。
1.2 四羟甲基甘脲的合成原理
以甘脲和甲醛溶液为原料,在碱性条件下合成四羟甲基甘脲,反应方程式如下:
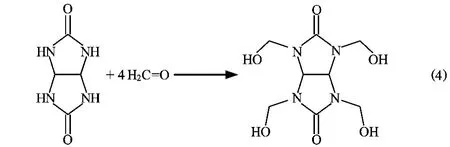
由反应式(4)可见,1mol的甘脲和4mol甲醛反应,甲醛上的C=O双键断开形成了4个连接在N原子上的手臂。由于取代是逐步进行的,所以很有可能会形成不完全的取代产物,比如三羟甲基甘脲,故要使该反应的副产物最少,必须使甲醛过量。
1.3 甘脲和四羟甲基甘脲的制备
1.3.1 实验步骤
称取尿素,用蒸馏水溶解。调节尿素溶液的pH值在1~2之间;加入安装有搅拌器、冷凝管和滴液漏斗的三口烧瓶中;温度控制在40~60℃之间;然后缓慢滴加乙二醛持续1h左右;滴加完毕再继续搅拌大约5h左右。反应结束后,抽滤,用稀NaOH溶液和蒸馏水各洗涤2~3次,滤饼于80℃下干燥24h,即得到甘脲产物。
称取14.2g甘脲,并量取一定量的甲醛,用稀NaOH溶液调节pH值在9.5~10之间;加入安装有搅拌器、冷凝管和温度计的三口烧瓶中;在水浴上加热,温度控制在50℃,反应1~2h;然后将上述反应液倒入圆底烧瓶,温度控制在65℃,采用减压蒸馏;把蒸馏完毕留下的浓缩液倒入盛有甲醇的烧杯中,搅拌至固体析出;进行抽滤,用甲醇洗涤2~3次,滤饼放入烘箱,干燥24h,即得到产品。
2 结果及分析
2.1 影响甘脲合成的因素
2.1.1 pH值对甘脲产率的影响
保持其他条件恒定,改变尿素溶液的pH值测得产物的产率,可见pH值在1.3时甘脲的产率最大。导致这样结果的原因可能是pH值减小,酸性增强,从而有利于缩合和脱水反应的进行;pH值增大产率下降的原因可能是由于酸性减弱导致了尿素水解,即
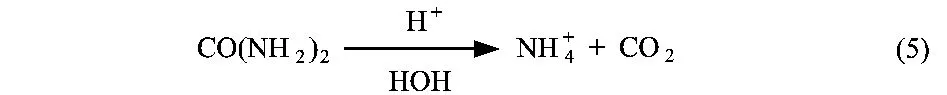
2.1.2 加料速度对甘脲产率的影响
保持其他条件恒定,改变乙二醛滴加速度测得产物的产率,可见滴加时间在该反应中影响显著。当滴加时间从2min延长到40min时,甘脲的产率提高40%,由此可得滴加速度的快慢直接反应了尿素/乙二醛的有效配比和脱水反应速度;缓慢滴加既可以加大尿素/乙二醛的摩尔比,又可以使缩合和脱水有足够的反应时间,因而甘脲的产率明显提高。
2.2 合成四羟甲基甘脲的结果分析
2.2.1 合成甘脲正交试验数据分析
由于形成甘脲的环化反应是一个脱水缩合反应,因而升高温度显然有利于脱水环化,但是实验中发现当反应温度到达70℃时,反应产物呈黄色。而甘脲产物本应为白色或者略带浅黄色的固体。可见反应温度70℃时产物中含有大量杂质,故反应温度选择在60℃以下。当反应温度在35℃以下时,反应很难进行,产率极其低,并且产物亦为黄色,故正交实验反应温度应设定在40~60℃。在pH=1~2,滴加时间为40min,取40%的乙二醛水溶液36.5 mL的情况下,按下表进行正交实验,以求找出最佳反应条件。

表1 合成甘脲正交试验因素水平表
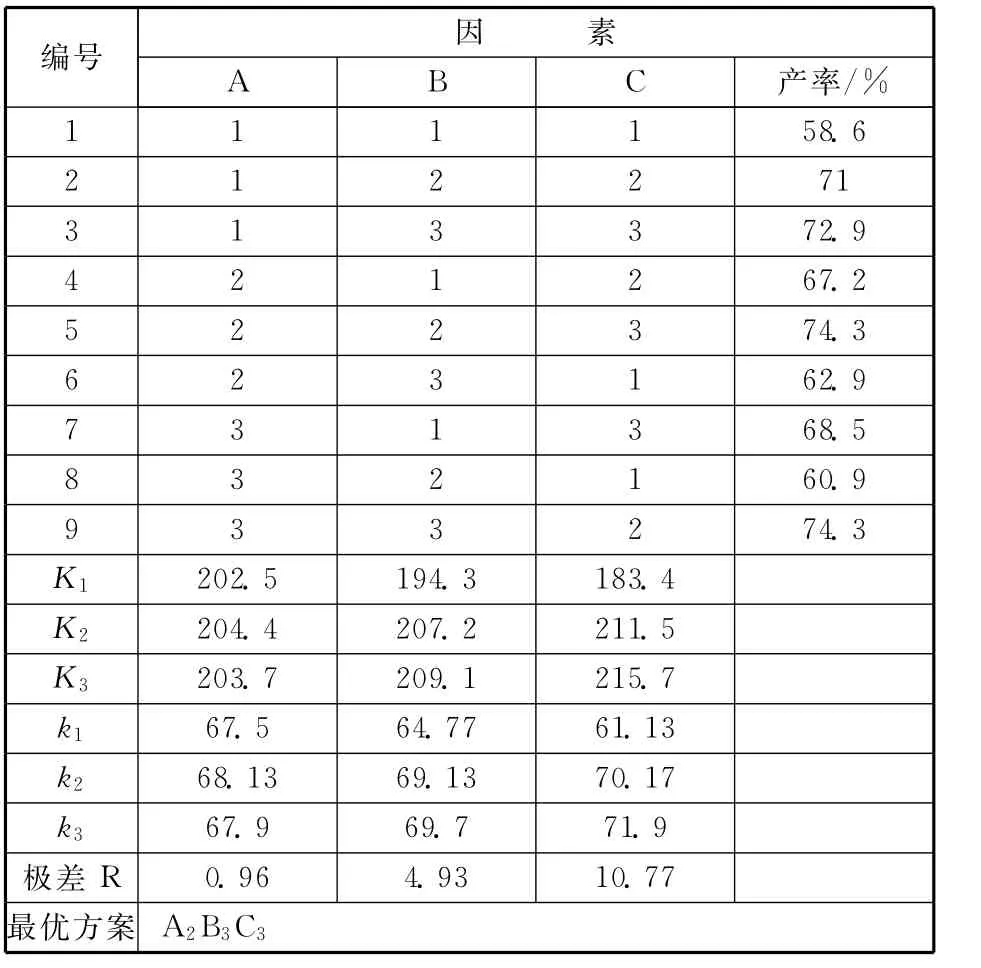
表2 合成甘脲正交分析表
表2中,设A代表温度t/℃;B代表反应时间ts/h;C代表反应摩尔比。从表中可以看出,A2B3C3为最优组合,从中看出三水平上的产率差距很小。通过实验,对组合做了简单的调整,找出一个适合工业生产的最佳反应条件。最佳合成条件为:反应温度50℃,反应时间4h,反应摩尔比2.5∶1,该条件下产率(质量分数)为75%,纯度为95%。
2.2.2 合成甘脲的液相色谱分析
用液相色谱,光的波长取200nm,流动相使用体积分数为87%的甲醇与13%的水混合溶液,使用面积归一法来测定产物中甘脲的含量。其结果如图1所示。由图1可以看出,通过正交试验找到的最佳合成条件下合成的甘脲纯度(质量分数)可以达到95%。
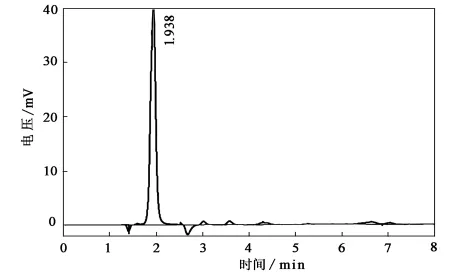
图1 最佳条件的液相色谱图
2.2.3 甘脲的红外分析
图2为产物的红外谱图。由图可知,与红外标准谱图对比看到:
在2 800cm-1峰为NH的吸收峰,1 700cm-1处强而尖的峰是—CO的吸收峰;1 500cm-1峰和800cm-1峰为—C—C—的吸收峰;1 300cm-1处的是—C—N—的吸收峰,3 300cm-1左右的峰为仲氨基的吸收峰。根据FT-IR谱图可判定主要产物为甘脲。

图2 产物红外谱图
2.2.4 甘脲的紫外分析
将图3与紫外标准谱图对照,最大吸收峰都出现在波长为191.5nm的地方,说明实验的合成产物为甘脲。
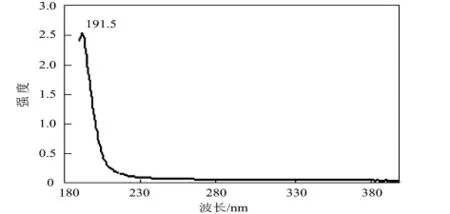
图3 产物的紫外谱图
2.3 影响四羟甲基甘脲合成的因素
2.3.1 pH值对四羟甲基甘脲产率的影响
四羟甲基甘脲的合成必须在碱性条件下进行,如果在酸性条件下会发生如下反应:

由反应式(6)可见,pH值在四羟甲基甘脲的合成过程中有着严格的要求。保持其他反应条件恒定,改变甲醛溶液的pH值,测得产物的产率,可见当pH值在9.8时四羟甲基甘脲的产率最大;而当pH值小于9.0时,反应基本不能进行;当pH值大于10.5时,产率急剧降低。故反应应控制在pH=9.5~10之间。
2.3.2 反应时间对四羟甲基甘脲产率的影响
固定甘脲14.2g和甲醛55mL,调节pH=9.5~10之间,反应温度60℃,甲醇用量60mL。实验测得反应时间对四羟甲基甘脲产率的影响,可见当反应时间大于1.5h时四羟甲基甘脲的产率才趋于平稳。
2.3.3 浓缩的方法对四羟甲基甘脲产率的影响
当甘脲和甲醛反应完毕后,需要对所得溶液进行浓缩。实验证明,如果直接进行常压蒸馏浓缩后加甲醇的方法不能使四羟甲基甘脲固体析出,必须用减压蒸馏的方法才能最终得到四羟甲基甘脲固体。当浓缩的压强达到10kPa,加热温度为55℃时,即可把溶液中混有的水分和多余的甲醇、甲醛都蒸馏出来。实验证明,当浓缩不完全时会使产率大大降低。
2.4 合成四羟甲基甘脲的结果分析
2.4.1 正交实验数据分析
四羟甲基甘脲是在甘脲的4个N上分别加上一个羟甲基,羟甲基来源于甲醛,1mol甘脲和4 mol甲醛反应。实验发现,当温度低于30℃时,反应几乎不能进行;而反应温度达到60℃时,产物颜色为黄色。故正交试验设计中,固定甘脲14.2g,反应温度应在30℃到50℃之间。在固定反应时间为1.5h,pH=9.5~10.5,设计的正交实验表以及实验结果如表3所示。

表3 四羟甲基甘脲正交试验因素水平表
表4中,设A代表甲醛的用量V/mL;B代表反应温度t/℃;C代表甲醇的用量V/mL。可以看出,A3B2C1为最优组合。也就是甲醛55mL、反应温度40℃、甲醇40mL时是最优组合。
表4 四羟甲基甘脲合成正交分析表
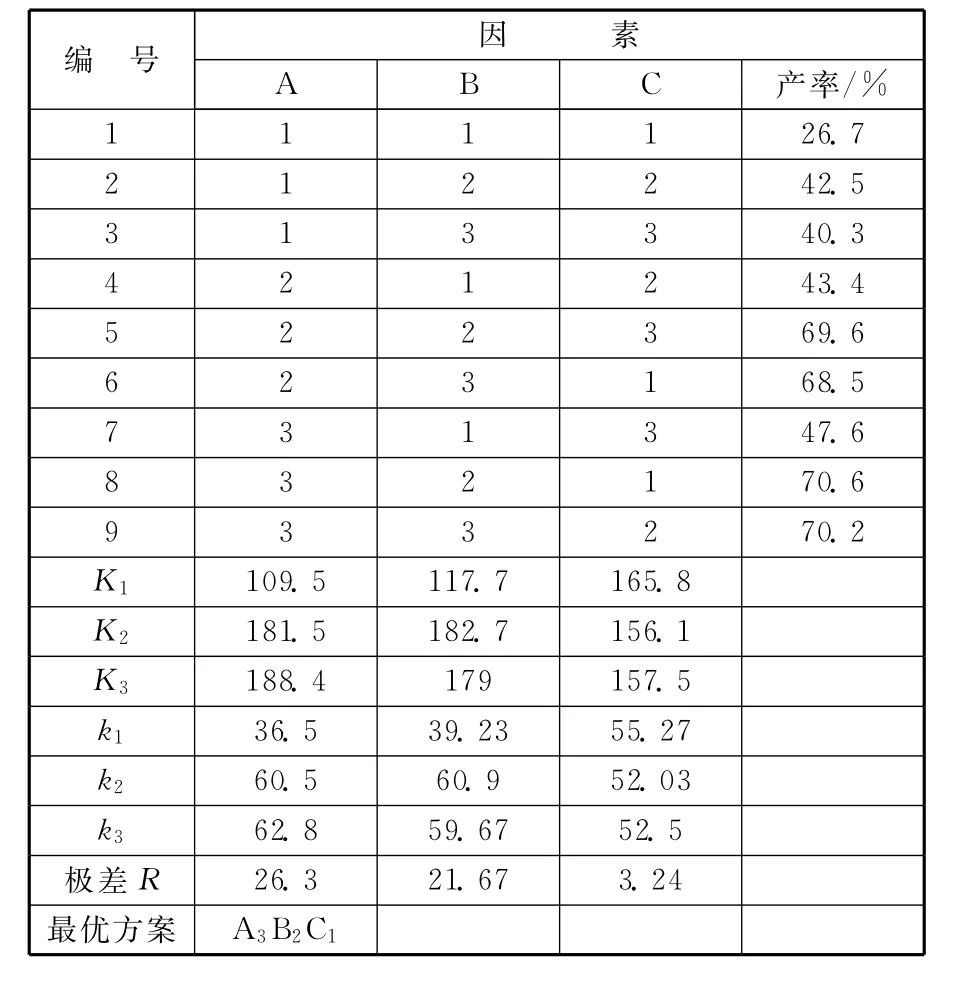
编 号 因 素A B C 产率/%1 1 1 1 26.7 2 1 2 2 42.5 3 1 3 3 40.3 4 2 1 2 43.4 5 2 2 3 69.6 6 2 3 1 68.5 7 3 1 3 47.6 8 3 2 1 70.6 9 3 3 2 70.2 K1 109.5 117.7 165.8 K2 181.5 182.7 156.1 K3 188.4 179 157.5 k1 36.5 39.23 55.27 k2 60.5 60.9 52.03 k3 62.8 59.67 52.5极差R 26.3 21.67 3.24最优方案 A3B2C1
通过增加少量实验,对正交实验上进行简单调整,可得到适合工业化生产的最佳方案,反应条件如下:甲醛50mL,反应温度40℃,甲醇35mL,该条件下得到的产率(质量分数)为71%。
2.4.2 四羟甲基甘脲的液相色谱分析
用液相色谱,光的波长取200nm,流动相使用体积分数为87%的甲醇和13%的水混合溶液,使用面积归一法来测定产物中四羟甲基甘脲的含量,结果见图4所示。
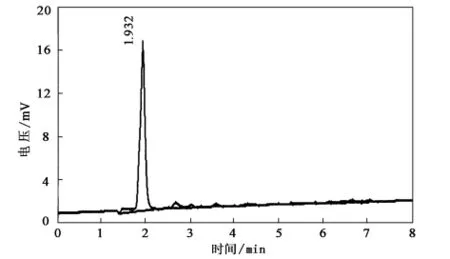
图4 最佳反应条件下产物的液相谱图
从图4谱图看出,合成的四羟甲基甘脲(质量分数)纯度接近90%。在停留时间为2.665min的地方有一个较大的峰,峰面积占4%以上,其产物的最大的可能性为尿素和乙二醛合成的长链聚合物。
3 结论
1)尿素和乙二醛在酸性条件下合成甘脲,最佳酸度为pH=1~2,最佳反应摩尔比为2.5∶1,反应时间为4h,反应温度为50℃。产率(质量分数)可以到达75%,纯度可以达到95%。
2)甘脲和甲醛在碱性条件下合成四羟甲基甘脲,最佳pH=9.5~10.5,最佳反应摩尔比为1∶6,反应时间为1.5h,反应温度为40℃。反应产率可以到达70.5%,纯度90%。
3)减压蒸馏浓缩对四羟甲基甘脲的合成有决定性影响,不能用常压蒸馏取代。
[1] 张伟,潘春跃,程化,等.甘脲的合成及其在水性涂料中的应用[J].热固性树脂,2007,22(4):29-31.
[2] Miyahara Y,Abe K,Inazu T.Angew Chem Int Ed,2002,41:3020.
[3] 庞来兴,杨建文,曾兆华,等.涂料工业的世纪进展——绿色涂料[J].广州化工,2001,29(4):3-6.
[4] 李红生,王文丽.涂料工业的现状及发展趋势[J].化工科技市场,2002(4):21-23.
[5] 肖新颜,夏正斌,陈焕钦,等.环境友好涂料的研究新进展[J].化工学报,2003,54(4):531-537.
[6] 廖文波,魏争,蓝仁华.绿色环保涂料的发展方向[J].广东化工,2008,35(1):52-55.
[7] 韩要星,吴秋芳.粉末涂料制造工艺及其技术研究进展[J].试验与研究,2003(1):9-12.
[8] 方震.浅谈涂料、涂装技术的发展方向[J].江苏电器,2001(2):37-40.
[9] 张华生.持续竞争的中国粉末涂料行业——从2006中国粉末涂料与涂装行业年会看中国粉末涂料行业的发展[J].中国涂料,2007,22(01):11-13.
[10] Kolbel M,Menger F M.Materials based on glycoluril[J].Adv Mater,2001,13(14):1115-1119.
[11] Hof F,Craig S L,Nuckolls C,et al.Molecular encapsulation[J].Angew Chem Int Ed,2002,41(9):1488-1508.
[12] Rowan A E,Elemans W J A A,Nolte R J M.Molecular and supramolecular objects from glycoluril[J].Acc Chem Res,1999,32(14):995-1006.
[13] Pryor K E,Rebek J.Multifunctionalized glycolurils[J].Org Lett,1999,1(1):39-42.
[14] 向双春,文彬,陶朱.合成瓜环的中间体——新型甘脲的合成.贵州大学学报,2005,22(1):28-30.
[15] 罗绪强,张桂玲,薛赛凤,等.一类新型功能材料化合物——瓜环的合成与分离研究进展[J].贵州化工.2003,28(4):1-4.
[16] 夏宇正,焦书科.甘脲的合成与鉴定[J].北京化工学院学报,1990,17(3):73-76.

