酸性离子液体[bmim]HSO4催化纤维素水解的研究
芦天亮, 秦志芳, 唐 思, 周利鹏, 苏运来, 杨晓梅
(郑州大学 化学系 河南 郑州 450001)
0 引言
煤、石油、天然气等化石资源是人类赖以生存和发展的主要能源,其消耗量占目前世界能源消耗总量的3/4[1].为解决化石资源总量减少和全世界对能源需求量迅速增加的矛盾,以及利用化石资源引起的环境和气候问题,寻求清洁、可循环的替代能源迫在眉睫.生物质具有可再生性、二氧化碳零排放以及较低的硫含量等优点[2-3],是理想的替代能源.纤维素是自然界中生物质的最主要存在形式,然而目前只有11%的纤维素被人类所利用,大部分被微生物降解后参与自然界中碳循环,所以如何利用纤维素成为目前的研究热点.纤维素水解经由葡萄糖可以得到生物燃料和多种化学品.但是,纤维素规整的线性结构及分子内和分子间存在的大量氢键决定了其具有非常稳定的物理化学性质[4].因此,传统溶剂对于纤维素的溶解能力非常差,极大地限制了纤维素水解反应的进行.Swatloski等[5]在2002年发现离子液体1-正丁基-3-甲基氯代咪唑([bmim]Cl)对纤维素有较好的溶解作用,为纤维素的绿色水解奠定了基础.自此,以离子液体为溶剂进行纤维素水解的研究迅速开展起来,采用的催化剂可以分为固体催化剂和均相催化剂.使用的固体催化剂主要有酸性树脂、分子筛等[6-8],但是,由于固体催化剂本身受传质、酸量、酸强度等因素的限制,使得其催化纤维素水解的效率较低.相反,均相体系水解纤维素取得了较好的结果.Amarasekara等[9]利用1-丙基磺酸-3-甲基氯代咪唑等酸性离子液体作为溶剂和催化剂进行纤维素的水解,还原糖收率最高可以达到62%.而Li等[10]利用[bmim]Cl作为溶剂,以无机酸为催化剂进行纤维素水解反应,还原糖收率可达77%.但是使用无机酸为催化剂不但对设备要求高,而且污染环境.姜锋等[11]利用[bmim]Cl为溶剂,二甲基甲酰胺为共溶剂,1-丁基磺酸-3-甲基氯代咪唑为催化剂进行纤维素水解,取得了较高的转化率(100%)和还原糖收率(95%),但是共溶剂的加入使体系变得更加复杂.
作者以[bmim]Cl为溶剂,以1-正丁基-3-甲基硫酸氢根代咪唑([bmim]HSO4)为催化剂,考察了实验条件对纤维素水解反应中还原糖收率的影响,结果表明,在优化条件下还原糖收率可达90%以上.
1 实验部分
1.1 离子液体的制备
1.1.1[bmim]Cl的制备 参照文献[12]制备[bmim]Cl,具体步骤如下:将重蒸过的N-甲基咪唑和1-氯代正丁烷(物质的量比为1∶1.29)加入到四口瓶中.在氮气气氛、机械搅拌条件下,70 ℃回流反应48 h.反应完成后,旋转蒸发除去过量的1-氯代正丁烷.最后将所得产品转移至真空干燥箱中,80 ℃干燥3 h.
1.1.2[bmim]HSO4的制备 采用[bmim]Br与硫酸反应制备[bmim]HSO4.[bmim]Br的合成方法与[bmim]Cl基本相同,除了用1-溴代正丁烷代替1.1.1中的1-氯代正丁烷.参照文献[13]制备[bmim]HSO4,具体步骤如下:将质量分数98%的浓硫酸滴加到[bmim]Br(物质的量比为1∶1)中,加热至90 ℃反应6 h.将副产物HBr通入到水中,用NaOH溶液滴定的方法监测反应.最后将所得产品转移至真空干燥箱中,80 ℃干燥3 h.
1.2 纤维素的水解反应
参照文献[11],将4 g [bmim]Cl和0.15 g纤维素(MN300,德国Macherey-Nagel公司)加入烧瓶中,在相应的纤维素水解反应温度下磁力搅拌一段时间使纤维素溶解.然后加入[bmim]HSO4和去离子水,并开始计时.每隔一段时间取样,每次取0.11 g反应液于离心管中,并用NaOH溶液中和,然后离心分离,取上层液体进行还原糖浓度的测定.
1.3 总还原糖(TRS)的测定
以3, 5-二硝基水杨酸(DNS)试剂为显色剂,采用比色法测定还原糖浓度.具体步骤如下:取0.5 mL待测液于试管中,加入0.5 mL DNS试剂,100 ℃反应20 min,反应结束后迅速冷却,并用去离子水定容至5 mL.最终在721型分光光度计上采用固定波长511 nm进行比色分析.
2 结果与讨论
2.1 纤维素溶解时间对水解的影响
由于纤维素是纤维二糖的线性聚合物,并且其自身存在大量的分子内和分子间氢键,因此纤维素在离子液体中的溶解主要是其自身氢键打开的过程[14],氢键打开完全与否对纤维素水解过程有重要影响.实验过程中发现,纤维素加入到离子液体中4 h后白色固体(纤维素)会完全消失.为了验证此时纤维素确实溶解完全,延长溶解时间至16 h.当催化剂用量为1.5 g,水量为0.1 mL,溶剂为5 g,纤维素用量为0.15 g,反应温度为90 ℃时,溶解时间对纤维素水解反应的影响见图1.可以看出,纤维素的溶解时间从4 h 延长到16 h,对纤维素水解影响不大.因此,在接下来的实验中纤维素的溶解时间均固定在4 h.
2.2 反应温度对水解的影响
图2为反应温度对纤维素水解的影响结果.可以看出,当反应温度为70 ℃时,还原糖生成速率较低,收率随着时间的延长而缓慢增加,反应330 min后,还原糖收率只有58%.当反应温度升高到90 ℃时,还原糖生成速率显著提高,只需80 min还原糖浓度便可达到峰值,收率达到92%.反应温度进一步升高到110 ℃时,反应速率进一步提高,在30 min时还原糖收率就可以达到90%.

图1 溶解时间对还原糖收率的影响Fig.1 The effect of dissolution time on the yield of TRS

图2 反应温度对还原糖收率的影响Fig.2 The effect of temperature on the yield of TRS
从图中还可以看出,在反应初期,随着反应时间的延长,还原糖收率迅速增加;到达最大值后,随着反应时间的进一步延长还原糖收率逐渐下降.纤维素的降解过程包括纤维素水解为还原糖和还原糖降解的过程,即

葡萄糖作为中间产物,所以其收率存在最大值.酸性条件下,在[bmim]Cl中,纤维素水解的表观活化能((108±5) kJ/ mol)小于葡萄糖降解的表观活化能((114±6) kJ/ mol)[15].因此,较高的反应温度会使葡萄糖降解速率增加较多,从而使还原糖最大收率降低.所以,在此后的实验中,反应温度均选定为90 ℃.进一步对该温度条件下反应的动力学参数进行了研究,TRS的收率设为y,图3为ln(1-y)与反应时间的关系图,可以看出,该条件下的纤维素水解过程可视为一级反应,水解反应的速率常数k1为3.31×10-3min-1.
2.3 催化剂用量对水解的影响
催化剂用量对还原糖收率的影响结果见图4.当[bmim]HSO4的加入量为1.3 g时,随着反应时间的延长,还原糖浓度不断升高,在140 min的时候达到峰值,收率为89%.而当[bmim]HSO4的加入量增加到1.5 g时,还原糖生成速率明显加快,还原糖收率只需80 min就可以达到峰值92%.继续增加酸量到1.7 g时,还原糖生成速率反而有所下降,并且最大收率也降到了79%.在酸量较低时,纤维素水解生成葡萄糖的过程占主导地位,因而随着催化剂用量的增加,反应速率加快;但是在催化剂用量较大时,产物还原糖的降解速率增加很快,从而导致还原糖的收率降低.可见,酸量对纤维素的水解影响很大,只有适当的酸量才能保证较好的还原糖的收率.在本实验中,酸量的最佳值为1.5 g.
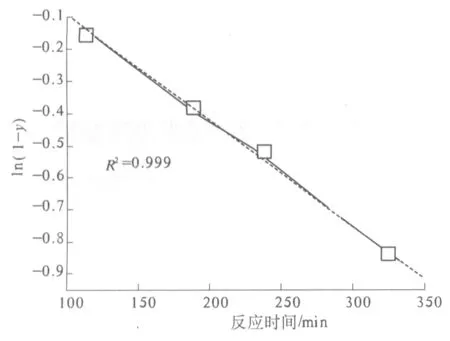
图3 90 ℃时纤维素水解反应的ln(1-y)与时间的关系Fig.3 Variation of ln(1-y) against reaction time during the hydrolysis of cellulose at 90 ℃

图4 催化剂用量对还原糖收率的影响Fig.4 The effect of catalyst amount on the yield of TRS
2.4 水量对水解的影响
图5是水量对纤维素水解的影响结果.可以看出,水量对水解速率有很大影响.随着水量由0.1 mL增加到1.0 mL,还原糖的生成速率以及还原糖收率峰值都急剧下降.当水量为0.1 mL时,经过80 min还原糖收率即可达到最大值92%.水量为0.5 mL时,经过140 min 还原糖收率达到峰值68%.而当水量为1.0 mL时,经过390 min,还原糖收率只有22%.姜锋等[11]认为水量增加导致还原糖最大收率下降是由于水量的增加降低了体系的酸性.对此进行了验证实验.当增加水量时,通过增加酸量从而保证体系的酸性不变,实验结果见图6.可以看到,在维持体系酸性不变的条件下,当水量从0.1 mL增加到0.5 mL时,还原糖收率最大值以及还原糖生成速率均有所下降.由此可以推断,体系酸性的降低并不是水量增加导致还原糖最大收率下降的主要原因.Mazza等[16]研究了水对纤维素在离子液体中溶解的影响,认为水量的增加会降低纤维素在离子液体中的溶解度,过量的水甚至会使原本溶解的纤维素重新析出,而纤维素能否溶解完全对其水解过程有重要影响.所以,水量的增加导致还原糖收率最大值以及还原糖生成速率降低的主要原因是其降低了纤维素在[bmim]Cl中的溶解度.
2.5 存在的问题及解决思路
虽然[bmim]HSO4可以有效地催化纤维素的水解反应,但是同其他的均相催化体系一样,也存在催化剂分离、循环使用困难的缺点,并且该方法的催化剂用量较大,因而开发高效的、催化纤维素水解的固体催化剂成为亟待解决的问题.在设计固体催化剂时,鉴于纤维素分子的体积较大,除了考虑酸量、酸强度外,如何使纤维素分子接近这些酸性位也是必须考虑的问题.具有大的孔径或较高的外比表面积的强酸性固体材料,可能成为最受关注的纤维素水解的固体催化剂.

图5 水量对还原糖收率的影响Fig.5 The effect of water amount on the yield of TRS

图6 相同pH值条件下水量对还原糖收率的影响Fig.6 The effect of water amount on the yield of TRS at equivalent pH value
参考文献:
[1] Stöcker M. Biofuels and biomass-to-liquid fuels in the biorefinery: catalytic conversion of lignocellulosic biomass using porous materials[J]. Angew Chem Int Ed, 2008, 47(48): 9200-9211.
[2] Cadenas A, Cabezudo S. Biofuels as sustainable technologies: perspectives for less developed countries[J]. Technol Forecast Social Change, 1998, 58(1/2): 83-103.
[3] Demirbas A. The importance of bioethanol and biodiesel from biomass[J]. Energy Sources: Part B, 2008, 3(2): 177-185.
[4] Lima M M D, Borsali R. Rodlike cellulose microcrystals: structure, properties, and applications[J]. Macromol Rapid Comm, 2004, 25(7): 771-787.
[5] Swatloski R P, Spear S K, Holbrey J D, et al. Dissolution of cellose with ionic liquids[J]. J Am Chem Soc, 2002, 124(18): 4974-4975.
[6] Rinaldi R, Palkovits R, Schüth F. Depolymerization of cellulose using solid catalysts in ionic liquids[J]. Angew Chem Int Ed, 2008, 47(42): 8047-8050.
[7] Amarasekara A S, Owereh O S. Synthesis of a sulfonic acid functionalized acidic ionic liquid modified silica catalyst and applications in the hydrolysis of cellulose[J]. Catal Commun, 2010, 11(13): 1072-1075.
[8] Zhang Zehui, Zhao Zongbao. Solid acid and microwave-assisted hydrolysis of cellulose in ionic liquid[J]. Carbohydr Res, 2009, 344(15): 2069-2072.
[9] Amarasekara A S, Owereh O S. Hydrolysis and decomposition of cellulose in bronsted acidic ionic liquids under mild conditions[J]. Ind Eng Chem Res, 2009, 48(22): 10152-10155.
[10] Li Changzhi, Zhao Zongbao. Efficient acid-catalyzed hydrolysis of cellulose in ionic liquid[J]. Adv Synth Catal, 2007, 349(11/12): 1847-1850.
[11] 姜锋,马丁,包信和.酸性离子液体中纤维素的水解[J].催化学报,2009,30(4):279-283.
[12] Huddleston J G, Visser A E, Reichert W M, et al. Characterization and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation[J]. Green Chem, 2001, 3(4): 156-164.
[13] Xiong Wanming, Zhu Manzhou, Deng Li, et al. Esterification of organic acid in bio-oil using acidic ionic liquid catalysts[J]. Energy Fuels, 2009, 23(4): 2278-2283.
[14] Pinkert A, Marsh K N, Pang S, et al. Ionic liquids and their interaction with cellulose[J]. Chem Rev, 2009, 109(12): 6712-6728.
[15] Rinaldi R, Meine N, vom Stein J, et al. Which controls the depolymerization of cellulose in ionic liquids: the solid acid catalyst or cellulose?[J]. ChemSusChem, 2010, 3(2): 266-276.
[16] Mazza M, Catana D A, Vaca-Garcia C, et al. Influence of water on the dissolution of cellulose in selected ionic liquids[J]. Cellulose, 2009, 16(2): 207-215.

