外加低压稳恒直流电场对兔腹主动脉球囊损伤后血管新生内膜增生的影响
刘志涛, 张 萍, 何国祥, 刘建平
(第三军医大学西南医院心血管内科, 重庆 400038)
经皮冠状动脉介入(percutaneous coronary intervention, PCI)治疗术对动脉的损伤会引起一系列的变化, 导致靶病变处血管新生内膜形成及增生,造成再狭窄(restenosis, RS)。血管平滑肌细胞(vascular smooth muscle cells, VSMCs)的增殖和迁移是 RS 的主要病理机制[1]。组织损伤后伤口及其附近上皮存在的损伤电流场源是一种稳恒直流电场,部分离体实验也发现, 外加电场可以影响内皮细胞和VSMCs的增殖、迁移以及细胞的排列[2]。本研究探讨外加稳恒直流电场对兔腹主动脉球囊损伤后新生内膜增生的影响及其意义。
1 材料与方法
1.1 实验动物及分组
健康日本大耳白兔 65只, 雌雄不限, 体质量(1.98±0.23)kg, 由第三军医大学实验动物中心提供。动物实验依照第三军医大学动物实验委员会许可的协议进行。随机分为正常对照组(n=5)、假手术组(n=24)及实验组(n=36)。假手术组与实验组手术过程完全相同, 也埋置电极但不给予电场刺激。假手术组及实验组分别观察至术后1天、1周、2周以及4周, 实验组根据施加电场强度不同分为3.0V/cm和4.0V/cm两个亚组, 术后第2天开始电治疗。
1.2 主要试剂、材料和仪器
HE染色; 天狼猩红购自海泛柯生物科技有限公司; 鼠抗兔Ⅰ型胶原单克隆抗体购自 Abcam 公司; 鼠抗兔Ⅲ型胶原单克隆抗体购自 Calbiochem公司; GAPDH(V-18)购自Santa Cruz公司; WYJ数字显示高精度直流稳压电源购自上海山杰科技有限公司; Western blot凝胶成像系统购自Bio-Rad公司; 显微镜下图像应用 Olympus BX51显微图像采集系统采集; 图像分析均使用Image Pro Plus 6.0图像分析软件; Western blot结果分析使用 Quangtity One软件。自制铂电极(电极直径0.40 mm, 长20 mm,导线长约30 cm)。
1.3 动物模型构建
兔经耳缘静脉注射3%戊巴比妥1ml/kg麻醉。分离兔右侧股动脉约 2~3cm 长, 纵向逐层切开下腹壁暴露腹腔, 显示腹主动脉下段与髂总动脉分叉处。从股动脉插入带有PTCA导丝支持的2.5 mm×20.0 mm PTCA球囊, 推送至腹主动脉下段, 使球囊头端距离腹主动脉分叉处5.0 cm。球囊加压至12标准大气压(atmospheric pressure, atm)后, 回拉球囊直至髂总动脉分叉处, 然后释放压力。以上过程共3次, 每次间隔时间1min。术毕, 撤出球囊导管, 结扎股动脉近端。将两针状铂电极分别插入兔腹主动脉两侧腰大肌缝扎固定, 保持两电极平行, 电极距离腹主动脉约 1cm, 电极下端与腹主动脉与髂动脉分叉处持平。将两电极导线通过皮下隧道引至兔颈后,缝扎固定于体外。庆大霉素溶液冲洗腹腔后, 逐层缝合皮下及皮肤, 青霉素400 000U肌内注射3d。
1.4 血管新生内膜增生的观察
将 10%中性甲醛固定的血管组织常规石蜡包埋,切片, HE染色后显微镜下观察, 通过计算机图像分析软件Image Pro Plus 6.0分析内膜、中膜面积, 计算内膜/中膜面积比值。
1.5 天狼猩红染色
将石蜡包埋的血管组织切片, 用天狼猩红染色,在暗视野条件下, 偏振光显微镜观察。天狼猩红染色后, 胶原纤维呈现不同的折光性和颜色, Ⅰ型胶原纤维紧密排列, 显示很强的双折光性, 为黄色或红色的纤维。Ⅱ型胶原纤维有弱的双折光性, 为各种不同颜色的疏松网状。Ⅲ型胶原纤维显示弱的双折光性, 呈绿色的细纤维。
1.6 Western blot测定血管组织I型、III型胶原蛋白表达
血管组织中总蛋白提取后, 蛋白质定量绘制标准曲线, 测定样品浓度, 灌制 10%SDS-PAGE, 上样量为 30μg, Bio-Rad公司 Mini系电泳槽进行电泳,转至 PVDF膜, 加入一抗、二抗等系列操作后用凝胶扫描成像系统扫描成像, 并用Quantity One-4.4.0图像分析软件进行分析, 蛋白表达量以“目的蛋白/GAPDH”的光密度比值表示。
1.7 统计学处理
所有计量资料数据均采用±s表示。采用SPSS11.5软件行单因素方差分析,L.S.D-t检验及Dunnett-t检验作为验后多重比较。以P<0.05为差异有统计学差异。
2 结 果
2.1 实验动物一般情况
本研究65只动物中, 1只动物死于腹腔感染, 1只死于肠梗阻, 1只无明显原因死亡, 将这3只动物剔除。其余兔健康存活, 纳入研究。
2.2 外加电场对血管损伤后内/中膜面积比值的影响
HE染色后光镜下观察可见, 假手术组正常动脉内膜仅见单层内皮细胞, 内皮层下未见有中膜VSMCs潜入。球囊损伤1d后, 动脉内皮剥脱, 管腔内表面尚无增殖的VSMCs。内膜损伤后1周, 新生内膜形成并逐渐增厚, 其中可见较多增殖的VSMCs,分布不均, 排列紊乱, 内/中膜面积比为(8.43±1.39)%。内膜损伤2周后, 新生内膜厚度明显增加,最厚处约为中膜厚度的 1/2, 内/中膜面积比为(20.88±1.84)%。损伤后4周, 新生内膜继续增厚,最厚处约等于中膜厚度, 内/中膜面积比为(46.92±5.79)%。在3.0V电场干预组, 内膜损伤后1周、2周及 4周内/中膜面积比分别为(8.28±1.31)%,(16.12±2.65)%, 及(28.07±3.63)%, 与对照组相比显著减小(P<0.01)。在4.0V电场干预组, 内膜损伤后1周、2周及4周内/中膜面积比分别为(7.93±1.76)%,(14.80±1.51)%及(27.58±4.27)%, 也明显小于假手术组(P<0.01), 但与3.0V组比较, 差异无统计学意义(P>0.05; 图1, 图2)。
2.3 外加电场对血管损伤后Ⅰ型、Ⅲ型胶原的影响
天狼猩红染色后偏振光纤维镜下观察, 可见各组血管壁内较丰富橙黄色Ⅰ型胶原, 主要分布于外膜, 仅有较少量绿色Ⅲ型胶原表达。术后1周, 各组新生内膜已形成, 但内膜中未见橙黄色和绿色条纹。术后2周, 新生内膜厚度明显增加, 内膜中可见少许橙黄色条纹, 在电场干预3.0V、4.0V组新生内膜厚度小于对照组, 内膜中未见橙黄色条纹; 术后4周, 新生内膜继续增厚, 新生内膜中可见较多的橙黄色斑条纹, 并有少许绿色细条纹夹杂其中, 在电场干预3.0V、4.0V组, 新生内膜厚度小于假手术组, 新生内膜中的橙黄色斑条纹较对照组显著减少(图3, 图4)。Western blot结果显示, 在术后4周,无论是3.0V还是4.0V实验亚组, 其I、III型胶原蛋白的表达与假手术组比较, 差异无统计学意义(P>0.05; 图5, 图 6)。
3 讨 论
血管损伤后的内膜增生是一个复杂的过程。内皮细胞损伤诱导血栓形成, 血栓形成后的 24h内,VSMCs即开始增生。正常内皮细胞产生很多因子如前列环素和硫酸类肝素等, 这些物质抑制VSMCs增殖[3]。损伤的内皮细胞产生硫酸类肝素量减少, 同时由内皮细胞产生的其他抑制VSMCs增殖的因子如一氧化氮的产量亦降低, 而死亡或损伤的内皮细胞和VSMCs释放许多促增殖物质, 刺激VSMCs增殖[4]。因此, 血管壁损伤后降低了抑制性生长因子的产量而增加了刺激性生长因子的表达量, 使其平衡向有利于VSMCs增殖的方向移动。新生内膜的最终形成是 VSMCs通过增殖聚集, 持续性迁移或者是两者的结果, 同样也是大量细胞外基质合成的结果。VSMCs聚集过程和细胞外基质产生紧密联系, 刺激 VSMCs增殖的相同因子, 同时也增加细胞外基质的含量[3]。
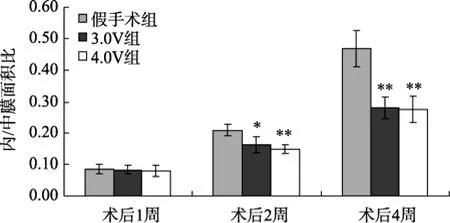
图1 各组不同时间点内/中膜面积比Figure 1 Ratio of the tunica intima area to media area of the neointima
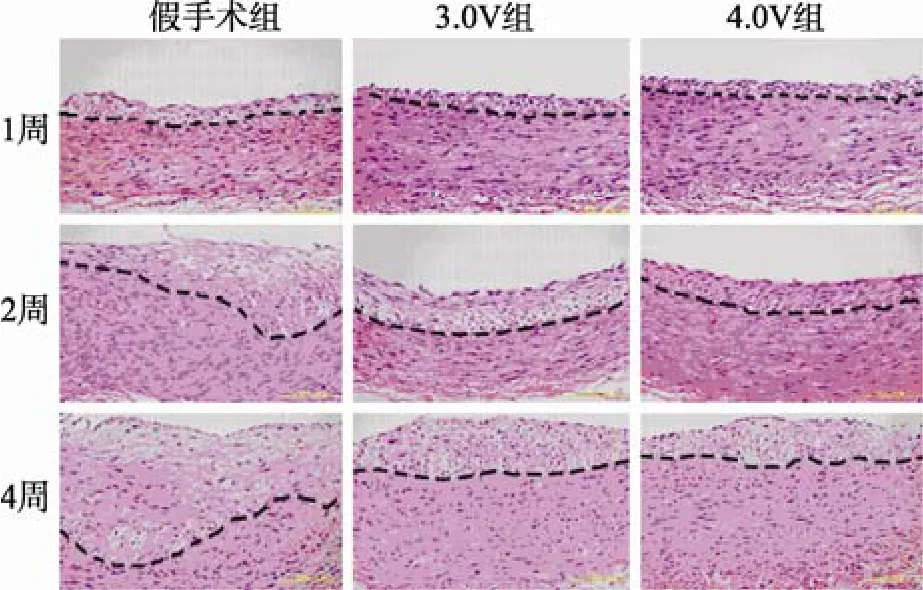
图2 各组不同时相点新生内膜增生情况Figure 2 Neointimal formation of the abdominal aorta after balloon injury operation in different groups (HE×100)

图3 天狼猩红染色术后4周各组间内膜Ⅰ型胶原比较Figure 3 Expressions of type-I collagens in different groups at 4 weeks after surgery (Sirius red dye staining)
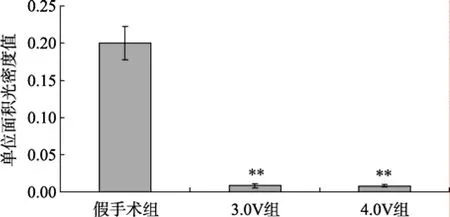
图4 术后4周各组间内膜Ⅰ型胶原单位面积光密度值比较Figure 4 Absorbance value of type-I collagens in different groups at 4 weeks after surgery
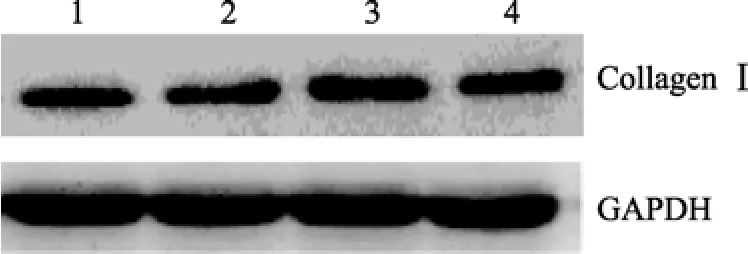
图5 Western blot检测血管Ⅰ型胶原蛋白的表达Figure 5 Expression of type-I collagens detected by western blot
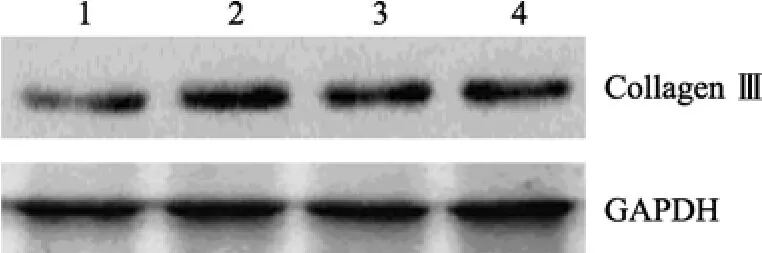
图6 Western blot检测血管Ⅲ型胶原蛋白的表达Figure 6 Expression of type-III collagens detected by western blot
唐波等[5]的研究发现, 在外加直流电场的作用下, VSMCs 向电场阴极面作定向迁移, 迁移速度也明显增加, 电场作用下 VSMCs 的定向迁移是与细胞生长相关的一种主动行为, 而不是在电场作用下的一种被动的泳动。Azadniv 等[6]的研究也发现,外加电场可以抑制体外培养的哺乳动物细胞的增殖。以上研究均表明, 外加电场可以影响 VSMCs的增殖和迁移。本研究中发现, 球囊损伤后2周及4周,新生内膜厚度显著增加; 3.0V及4.0V实验亚组内皮损伤后 2周及 4周的内/中膜面积比均显著小于对照组(P<0.05,P<0.01), 但不同实验亚组间相比, 差异无统计学意义。这表明外加一定强度范围的稳恒直流电场可以抑制新生内膜的形成。
目前的研究表明, 细胞外基质的重建, 尤其胶原纤维的重建(Ⅰ型、Ⅲ型胶原)与 VSMCs迁移和增生有密切的关系, 血管内膜损伤后增生的细胞外基质主要来自于中膜的 VSMCs和外膜活化后的肌成纤维细胞, 细胞外基质是 VSMCs增殖所必需的。Abid等[7]的研究显示, 自发性高血压大鼠VSMCs增殖的同时,Ⅰ, Ⅲ型胶原 mRNA的表达增加, VSMCs增殖伴细胞外基质的分泌。血管细胞外基质是维持血管壁结构完整和功能正常的必要保证,正常动脉血管中的胶原以Ⅰ型、Ⅲ型和Ⅳ型为主,主要由VSMCs合成分泌[8]。
我们的研究发现, 天狼猩红染色后偏振光纤维镜下观察, 正常血管壁内的胶原以Ⅰ型胶原为主,主要分布于外膜, 少量Ⅲ型胶原夹杂其中, 明显少于Ⅰ型胶原。术后1周, 各组新生内膜已形成, 但内膜中均未见Ⅰ, Ⅲ型胶原。术后2周, 新生内膜厚度明显增加, 内膜中可见少许Ⅰ型胶原, 在3.0V, 4.0V实验亚组新生内膜厚度小于对照组, 内膜中未见Ⅰ,Ⅲ型胶原; 术后4周, 新生内膜继续增厚, 新生内膜中可见较多的Ⅰ型胶原, 并有Ⅲ型胶原夹杂其中;3.0V和4.0V实验亚组新生内膜厚度小于对照组, 新生内膜中的Ⅰ型胶原明显少于对照组。3.0V和4.0V亚组之间内膜胶原含量未见差异。这表明外加电场在抑制新生内膜形成的同时也抑制了细胞外基质的分泌。Western blot结果显示, 在术后4周, 3.0V亚组、4.0V亚组Ⅰ型、Ⅲ型胶原蛋白的表达与对照组相比, 差异亦无统计学意义, 3.0V亚组、4.0V亚组Ⅲ型胶原蛋白的表达与对照组相比, 差异无统计学意义, 表明电场干预没有改变血管壁总的胶原蛋白含量, 这可能是因为血管壁总胶原蛋白主要由血管外膜胶原蛋白组成, 血管内膜内的胶原蛋白含量变化对血管总胶原蛋白含量的变化无明显影响。
既往有研究发现, 外加电场可以促进新生内膜增生, 从而形成管腔的狭窄, 这一作用甚至被人们用来制作血管损伤模型[9]。但在这些研究中产生血管损伤作用的电场均为高频脉冲电场, 刺激电流均高于 1mA, 并且刺激电极与血管外膜紧密接触, 而我们采用的是低压稳恒直流电场, 刺激电极置于腰大肌内, 不与血管直接接触, 经过血管的电流极小。这可能是本研究中血管产生不同效应的主要原因。
总之, 外加适宜的低压稳恒电场可以抑制血管损伤后新生内膜的形成, 同时抑制血管内膜 I型胶原蛋白的生成, 这可能有助于改善血管损伤后内皮依赖性舒张功能。
[1]Slavin L, Chhabra A, Tobis JM. Drug-eluting stents:preventing restenosis[J]. Cardiol Rev, 2007, 15(1): 1-12.
[2]唐 波, 何国祥. 电场对细胞生物学行为的影响[J]. 国外医学心血管疾病分册, 2003, 30(6): 350-353.
[3]Sottirurai VS, Yao JST, Batson RC,et al. Distal anastomotic intimal hyperplasia: histopathologic character and biogenesis[J].Ann Vasc Sung, 1989, 3(1): 26-33.
[4]Kairuz EM, Barber MN, Anderson CR,et al. C-type natriuretic peptide (CNP) suppresses plasminogen activator inhibitor-1 (PAI-1)in vivo[J]. Cardiovasc Res, 2005, 66(3):574-582.
[5]唐 波, 何国祥, 刘建平, 等. 电场干预对血管平滑肌细胞形态和细胞骨架的影响[J]. 中国临床康复, 2006, 10(21):70-72.
[6]Azadniv M, Miller MW, Cox C,et al. On the mechanism of a 60-Hz electric field induced growth reduction of mammalian cellsin vitro[J]. Radiat Environ Biophys, 1993,32(1): 73.
[7]Abid MR, Yano K, Guo S,et al. Forkhead transcription factors inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia[J]. J Biol Chem, 2005, 280(33):29864-29873.
[8]杜瑶瑶, 王 宪, 孔 炜. 细胞外基质、基质水解酶与血管钙化[J]. 生理科学进展, 2008, 39(3): 203-208.
[9]Carmeliet P, Moons L, Stassen JM,et al. Vascular wound healing and neointima formation induced by perivascular electric injury in mice[J]. Am J Pathol, 1997, 150(2): 761-776.

