利奈唑胺和替考拉宁治疗住院高龄革兰阳性菌感染患者的临床应用分析
李曙平, 李 娟
(广州军区武汉总医院干部病房一科, 武汉 430070)
常见的革兰阳性球菌有金黄色葡萄球菌、肠球菌、凝固酶阴性葡萄球菌等。近年来, 革兰阳性球菌在医院获得性感染中所占比例逐渐上升, 同时耐甲氧西林金黄色葡萄球菌、耐万古霉素葡萄球菌及肠球菌等的比例也在日益上升, 使临床上针对革兰阳性球菌所致感染性疾病的治疗面临严峻的考验。由于长期住院的高龄患者发生革兰阳性球菌感染在治疗上往往十分困难, 死亡率很高, 且糖肽类抗生素如万古霉素、替考拉宁等的肝、肾毒性使临床上选择治疗革兰阳性菌的抗菌药物受到限制。恶唑烷酮类新型抗菌药物—— 利奈唑胺对各种耐药的革兰阳性球菌均具有抗菌活性, 为临床治疗提供了新的选择。本文通过回顾性分析, 针对80岁以上高龄患者应用利奈唑胺和替考拉宁的情况进行了调查与比较, 以期探讨其疗效和安全性。
1 对象与方法
1.1 对象
回顾性分析2008年1月至2011年8月于广州军区武汉总医院干部病房一科住院的高龄革兰阳性球菌感染患者的临床资料, 共 58例, 均为男性, 年龄84~98岁, 平均(91.2±4.0)岁。其中接受利奈唑胺治疗者30例, 接受替考拉宁治疗者28例。所有患者均患有两种以上基础疾病, 其中冠心病 23例、高血压病16例、糖尿病13例、慢性阻塞性肺部疾病15例、恶性肿瘤10例、脑血管病9例、肾功能衰竭6例、老年性精神障碍7例、气管插管或气管切开并呼吸机辅助呼吸者 16例。所有患者均因感染, 先经其他广谱抗生素治疗, 临床不显效, 细菌学监测发现革兰阳性球菌而合用或换用利奈唑胺或替考拉宁治疗。
1.2 给药方法与疗程
利奈唑胺组给予利奈唑胺(辉瑞公司, 美国)600 mg, 静脉滴注, 每 12小时 1次, 疗程 5~14 d;替考拉宁组给予替考拉宁(赛诺菲安万特公司, 法国)0.2 g, 静脉滴注, 每日1次, 治疗前3 d剂量加倍, 疗程3~21 d。观察并记录治疗过程中患者的症状、体征变化及不良反应, 跟踪检查血常规、尿常规、肝、肾功能, 进行微生物学检测等。
1.3 疗效评价
1.3.1 临床疗效评价 按卫生部颁发的《抗菌药物临床研究指导原则》, 临床疗效评价分为(1)痊愈:症状、体征、检验及病原学检查均恢复正常; (2)显效: 病情明显好转, 但上述4项中有1项未恢复正常; (3)进步: 用药后病情有好转但不明显, 实验室检查未恢复正常, 病原学检查仍为阳性; (4)无效: 用药 72 h后病情无明显进步或加重。痊愈、显效、进步合计为临床有效, 无效则为临床无效。
1.3.2 细菌学疗效评价标准 主要以病原学监测结果进行判定, 分为病原菌清除、假设清除、未清除、替换、再感染5级。其中假设清除为治疗后患者的病情改善, 但不能收集到微生物标本, 其治疗前微生物学检查必须为阳性。
1.4 不良反应评价
参照药物说明书描述的不良反应, 结合临床按有关、可能有关、可能无关及无关进行评定。
1.5 统计学处理
数据应用 SPSS 17.0软件进行统计学处理, 结果以均数±标准差表示, 采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般状况
两组患者年龄、疾病分布和急性生理与慢性健康Ⅱ评分(acute pathologic and chronic health evaluationⅡ, APACHEⅡ)差异无统计学意义。感染部位和细菌学监测情况: 肺部感染46例、支气管感染7例、泌尿系感染3例、皮肤感染2例。细菌培养结果为: 耐甲氧西林金黄色葡萄球15例、肠球菌10例、凝固酶阴性葡萄球菌5例、溶血葡萄球菌3例; 一般细菌学涂片检查提示, 革兰阳性球菌者 23例, 未找到病原学证据、经验性用药2例。
2.2 两组患者疗效对比
临床总有效率利奈唑胺组为 93.3%, 替考拉宁组为78.5%, 二者差异无统计学意义(表1); 总细菌清除率利奈唑胺组为 86.7%, 明显高于替考拉宁组的53.6%(P<0.05; 表2)。
2.3 不良反应
利奈唑胺组在治疗过程中主要不良反应为血小板减少, 均与药物有关。出现血小板减少者 19例(63.3%), 其中血小板减少 50%以上者 13例(43.3%), 血小板计数最低值≤30×109/L者 5例(16.7%), 其中1例为20×109/L。在这些患者中,伴有红细胞和血红蛋白下降者4例(13.3%), 最低达 57g/L; 伴有白细胞减少(<4.0×109/L)2例(6.7%); 有 8例出现皮下瘀点瘀斑。在治疗过程中, 血小板开始下降时间最早为用药后4 d, 最晚为用药后11 d, 平均(7.2±3.98)d; 停药后血小板继续下降者14例, 持续3~6 d不等; 血小板开始恢复时间最早于停药后 2 d, 最迟停药后 10 d, 平均(6.5±3.72)d。需要给予血小板输注的9例(30%)。值得提出的是, 有 2例患者在应用利奈唑胺之前血小板已在基线值 75%以下, 应用利奈唑胺后, 随着感染的控制, 血小板反而上升至基线值以上。利奈唑胺组患者其他的不良反应包括胃肠道反应1例、谷氨酸氨基转移酶轻度升高 1例, 停药后逐渐恢复, 考虑也与药物有关。
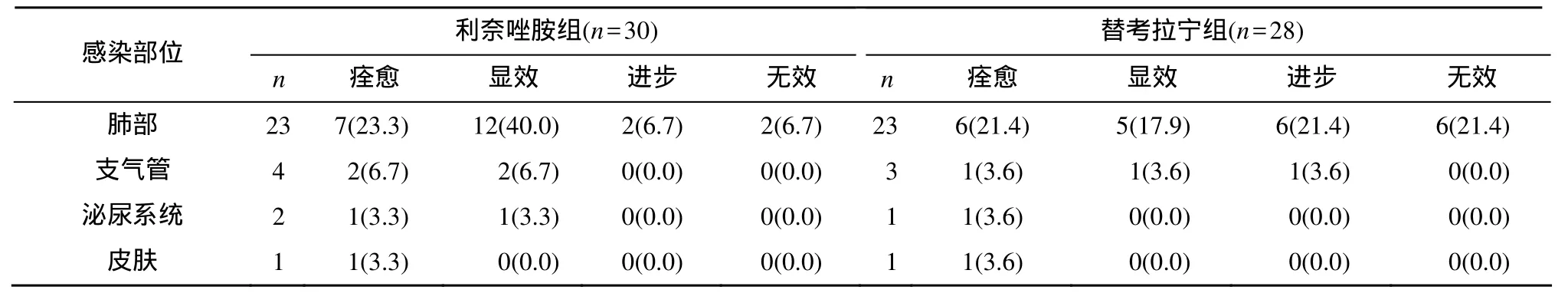
表1 两组患者临床疗效Table 1 Clinical efficacy on patients in two groups [n(%)]
替考拉宁组主要不良反应为肾功能异常, 血肌酐升高者12例(42.86%), 血肌酐从122 µmol/L升至460 µmol/L。血肌酐升高幅度 0.5倍以上者7例(25%)、升高 1倍以上者 3例(10.7%), 其中 1例患者升高2.22倍; 有3例出现尿量减少。上述肾功能异常情况在停用替考拉宁后逐渐恢复, 考虑与用药有关。
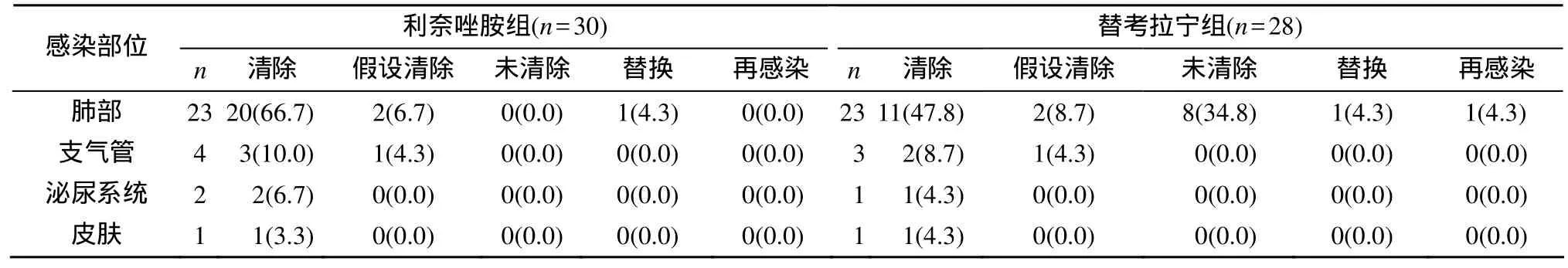
表2 两组患者细菌学疗效Table 2 Bacteriological efficacy on patients in two groups [n(%)]
3 讨 论
老年患者是严重感染的高危人群, 因为常合并多种基础疾病, 长期反复使用抗生素, 免疫功能低下, 一旦感染发生, 难以控制。近年来医院获得性革兰阳性球菌感染率有上升趋势, 而且耐药情况日益严重[1]。由于高龄老人脏器功能减退, 临床上针对高龄老人感染革兰阳性球菌时选择抗生素颇有顾虑,在选择抗生素时, 要求广覆盖、足量、足程, 同时要考虑药物在组织中的穿透力等因素。糖肽类抗生素是治疗革兰阳性球菌感染的有效药物, 但因其肾毒性而限制了临床对其的选择。本组资料显示, 替考拉宁组临床总有效率和细菌清除率均低于利奈唑胺组, 考虑与细菌对糖肽类抗菌药物的耐药性增强有关[2]。利奈唑胺是第一个应用于临床的恶唑烷酮类抗菌药物, 主要与细菌50 s亚基上核糖体RNA的23 s位点结合, 阻止形成 70 s始动复合物, 从而抑制细菌蛋白质的合成, 发挥抑菌作用, 而以往的抗菌药物均非以此阶段为抑制细菌蛋白合成的靶位。由于利奈唑胺作用部位和方式独特, 不易与其他类别的抗菌药物发生交叉耐药[3]。该药对各类革兰阳性球菌均具有良好的抗菌活性。此外, 利奈唑胺有强大的组织穿透力, 这也是其可以强效治疗革兰阳性球菌所致感染的一个主要因素[4]。本组资料显示, 利奈唑胺组临床总有效率93.3%, 细菌清除率86.7%, 均优于替考拉宁组, 与文献报道一致[5], 也证实了利奈唑胺的独特疗效。
在针对高龄患者革兰阳性球菌感染的抗菌治疗时, 药物的安全性不容忽视, 本组资料显示, 利奈唑胺的主要不良反应为血小板减少, 部分伴有血红蛋白和白细胞减少。有文献报道, 应用利奈唑胺的患者血小板减少发生率可达 29.5%, 均为可逆性,与该药对骨髓的抑制有关[6]; 也有报道认为, 该不良反应与感染相关的免疫介导有关[7]。本研究中利奈唑胺组患者血小板减少发生率高达 63.3%, 血小板开始减少时间和降至最低值的时间也短于文献报道, 考虑与患者高龄、患有多种基础疾病、感染本身对骨髓的抑制以及长期应用各种广谱抗生素等因素有关。有2例患者在应用利奈唑胺之前血小板已在基线值 75%以下, 应用利奈唑胺后, 随着感染的控制, 血小板反而上升至基线值以上, 也说明了感染对血小板的影响。对高龄患者严重感染选择利奈唑胺时, 要严密监测血常规, 特别是血小板的动态变化, 一旦有下降趋势即应高度警惕。我们的体会是, 血小板低于30×109/L应立即停药, 必要时给予输注血小板。此外要注意因血小板明显减少而停药后的 1周内, 血小板会继续下降, 仍应密切观察血小板的变化, 给予相应的处理。替考拉宁主要不良反应为肾功能异常, 研究中替考拉宁组患者血肌酐升高者12例(42.86%), 有3例出现尿量减少, 提示高龄患者本身存在肾脏生理功能减退, 肾脏储备功能较差, 同时伴有肾动脉硬化、肾小球滤过率降低, 加之感染及长期应用广谱抗生素对肾脏具有一定影响, 因此应用替考拉宁时, 要注意其对肾脏的毒性, 必要时及时停药, 给予保护肾脏, 增加滤过等处理。
综上所述, 利奈唑胺和替考拉宁治疗高龄革兰阳性球菌感染患者疗效是肯定的, 利奈唑胺在临床疗效和细菌清除率方面优于替考拉宁。在选择这两类药时, 需严格掌握适应证。应用利奈唑胺时需注意监测血小板的变化, 应用替考拉宁时需密切监测血肌酐水平, 在确保治疗效果的同时, 强调用药安全, 规避不良反应。
[1]胡必杰, 魏 丽, 张秀珍, 等. 医院获得性肺炎发病时间对病原菌构成影响的回归行队列研究[J]. 中华结核和呼吸杂志, 2005, 28(2): 112-116.
[2]Steinkraus G, White R, Friedrich L. Vancomycin MIC creep in non-vancomycin-intermediateStaphylococcus aureus(VISA), vancomycin-susceptible clinical methicillin-resistantS. aureus(MRSA) blood isolates from 2001-05[J]. J Antimicrob Chemother, 2007, 60(4): 788-794.
[3]曲俊兵. 利奈唑胺的研究进展[J]. 中国药业, 2010, 19(1):60-61.
[4]Boselli E, Breilh D, Rimmelé T,et al. Pharmacokinetics and intrapulmonary concentrations of linezolid administered to critically ill patients with ventilator-associated pneumonia[J].Crit Care Med, 2005, 33(7): 1529-1533.
[5]Tascini C, Gemignani G, Doria R,et al. Linezolid treatment for gram-positive infections: a retrospective comparison with teicoplanin[J]. J Chemother, 2009, 21(3): 311-316.
[6]Garazzino S, De Rosa FG, Bargiacchi O,et al. Haematological safety of long-term therapy with linezolid[J]. Int J Antimicrob Agents, 2007, 29(4): 480-483.
[7]Bernstein WB, Trotta RF, Rector JT,et al. Mechanisms for linezolid-induced anemia and thrombocytopenia[J]. Ann Pharmacother, 2003, 37(4): 517-520.

