不同浓度NaCl处理对扶芳藤幼苗生理效应的影响
张鹏骞,钟震宇,王丽斌,马盈,姚延梼
(1.北京麋鹿生态实验中心,北京100076;2.山西农业大学 林学院,山西 太谷030801)
扶芳藤(Euonymus fortunei Hand.-Mazz.)属卫矛科卫矛属,常绿藤本[1]。扶芳藤为野生乡土树种,四季常青,秋、冬季有红叶、红果,是我国北方少有的可在露地栽培的常绿阔叶木本地被植物。对植物的耐盐性研究,已有较多报道,但所研究植物一般局限于农作物方面,对园林植物特别是扶芳藤的耐盐性研究并不多见。我国有盐碱地面积2.7×1011m2,大量土地中因含有盐分而寸草不生,成为荒地[2]。随着我国经济社会的快速发展,在人地矛盾凸显的背景下,研究园林植物的耐盐性有着重要意义。本文对扶芳藤这一我国北方绿化常用植物进行抗盐性研究,旨在探讨园林植物在盐碱逆境中生理效应的变化,为盐碱条件下的绿化植物培育积累理论经验。
1 植物耐盐机制
自然条件下,植物生长的环境多种多样,对植物生长发育不利的环境条件统称为逆境(stress environment)或胁迫(stress)[3]。在不同的逆境种类中,土壤盐碱对植物造成的负面影响是比较突出的。盐碱土以土壤溶液中 Na+、Mg2+、Ca2+及CO32-、HCO-3、Cl-和SO42-含量高为主要特征,尤其是Na+和Cl-含量高[4]。阳离子与Cl-、SO42-所形成的盐为中性盐,其中对植物危害的盐类主要为钠盐。盐胁迫下,所有植物的生长都会受到抑制,不同植物对于致死盐浓度的耐受水平和生长降低率不同。盐胁迫几乎影响植物所有的重要生命过程,如生长、光合、蛋白合成、能量和脂类代谢等[5]。
盐胁迫能够启动植物膜脂过氧化作用,从而破坏膜结构,使膜差别透性消失,导致一系列有害的生理生化变化。超氧化物歧化酶(SOD)、过氧化物酶(POD)是生物体内重要的自由基清除剂,在清除机体内多余的超氧阴离子、解除超氧阴离子毒性的过程中起着关键性作用[6]。丙二醛(MDA)是膜脂过氧化的产物,是衡量植物膜脂过氧化的重要指标。在植物生命活动中干扰或破坏膜结构和功能的因素很多,脂质过氧化作用是最引人重视的一个因素[7]。
2 材料与方法
2.1 试验材料
试验于2011年6月~11月进行,试验采用北京麋鹿生态实验中心内新栽植一年生优质扶芳藤扦插苗为试材。
2.2 试验方法
2.2.1 试验设计
试验采取随机区组排列法,30株为一个小区。试验使用NaCl处理,浓度水平设置为:A1:2g·L-1,A2:4g·L-1,A3:6g·L-1,共3个处理和1个对照,3次重复。
试验在2011年4月育苗,到5月初进行移栽,移后确保苗木良好生长,选均匀一致的苗木进行集中管理。到5月中旬第一次处理,用喷壶将配制好的盐液均匀浇灌于植物根部,每次每盆浇灌500 mL。以后每隔30d浇灌盐液一次,从浇灌盐液后间隔30d进行其生理指标的测定。依次进行处理、试验。期间定时灌溉保证苗木不受干旱的影响。试验测定于北京麋鹿生态实验中心野生动植物保护生物学实验室进行。
2.2.2 试验取样
以每次浇灌盐液日期开始,30d后在每个小区随机选取3株苗木,随机选取叶片,立即带回实验室,先用流动水将所取样品表面冲洗干净后,再用无离子水冲洗2~3次。用吸水纸吸干样品表面水分。各样品采集后立即放于冰箱内,设定温度为4℃,待测。
2.3 试验指标测定方法
质膜相对透性采用电导仪测试法[8],超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)还原法[9],过氧化物酶(POD)活性的测定采用愈创木酚法[10]。
2.4 数据统计分析
对试验的各项数据采用SPSS统计软件进行方差分析,并使用由Excel软件生成相关图表。
3 结果与分析
3.1 电导率的变化
当细胞受逆境影响时,膜系统受伤害往往首先表现在透性上,细胞内电解质外渗使外界溶液电导率容易发生变化,当细胞死亡,电解质能自由透过,此时外渗液电导率最大。膜透性增大的程度与逆境胁迫强度有关,也与植物抗逆性的强弱有关。不同浓度NaCl处理下扶芳藤电导率的变化见图1。
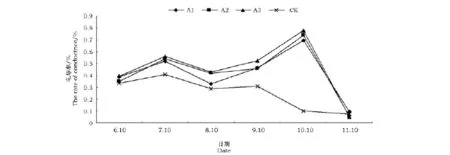
图1 不同浓度NaCl处理对扶芳藤电导率的影响Fig.1 The change of conductance rate in Euonymus fortunei Hand.-Mazz.under NaCl stress
通过图1可以看出,不同浓度NaCl溶液处理下的扶芳藤电导率值整体呈现升-降-升-降的变化规律。前4次盐处理后的扶芳藤幼苗电导率变化规律与Ck一致,但是各样株电导率值均高于对照。说明在试验初期,随着盐处理的进行,扶芳藤电导率有所增加,表明此时期扶芳藤对盐胁迫做出了一定的调节,通过自身调节达到了正常生长的目的。虽然对于NaCl溶液从低到高设置了3个浓度水平,但是从图中可以看出,A1、A2、A3在前3次测量中并没有按照浓度的高低而呈相关规律分布。这说明了扶芳藤在试验进行的前120d对于不同浓度的盐处理都具有较强的抗性。
在10月的处理中,各处理电导率值急剧升高,达到峰值,而对照的电导率值下降。说明扶芳藤在受到盐胁迫后,随着时间的延长以及浓度的增加对电导率产生明显影响。此时,经过长时间的盐胁迫已经使得扶芳藤的耐盐性达到了临界值。各处理的电导率值在最后一个处理中剧烈下降,且与Ck的电导率值在试验测试中基本持平。这一时期气温降低,扶芳藤幼苗的高生长停止,内部的生理活动变缓,可以降低盐对扶芳藤的胁迫。
3.2 不同浓度NaCl胁迫对扶芳藤幼苗POD的影响
POD在维持细胞膜系统稳定性方面有持久的作用,POD酶活性的变化能在一定程度上反映品种的抗逆性大小,POD活性的高低与植物抗逆能力成正比,POD活性的变化程度与植物的抗逆能力也成正比。植物在遭受盐胁迫后,POD活性高低表现不一[11,12]。NaCl处理下POD活性的变化见图2。
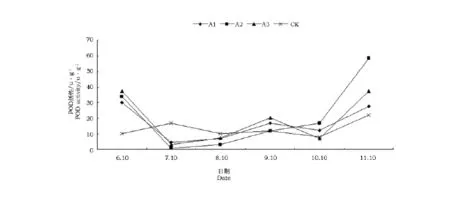
图2 NaCl处理对扶芳藤POD酶活性的影响Fig.2 The activity of POD in Euonymus fortunei Hand.-Mazz.under NaCl stress
从图2可以看出,POD活性总体呈现先降后升的变化趋势。在6月的测试中,各处理均明显高于对照,并且与对照差异显著。各处理间也呈现显著差异,POD酶活性随着盐处理浓度的升高而升高。这是由于扶芳藤幼苗在受到盐胁迫以后,为了保证幼苗的正常生长,POD活性迅速升高,以此来清除植物体内的活性氧。7月的测试中,POD酶活性迅速下降。这是由于SOD的酶活性在此阶段开始迅速上升,以此来消除盐胁迫所造成的大量活性氧自由基而造成的。各处理与对照差异极显著。随着盐胁迫时间的延长,POD酶活性继续增加,在9月达到较高水平,且A3>A1>A2>Ck。这也说明了POD酶活性的大小与盐胁迫的浓度并不成规律。A2处理与对照无明显差异,A1处理与A3处理无明显差异。在试验末期的11月,POD活性急剧上升。
3.3 不同浓度NaCl胁迫对扶芳藤幼苗SOD的影响
植物体为了减轻和防止由于逆境而产生的活性氧对其造成损伤,体内产生SOD等保护酶用于清除氧自由基,防止氧自由基破坏细胞的组成、结构和功能,保护细胞免受氧化损伤具有十分重要作用。NaCl处理下SOD活性的变化见图3。
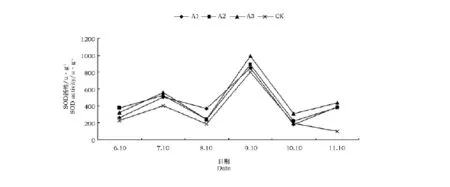
图3 NaCl处理对扶芳藤SOD酶活性的影响Fig.3 The activity of SOD in Euonymus fortunei Hand.-Mazz.under NaCl stress
陈一舞等[13]研究指出,超氧化物歧化酶在植物抵抗盐害过程中,起防止、中断膜脂过氧化,对细胞膜系统损伤起保护作用。通过图3可以发现,扶芳藤幼苗随着NaCl胁迫时间的延长总体呈现先升后降的变化规律,超氧化物歧化酶活性呈上升趋势,是由于在不间断的盐胁迫下,植物体内对逆境的一种代谢性调节。
扶芳藤幼苗的SOD酶活性在9月达到了峰值,在7月达到了次峰。苗木SOD酶活性在最热的月份以及开始降温的秋季达到最高。
在7月的测试中,各处理的SOD酶活性有略微地增加,并且与盐处理浓度呈正比。各处理间无明显差异,且各处理均与对照呈现极显著差异。在经过盐处理一段时间后,与对照相比较,扶芳藤幼苗的SOD酶活性得到了提升。9月,随着盐胁迫时间的进一步延长,以及盐胁迫强度的进一步加大,使得各处理急剧上升,并且使得该曲线达到峰值。这与金兰等[14]对紫花苜蓿抗盐性研究的结果一致:植物在遭受逆境胁迫时,产生的氧自由基数量增多,为了抵抗逆境对植物造成的伤害,超氧化物歧化酶的活性增加,以便清除氧自由基,减少膜脂过氧化。
试验后期,各处理急剧下降,虽然SOD酶系统的功能加强,但其调节能力有限,因而体内还是积累了过剩的氧自由基;同时由于10月已经进入自然降温期,扶芳藤幼苗自身的生理代谢速率减慢,故SOD酶活性下降。这与龚明等[15]对小麦抗盐性研究结果相一致。
3.4 不同浓度NaCl胁迫对扶芳藤幼苗MDA的影响
丙二醛(MDA)是脂质过氧化作用的最终产物,膜脂过氧化的结果使膜结构和功能受到损伤,使膜透性增加和细胞代谢失调,进而诱发酶促褐变反应[16],所以其含量的多少是膜脂质过氧化作用强弱的一个重要指标。
由图4可见,扶芳藤幼苗在NaCl处理下随着胁迫时间的延长,MDA呈现升-降-升-降-升的变化趋势。在7月的处理中,各处理均呈现上升的趋势并达到第一个峰值,A1与对照无明显差异,A3处理与对照有明显差异,A2处理与对照有极显著差异。8月的处理中,各处理均呈下降趋势:A3>A2>A1>Ck。3个不同浓度处理之间无明显差异;但是各处理与对照均呈现明显差异。在9月的处理中,各处理均呈现急剧上升的趋势:A3>A1>A2>Ck,达到曲线的第二个峰值。10月的处理中,各处理均呈现下降趋势。其中,A2处理下降趋势比较缓慢。A1和A3处理与Ck差异小于A2处理。试验末期,A1处理和A3处理均有小幅度的上升趋势;A2处理则有明显地下降趋势。
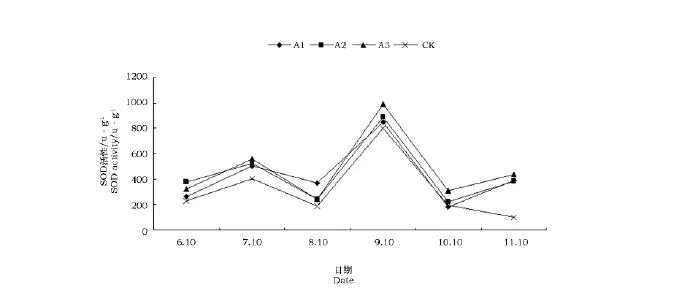
图4 NaCl处理对扶芳藤丙二醛含量的影响Fig.4 The content of MDA in Euonymus fortunei Hand.-Mazz.under NaCl stress
4 结论
当扶芳藤幼苗受到不同浓度的NaCl胁迫时,扶芳藤叶片电导率与盐液浓度的大小没有呈现出相关规律;扶芳藤幼苗体内所产生的SOD酶活性总体大于对照Ck;POD酶活性在试验进行的前30天以及后90天高于对照Ck;盐胁迫下,扶芳藤叶片内的MDA含量与盐浓度的高低无明显规律。随着盐胁迫时间的延长,在9月MDA含量达到峰值。这可以反映出,扶芳藤幼苗对盐害胁迫的响应强烈。其中,幼苗体内的SOD对清除活性氧自由基起到了主要作用,POD起到了一定的保护作用。
[1]诚静容.中国高等植物图鉴.第二册(卫矛科)[M].北京:科学出版社,1980:657-687.
[2]黎立群.盐碱土的基本知讯[M].北京:科学出版社,1986:81-82.
[3]利容千,王建波.植物逆境细胞及生理学[M].武汉:武汉大学出版社,2002:144-146.
[4]王志远.盐胁迫对杨桃光和特征的影响[J].现代农业科技,2007,18:10-11.
[5]杨少辉,季静,王罡.盐胁迫对植物的影响及植物的抗盐机理[J].世界科技研究与发展,2006,28(4):70-76.
[6]方允中,郑荣梁.自由基生命科学进展:第3集[M].北京:原子能出版社,1993:31-33.
[7]林栖凤.耐盐植物研究[M].北京:科学出版社,2004:159-161.
[8]刘铁铮,赵习平.电导法测定杏叶片细胞质膜相对透性的研究[J].河北农业科学,2008,12(1):33-34.
[9]陈贵,胡文玉,谢莆缔,等.提取植物体内的溶剂及作为衰老指标的探讨[J].植物生理学通讯,1991,27(1):44-46.
[10]喻方圆,徐锡增.植物逆境生理研究进展[J].世界林业研究,2003,16(5):6-11.
[11]Hernandez J A,Campillo A,Jimenez A.Response ofα-tioxidant systems and leaf water relations to NaCl stress in pea plants[J].New Phytol,1999,141(2):241-251.
[12]沈惠娟,曾斌.Effects of drought and low temperature stress on superoxide dismutase and peroxidase[J].南京林业大学学报,1992,16(4):54-57.
[13]陈一舞,邵桂花,常汝镇.盐胁迫下大豆子叶细胞器超氧化物歧化酶的影响[J].作物学报,1997(2):214-219.
[14]金兰,罗桂花.盐胁迫对紫花苜蓿SOD丙二醛及SOD同工酶的影响[J].黑龙江畜牧兽医,2005(5):15-16.
[15]龚明,丁念诚,贺子义,等.盐胁迫下大麦和小麦叶片膜脂过氧化伤害与超微结构变化的关系[J].植物学报,1989,31(11):841-846.
[16]宋风鸣,郑重,葛秀春.活性氧及膜脂过氧化在植物病原物互作中的作用[J].植物生理学通讯,1996,32(5):377-385.

