实验性酒精性肝损伤小鼠血清和肝组织中ACTA及FS的表达水平及其意义
杨 清,李大光,陈 勃,张灵敏,刘 洋,柳忠辉
(1.吉林大学第一医院二部输血科,吉林 长春 130031;2.吉林大学白求恩医学院免疫学教研室,吉林 长春 130021)
激活素A(activin,ACTA)属于TGF-β超家族成员,在初期胚胎形成、神经分化诱导、造血细胞增殖和分化、内分泌中枢垂体性激素分泌等多方面发挥重要作用。ACTA可由巨噬细胞、Th2细胞以及肝实质细胞产生。有研究[1-2]表明:细胞因子在肝纤维化发病机制中具有重要作用,而激活素是新近发现参与肝纤维化形成的细胞因子,其中以ACTA最为重要,其以自分泌、旁分泌的形式作用于肝细胞,导致肝细胞增殖抑制、诱导肝细胞凋亡及促进细胞外基质分泌等,参与肝脏疾病的发生发展过程。卵泡抑素(follistain,FS)具有广泛的组织分布且与激活素具有高亲和力,作为激活素结合蛋白,具有阻断激活素与其受体结合、中和激活素等多方面的生物学活性[3-4]。目前,关于ACTA和FS在酒精性肝病中的作用,国内外尚未见报道。本文作者拟通过探讨ACTA和FS在酒精性肝损伤中的作用,进一步阐明酒精性肝病的发生机制。
1 材料与方法
1.1 动物及模型建立C57雄性小鼠80只,体质量18~22 g,由吉林大学实验动物中心提供。适应性喂养3 d后,随机分为模型组(n=40)和对照组(n=40)。采用酒精灌胃方法制造酒精性肝损伤小鼠模型。选用酒精为北京牛栏山56℃二锅头,每日1次按每只小鼠5 g·kg-1酒精量给予。连续灌胃3 d。对照组小鼠选用蒸馏水连续灌胃3 d。
1.2 指标检测选择小鼠灌胃后24、72、120及168 h 4个时间点,每个时间点分别杀死模型组和对照组小鼠各10只,采集全部血液,37℃水浴30 min,2 000 r·min-1离心15 min,取血清-80℃冻存。其肝组织采用预冷的PBS液100 mL按心脏灌流方法进行清洗,取肝脏在4%多聚甲醛中固定过夜,石蜡切片及抗ACTA及FS染色。结果判定标准:细胞出现棕黄色染色为阳性细胞,无明显染色细胞为阴性。采用ELISA法检测小鼠血清ACTA和FS水平,试剂由武汉博生生物公司提供。采用改良赖氏法测定模型鼠和对照鼠血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)水平变化,试剂由武汉优尔生科技股份有限公司提供,严格按说明书操作。
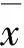
2 结 果
2.1 2组小鼠血清ALT、AST、ACTA和FS水平变化各时间点对照组小鼠血清ALT、AST和ACTA水平无明显变化,而模型组小鼠血清ALT、AST和ACTA水平均有不同程度的变化,其中ALT、AST以24 h为最高,ACTA以72 h为最高。模型组小鼠血清ALT、AST和ACTA水平在4个时间点与相应对照组比较,差异均有统计学意义(P<0.01)。在4个时间点,模型组和对照组小鼠血清FS水平变化无明显差别,差异无统计学意义(P>0.05)。见表1。
2.2 HE染色结果对照组小鼠肝组织肝小叶结构完整,肝细胞大小均匀、排列整齐,无变性坏死,无淋巴细胞浸润。模型组小鼠末次酒精灌胃后24 h时,肝脏可见明显的点状出血坏死,坏死处可见大量的中性粒细胞及淋巴细胞浸润,局部肝细胞肿胀,胞质疏松;肝组织病变尤以120 h时最为严重,结构紊乱,肝小叶内细胞肿胀,胞质淡染疏松,呈气球样变。见图1(插页一)。
2.3 免疫组织化学染色结果对照组小鼠肝组织中几乎不表达ACTA,而FS表达阳性。模型组小鼠肝组织中ACTA阳性颗粒分布主要位于中央小叶和门静脉周围肝细胞中,并在间质细胞质及其周围也可见其表达。FS在模型组小鼠肝组织表达与对照组比较无明显差异。见图2~4(插页二)。
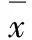
表1 不同时间点各组小鼠血清中ALT、AST、ACTA 及 FS水平的变化
3 讨 论
激活素是在性腺中发现的双链糖蛋白,属于TGF-β超家族成员。大量研究[5-6]证实:激活素是多功能的生长与分化调控因子,与肝脏疾病发生发展有关。目前研究最多的是ACTA,肝实质细胞和肝星状细胞(HSC)均能产生ACTA,以自分泌,旁分泌的方式作用于自身和周围细胞,参肝细胞活性调节,与肝脏疾病形成关系最为密切。FS又称卵泡休止素,是1987年先后从猪和牛的卵泡液中分离获得的一种新的单链糖蛋白,FS具有广泛的组织分布且与激活素具有高亲和力,作为激活素结合蛋白,具有阻断激活素与其受体结合、中和激活素等多方面的生物学活性。FS作为一种天然拮抗剂参与多种生理、病理功能的调节,在肝纤维化、肺纤维化、动脉粥样硬化等疾病的形成中均具有重要的作用[7-9]。本实验结果表明:正常小鼠肝脏组织低水平表达ACTA和FS,且主要位于肝小叶内门脉区的肝细胞,在肝损伤过程中ACTA表达升高明显,而且在肝细胞损伤区域周围表达最为明显,FS在小鼠肝损伤后无明显变化。因此,在酒精性肝纤维化形成过程中ACTA和FS表达发生了不同的变化。本研究结果显示:酒精性肝损伤时ACTA表达明显增高,在第7天(168 h)时,ACTA水平明显下降,但依然明显高于对照组;模型组小鼠血清ALT和AST水平在各时间点均明显高于相应对照组,以24 h时最高,提示 ACTA水平变化与肝损伤程度相一致。但模型组小鼠血清ALT和AST水平从120 h后又有所升高,这可能与模型鼠肝脏组织免疫反应增强有关,尚待探讨。有研究表明:ACTA可能通过抑制肝实质细胞增生,促进间质细胞分泌细胞外基质(ECM)而参与肝纤维化、肝硬变的形成,FS与激活素结合而阻断激活素生物学效应的发挥,激活素与FS系统调节了肝细胞的正常生长,激活素具有抑制作用,FS通过阻断激活素而发挥促进作用,这种系统的异常影响细胞正常生长,如肝肿瘤细胞系细胞,这些细胞具有无限制生长特性,在这些细胞中常伴有激活素-FS系统改变。在肝细胞癌细胞系HepG-2中的研究证实:这些细胞有激活素受体表达异常,表现为受体类型减少及与激活素亲和力下降,相反FS的分泌无影响[10-14]。本实验中模型组小鼠FS水平似乎略有升高迹象,是否可考虑为FS对ACTA活性增强的抑制性反应,尚需进一步深入研究。本实验结果表明:ACTA在酒精性肝损伤过程中起重要作用,激活素-FS系统失衡可能是酒精性肝病、肝纤维化形成的重要原因。
[参考文献]
[1]Phillips DJ,De Kretser DM,Hedger MP.Activin and related proteins in inflammation: not just interested by standers[J].Cytokine Growth Factor Rev,2009,20(2):153-164.
[2]Wang SY,Tai GX,Zhang PY,et al.Inhibitory effect of activin A on activation of lipopolysaccharide-stimulated mouse macrophage RAW264.7 cells[J].Cytokine,2008,42(1): 85-91.
[3]Zhang HJ,Tai GX,Zhou J,et al.Regulation of activin receptor-interacting protein 2 expression in mouse hepatoma Hepa1-6 cells and its relationship with collagentype Ⅳ[J].World J Gastroenterol,2007,13(41):5501-5505.
[4]Yndestad A,Haukeland JW,Dahl TB,et al.A complex role of Activin A in non-alcoholic fatty liver disease[J].Am J Gastroenterol,2009,104(9):2196-2205.
[5]张红军,台桂香,柳忠辉.激活素在肝纤维化形成中的作用[J].临床肝胆病杂志,2007,11(3):232-234.
[6]张红军,柳忠辉,马 迪,等.激活素A及其ⅡA型受体在小鼠肝损伤模型肝组织中的表达[J].吉林大学学报:医学版,2008,34(3):393-396.
[7]陈芳芳,冯 野,王轶楠,等.激活素A对巨噬细胞系RAW264.7细胞吞噬活性及TLR4表达的双向调节作用[J].中国生物制品学杂志,2009,22(6):560-562.
[8]方 琳,刘海岩,崔雪玲,等.抗激活素受体相互作用蛋白 1抗体的制备及应用[J].吉林大学学报:医学版,2008,34(1):11-13.
[9]陈 曦,李 斌.激活素和抑制素与卵巢肿瘤的研究进展[J].国际妇产科学杂志,2011,38(5):423-425.
[10]陈玲琴,汤曾耀,金 萱.表皮生长因子对卵巢激活素基因表达的调节及其信号通路[J].中国组织工程研究与临床康复,2011,34(1):134-136.
[11]陈 颖,徐 苓.激活素-抑制素-卵泡抑素系统研究进展[J].生殖医学杂志,2007,32(4):168-170.
[12]孔祥民,刘忠艳,傅春彬,等.慢性乙肝患者血清ACTA水平及临床评价[J].临床消化杂志,2009,25(3):188-189.
[13]于 昉,王轶楠,李 楠,等.肝硬化患者外周血及肝组织激活素A水平变化[J].中国老年学杂志,2010,35(22):332-333.
[14]李 楠,柳忠辉,霍德胜,等.激活素A诱导小鼠Ⅱ型巨噬细胞活化[J].中国免疫学杂志,2010,26(9):771-773.

