盐酸曲美他嗪片溶出度测定方法的建立
杜松,周君龙,刘美凤#,叶健文(.广州汉方现代中药研究开发有限公司,广州5040;.华南理工大学化学与化工学院制药工程系,广州 50640)
盐酸曲美他嗪是上世纪60年代开发的一种改善心肌缺血的药物,早期制剂规格为每片3 mg,服用剂量为每天6~12 mg。国内也有药厂仿制该规格产品,称为曲美他嗪片或三甲氧苄嗪片,均被收入地标升国标的部颁标准中[1,2],目前国内仅有1家生产。每片3 mg规格的曲美他嗪片目前在日本仍被沿用,且已被载入《日本药典》[3]。施维雅公司之后推出了每片20 mg的规格,国内也有多家仿制,因此目前市售曲美他嗪片也基本都为每片20 mg这种规格。
溶出度是评价口服固体制剂质量的重要指标[4]。每片3 mg规格的曲美他嗪片的早期部颁标准中没有溶出度测定项目。该规格制剂的《日本药典》标准中是以900 mL水为溶出介质,桨法,50 r·min-1,采用高效液相色谱法测定溶出度,溶出度限度为45 min溶出80%以上。而目前市售主流20 mg规格的片剂尚没有公开的国家药品标准。石海英等[5]曾对该规格制剂溶出测定方法开展研究,建立了以500 mL水为溶出介质,篮法,转速为75 r·min-1,紫外吸收系数法折算含量的溶出度测定方法。但篮法测定装置多用于测定胶囊溶出,较少用于片剂的溶出度测定。另外,将溶出液以稀硫酸稀释后进行紫外测定,再通过吸光系数折算含量的做法也较麻烦。笔者对20 mg盐酸曲美他嗪片溶出度测定进行进一步研究,期望建立一种更方便、准确的测定方法。
1 仪器与试药
ZRS-8G智能溶出仪(天大天发科技有限公司);紫外分光光度计(美国热电公司);BS210S电子天平(德国赛多利斯公司)。
盐酸曲美他嗪对照品(批号:20100612,纯度:99.8%)、盐酸曲美他嗪试验片3批(规格:20 mg∶80 mg)均由广州汉方现代中药研究开发有限公司提供;市售盐酸曲美他嗪片(商品名万爽力,施维雅(天津)制药有限公司,批号:20100915、20100916、20100919,规格:20 mg∶90 mg);盐酸、磷酸二氢钾、氢氧化钠等均为市售分析纯;水为脱气纯化水。
2 方法与结果
2.1 含量测定方法
2.1.1 溶出介质制备:介质1为纯化水(经脱气处理);介质2为0.1 mol·L-1盐酸溶液(pH1.0),即9 mL盐酸,以纯化水稀释至1 000 mL即得;介质3为磷酸盐缓冲液(pH6.8),即取0.2 mol·L-1磷酸二氢钾溶液250 mL,加0.2 mol·L-1氢氧化钠溶液118 mL,用纯化水稀释至1 000 mL,即得。
2.1.2 对照品溶液制备:精密称取盐酸曲美他嗪对照品27.78 mg,分别置于3个100 mL量瓶中,各加入适量介质1、介质2和介质3,溶解稀释并定容至刻度,作为盐酸曲美他嗪对照品贮备液。分别精密吸取此贮备液2 mL,置于25 mL量瓶中,再用各介质稀释并定容至刻度,摇匀,即得。
2.1.3 辅料溶液制备:按盐酸曲美他嗪处方称取各辅料适量,按照“2.1.2”项下方法操作,以3种溶出介质为溶剂制备辅料溶液,备用。
2.1.4 检测波长的选择:分别取“2.1.2”项下的盐酸曲美他嗪各对照品溶液和“2.1.3”项下的辅料溶液,于200~400 nm波长范围内进行扫描。结果,对照品在203、232 nm波长处均有最大吸收,但是因为203 nm为末端吸收,且辅料有干扰,而辅料在232 nm波长处没有吸收,不干扰测定,由此确定检测波长为232 nm。紫外吸收光谱详见图1。
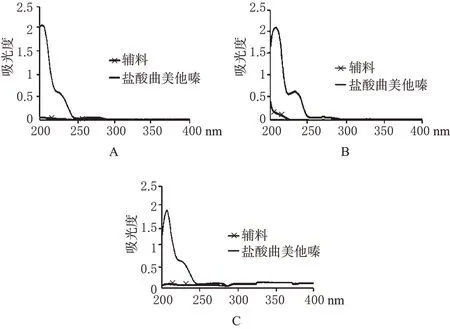
图1 不同介质中的紫外光谱图Fig 1 UV spectrum of different media
2.1.5 标准曲线的制备:精密称取盐酸曲美他嗪对照品50 mg分别置于50 mL量瓶中,分别以介质1、介质2和介质3稀释并定容至刻度,从中分别精密吸取7.5 mL置于25 mL量瓶中,以上述3种介质稀释并定容,得到浓度为0.3 mg·mL-1的盐酸曲美他嗪贮备液,分别量取各自贮备液1.5、2.5、3.0、4.0、4.5、5 mL置于50 mL量瓶中,以上述3种介质定容至刻度,制得浓度分别为9、15、18、21、24、27、30 μg·mL-1的盐酸曲美他嗪对照品溶液,以各自溶出介质作空白,按照分光光度法在232 nm波长下测量其吸光度(A),将其与浓度(c)进行线性回归,得标准曲线方程分别为:A水=2.26×10-2c-7.6×10-3(r=0.999 6,n=7);A盐酸=2.45×10-2c+8.42×10-3(r=0.999 8,n=7);A磷酸盐=2.32×10-2c+4.25×10-3(r=0.999 8,n=7)。可见,盐酸曲美他嗪检测浓度线性范围为9~30 μg·mL-1。
2.1.6 稳定性试验:取“2.2”项下供试品溶液,室温下放置,分别于0、1、2、3、4、5 h测定吸光度,结果吸光度值无明显变化,RSD水=0.36%(n=6),RSD盐酸=0.56%(n=6),RSD磷酸盐=0.40%(n=6),表明供试品溶液在5 h内稳定。
2.1.7 精密度试验:取同一对照品溶液5份,分别测定吸光度值,结果,RSD水=0.31%,RSD盐酸=0.26%,RSD磷酸盐=0.22%。表明该方法的精密度能够满足测量要求。
2.1.8 方法回收率试验:分别精密称取盐酸曲美他嗪对照品约16、20、24 mg,置于100 mL量瓶中,加入处方比例的辅料,用3种溶出介质溶解并定容,滤过,精密吸取滤液2 mL置于25 mL量瓶中,再分别用溶出介质定容,于232 nm波长处测定(每种浓度样品3份,每份测定5次),计算回收率,结果见表1。
2.2 溶出度试验
2.2.1 介质选择:取盐酸曲美他嗪试验片和市售片各6片,按《中国药典》2010年版附录ⅤC溶出度测定方法中桨法[6]进行测定,转速为50 r·min-1,分别以介质1、介质2、介质3为溶出介质。分别于5、10、15、30 min取样10 mL(同时补充同体积、同温度的相应介质),经0.45 μm微孔滤膜滤过,滤液即为供试品溶液。于232 nm波长处检测吸光度,与对照品溶液吸光度进行对比,计算累积溶出度,绘制溶出曲线,结果如图2所示。
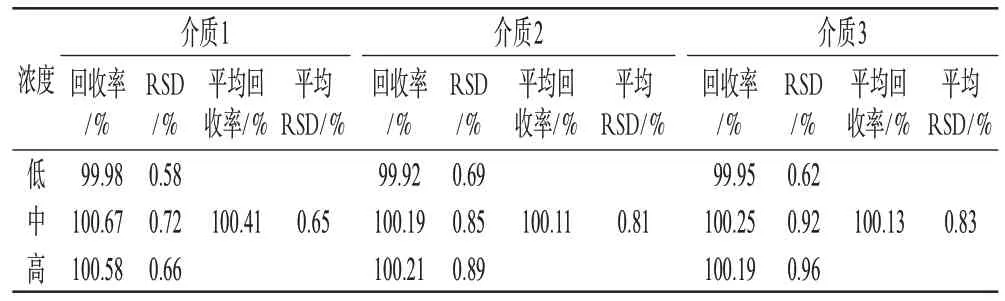
表1 回收率试验结果(n=5)Tab 1 Results of recovery test(n=5)
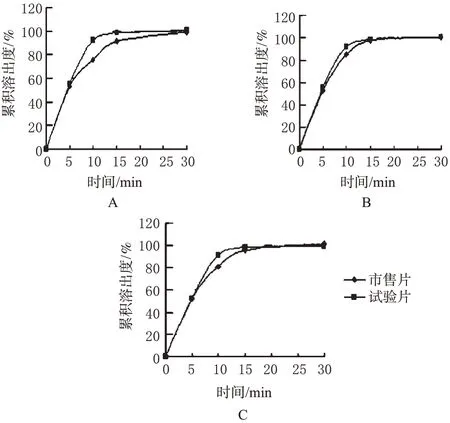
图2 2种片剂在3种介质中的体外溶出曲线Fig 2 Dissolution curves of 2 tablets in 3 kinds of media
由图2可知,试验片与市售片在各介质中溶出迅速,15 min时溶出均已达到85%以上。这与盐酸曲美他嗪药物水溶性强、在上述3种介质中的溶解度均超过1 g·mL-1有关。综合来看,片剂在水中溶出相对较慢,并且不同片之间溶出差异较显著,故选择水作为溶出介质,有利于控制产品质量。
2.2.2 转速选择:以水作为溶出介质,转速分别设为50、75、100 r·min-1,照“2.2.1”项下方法,于15 min取样测定吸光度,同时计算累积溶出度。结果表明,在3种转速条件下,盐酸曲美他嗪片累积溶出度均大于85%,且片剂溶出度均一性均良好,因此选择转速为50 r·min-1。
2.2.3 溶出时间:由图2可知,盐酸曲美他嗪试验片在15 min时累积溶出度均已85%以上,且15、30 min时2个点溶出度差异小于5%,故而确定最终溶出度取样时间为30 min,溶出限度设定为30 min内溶出80%以上。
2.2.4 样品溶出度测定:以水为介质,按“2.2.1”项下方法,对3批盐酸曲美他嗪试验片进行溶出度测定,计算各点的累积溶出度,结果见表2。
由表2可知,盐酸曲美他嗪试验片于30 min时溶出度分别为(100.07±1.8)%、(100.02±2.1)%、(100.78±2.0)%,均在80%以上,符合要求。
表2 3批试验片累积溶出度结果(%,±s,n=6)Tab 2 Accumulative dissolution rates of 3 batches of sample(s%,±s,n=6)
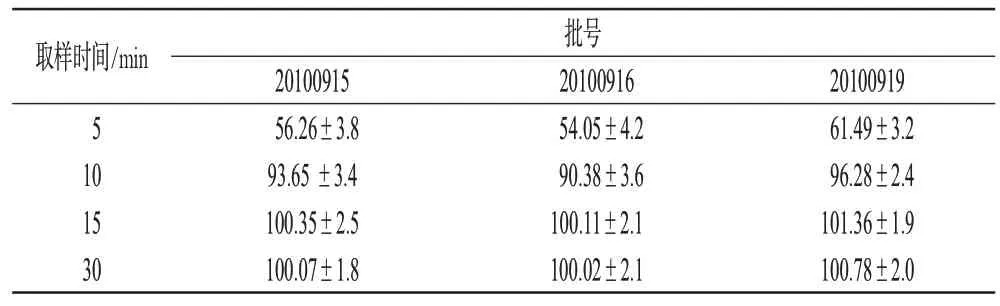
表2 3批试验片累积溶出度结果(%,±s,n=6)Tab 2 Accumulative dissolution rates of 3 batches of sample(s%,±s,n=6)
取样时间/min 批号5 10 15 30 20100915 56.26±3.8 93.65±3.4 100.35±2.5 100.07±1.8 20100916 54.05±4.2 90.38±3.6 100.11±2.1100.02±2.120100919 61.49±3.2 96.28±2.4 101.36±1.9 100.78±2.0
3 讨论
片剂溶出度测定最常用桨法。本试验采用的溶出介质体积为900 mL,得到的溶出溶液可以直接过滤测定,无需稀释,较文献[5]更为简单;且本试验的溶出度计算直接与对照品溶液的紫外吸光度进行对比,比文献[5]中将溶出液用稀硫酸稀释测定紫外吸收值,再由吸光系数折算含量计算溶出度更方便。盐酸美他嗪具有特征的紫外吸收,本文含量测定时采用紫外分光光度计法,较《日本药典》[3]中采用液相色谱法更为方便快捷。最终建立了桨法、转速为50 r·min-1、900 mL水作为溶出介质、温度(37±0.5)℃、紫外分光光度法测定并与对照品溶液的紫外吸光度进行对比计算溶出度的测定方法,溶出限度确定为30 min时溶出80%以上。
《日本药典》中曲美他嗪片溶出度限度为45 min溶出80%以上,这是根据日本的制剂处方中药物溶出较慢,30 min左右才完全溶出的情况[7]制定的。而本试验中试验片和市售片在15 min已经溶出完全,故而设定溶出度限度在30 min溶出80%以上。另一方面,由于制剂溶出迅速,也可以考虑以崩解度来评价药品质量。
[1]国家药典委员会.化学药品地方标准上升国家标准(第十三册)[S].2002:179.
[2]国家药典委员会.化学药品地方标准上升国家标准(第十五册)[S].2003:83.
[3]Japanese Pharmacopoeia Editorial Committee.Trimetazidine Hydrochloride Tablets.Japanese Pharmacopoeia(15th Edition)[S].Tokyo :The Society of Japanese Pharmacopoeia,2006:1 207-1 208.
[4]朱含涌,韦龙静,丁 泉,等.药物药剂学评价因素研究[J].中国药房,2008,19(26):2 077.
[5]石海英,侯筱筠,李振志,等.盐酸曲美他嗪片溶出方法的研究[J].齐鲁药事,2006,12(25):736.
[6]国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅤC.
[7]日本厚生省医药安全局编.国家食品药品监督管理局药审中心译.日本厚生省药品体外溶出试验信息库[DB/OL].http://www.cde.org.cn/recommend.do?method=view & id=65.2011-01.2011-02-24.

