自体与异体CIK细胞抗肿瘤效应的对照研究
董 毅,李月红,张飞虎,夏瑞祥
生物治疗是目前知道的唯一有望消灭肿瘤细胞的治疗手段,生物治疗将是肿瘤规范化治疗方案中一个主要部分。肿瘤的有效治疗,目前仍主要靠手术、放疗和化疗,它们的不彻底性和适应证限制,以及对机体的过分伤害使其在临床应用上受到了一定的限制。针对那些不能手术、或手术后放化疗不敏感的患者群及手术和放化疗后应需接续治疗的患者,目前绝大部分医疗单位尚无行之有效的方法,所以实施肿瘤的生物治疗方案已成为必然趋势。细胞因子诱导的杀伤细胞( cytokine-induced killer cells,CIK)是生物治疗中为数不多的同时具有广谱“杀伤”、纠正免疫功能、增强患者对治疗耐受性、实验技术成熟、临床疗效显著、毒副作用小、患者易于接受的重要生物治疗方法,亦是目前抗肿瘤最新、最好的免疫治疗方法。CIK细胞免疫治疗对多种肿瘤已显示较好的临床应用前景,如白血病、淋巴瘤、肝癌、肾癌、肺癌、乳腺癌等[1-3]。但关于自体与异体CIK细胞抗肿瘤效应的研究较少,本文通过比较自体与异体CIK细胞抗肿瘤效应,以探讨最有效的过继免疫治疗方法。
1 材料与方法
1.1 检测材料 CD3McAb(美国Pharmacia公司),rhIL-2,RPMI 1640,MTT(美国Sigma公司),rhIL-1,rhIFN-γand rhTNF-α(美国 Schering Plough公司),抗 CD3-FITC、抗 CD4-FITC、抗CD8-FITC、抗CD56-FITC、荧光标记的小鼠抗人HLADR-PE、CD1a-PE和CD14-PE(美国Gibco公司)。IL-12、IFN-γ、TNF-α试剂盒(深圳晶美生物制品公司)。流式细胞仪(美国Beckman Coulter公司)。白血病细胞株(K562细胞)、淋巴瘤细胞株(Raji细胞,上海生物制品研究所)。
1.2 检测方法
1.2.1 CIK细胞培养与扩增 分别把自体与异体的单个核细胞经人淋巴细胞分离液密度梯度离心获得外周血单个核细胞,用PBS洗涤2次,悬浮于含10%小牛血清的RPMI1640培养基中,在37℃、5%CO2培养箱中培养2 h,收集未贴壁细胞置于新的培养瓶中,调整细胞密度至1×106/m l,用于CIK细胞培养。当日加入IFN-γ(1 000 U/ml),24 h后加入CD3单抗(50μg/ml)、IL-2(300 U/ml)、IL-1α(100 U/ml),以后每3天补加新鲜培养基,并补加IL-2(300 U/ml)。
1.2.2 肿瘤细胞的传代培养 将Raji细胞及K562细胞加入含10%FBS的1640培养基悬浮,置于37℃,5%CO2,饱和湿度条件下传代培养,取对数生长期的细胞用于实验。
1.2.3 杀伤活性测定 取对数生长期的Raji细胞及K562细胞用0.4%的台盼蓝染色并计数,作为靶细胞,异体CIK细胞调整细胞浓度为1×106/ml作为效应细胞,效应细胞与靶细胞比例为5:1,10:1,20:1,40:1,自体CIK细胞作为阴性对照,置于96孔板,每组设三个复孔。置于37℃,5%CO2,饱和湿度条件下培养24 h,每孔加入MTT20μl继续孵育4 h,用酶标仪在570nm处读数,测定OD值,计算杀伤活性。杀伤活性(%)=[1-(实验孔OD值—效应孔OD值)/靶细胞孔OD值]×100%。
1.2.4 细胞的免疫表型检测 取培养7 d自体与异体的CIK细胞,通过流式细胞仪检测免疫表型。
1.2.5 细胞因子分析 用ELISA双抗体夹心法测定干扰素-γ(IFN-γ)、白介素-12(IL-12)、肿瘤坏死因子-α(TNF-α)的水平。
1.3 统计学方法 应用SPSS15.0软件分析结果。结果用±s表示,组间比较采用t检验,P<0.05为有统计学意义。
2 结果
2.1 自体与异体CIK细胞增殖能力分析 CIK培养第3~4天开始增殖,第7天数量明显增多。来自异体的单个核细胞培养后CIK细胞增殖速率明显提高。培养第15天,台盼蓝染色计数活细胞,自体CIK细胞总数扩增到原来的(48.52± 4.78)倍,而异体CIK细胞为(102.34±6.63)倍,2组差异有统计学意义(P<0.01)。见图1。
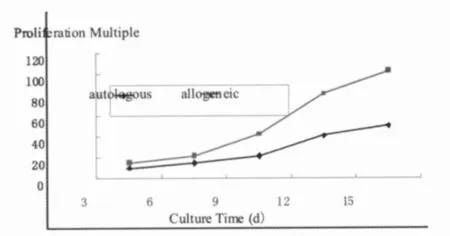
图1 自体与异体CIK细胞增殖能力分析
2.2 自体与异体CIK细胞杀伤活性测定 用MTT比色法测定2组细胞对Raji肿瘤细胞,K562肿瘤细胞的杀伤活性,结果表明,随着效靶比的增加,各组效应细胞对靶杀伤活性也增加;同一效靶比下,各组效应细胞杀伤活性不同,其中异体CIK对肿瘤细胞的杀伤活性最强(P<0.01)。见图2与图3。

图2 自体与异体CIK细胞对Raji细胞杀伤能力分析
2.3 自体与异体CIK细胞免疫表型检测 CIK细胞随着培养时间的延长,CD3+CD8+及CD3+CD56+细胞的比例逐渐增加,异体CIK细胞CD3+CD8+及CD3+CD56+双阳性细胞的比例明显高于同条件下自体CIK细胞组(P<0.05)。见表1。
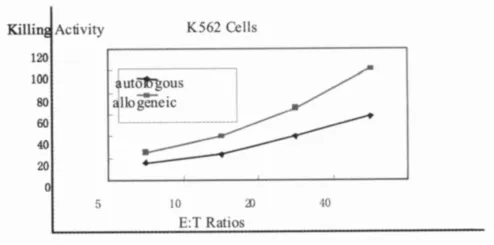
图3 自体及异体CIK细胞对K562细胞杀伤能力分析
2.4 自体与异体CIK细胞上清液中细胞因子分析 检测培养7天的CIK细胞分泌的IFN-γ、IL-12、TNF-α的水平,异体CIK细胞组明显高于自体CIK细胞组(P<0.05)。见表2。
表1 自体及异体CIK细胞免疫表型(±s,%)

表1 自体及异体CIK细胞免疫表型(±s,%)
CD3+ CD3+/CD4+ CD3+/CD8+CD3+/CD56+自体CIK细胞62.34±11.78 25.15±5.82 36.56±7.11 26.91±6.类别36异体CIK细胞81.02±15.52 16.35±5.41 52.11±9.73 39.64±8.02 t值2.524 8.111 10.997 9.002 P值 <0.05 <0.05 <0.05 <0.05
表2 自体及异体CIK细胞分泌的细胞因子(±s,ng/L)

表2 自体及异体CIK细胞分泌的细胞因子(±s,ng/L)
类别 IFN-γ IL-12 TNF-α 315.12±69.61 15.56±4.71 108.35±24.56异体CIK细胞 491.27±88.43 28.16±6.91 158.11±39.34 t值自体CIK细胞<0.05 <0.05 <0.05 11.291 10.512 2.488 P值
3 讨论
CIK细胞是将人外周血单个核细胞在体外用多种细胞因子(如抗CD3McAb、IL-2、IFN-γ、IL-1α等)共同培养一段时间后获得的一群异质细胞。由于该种细胞同时表达CD3和CD56两种膜蛋白分子,故又被称为NK细胞样T淋巴细胞,兼具有T淋巴细胞强大的抗癌症和肿瘤活性和NK细胞的非主要组织相容性复合体限制性杀癌症和肿瘤优点。应用CIK细胞被认为是新一代抗癌症和肿瘤过继细胞免疫治疗的首选方案。CIK细胞治疗是近年来开展的一种全新的肿瘤免疫治疗方法,对CIK细胞的体外培养特性及对实体瘤的治疗效果已做了大量的临床观察和探索。CIK细胞由CD3、CD4、CD8、CD3+CD56+、CD3-CD56+等不同阳性标记细胞组成,其发挥杀伤作用主要是CD8和CD3+CD56+细胞。流式细胞仪测定显示,CIK细胞群中CD8、CD3+CD56+阳性细胞比例明显升高,尤其是CD3+CD56+细胞更为突出,表明CIK有更强的杀灭肿瘤功能,更适合应用于临床。CIK细胞可用于下述肿瘤患者的辅助治疗:(1)手术后患者,可防止肿瘤转移复发;(2)无法进行手术、放疗、化疗的中晚期患者;(3)放疗、化疗失败的患者;(4)放疗或化疗后患者的综合治疗;(5)骨髓移植后或化疗缓解后的白血病患者;(6)癌性胸、腹腔积液患者。
CIK细胞的抗瘤效果主要与其杀伤活性及效应细胞与靶细胞的比例有关,理论上,CIK细胞的杀伤活性越高,输注的细胞数越多对肿瘤的治疗效果越好。实验结果提示:培养12~15 d的CIK细胞群增殖倍数最高,因此培养2周的CIK细胞可用于临床治疗。关于治疗中输注细胞量的问题,每疗程输注的细胞数大于(3~5)×109时,出现明显的治疗效果。临床观察表明,CIK细胞治疗肿瘤的总有效率为35.7%,不同肿瘤的疗效并不相同。目前,CIK细胞主要用于自体骨髓移植物的净化、微小残留病灶的清除及晚期恶性肿瘤(包括急慢性血液系统恶性疾病和各种实体瘤)的免疫治疗。CIK细胞产生干扰素-γ和TNF–α有显著的数额,但只产生微量的IL-2和IL-4和IL-5,在一个30:1的效应靶细胞比例,CIK细胞摧毁人肝癌细胞,1×106个CIK细胞抑制小鼠肿瘤的生长,这项研究表明,CIK细胞可作为过继免疫治疗用于原发性肝癌患者。BorleriG等[4]发现CIK细胞联合造血干细胞移植,显示较好的抗白血病活性且不增加移植物抗宿主反应,这些自体细胞的安全性被证明。急性白血病患者化疗加CIK细胞与单纯化疗相比较完全缓解率明显增高[5]。对淋巴瘤、多发性骨髓瘤、肺癌等肿瘤的治疗达到同样的效果[6]。
在这项研究中,我们比较了自体与异体CIK细胞抗肿瘤效应,实验结果表明:异体CIK有更强的增殖能力,培养第15天,台盼蓝染色计数活细胞,自体CIK细胞总数扩增到原来的(48.52±4.78)倍,异体CIK细胞为(102.34±6.63)倍,用MTT比色法测定自体与异体 CIK细胞对Raji肿瘤细胞和K562肿瘤细胞的杀伤活性,结果表明,随着效靶比的增加(5: 1,10:1,20:1,40:1),各组效应细胞对靶杀伤活性也增加;同一效靶比下,各组效应细胞杀伤活性不同,异体CIK对肿瘤细胞的杀伤活性最强,显着提高了抗肿瘤活性[7-8]。异体CIK细胞CD3+CD8+及CD3+CD56+双阳性细胞的比例明显高于同条件下自体CIK细胞组。异体CIK细胞促进了IFN-γ、IL-12、TNF-α的分泌,保持了CIK细胞活性,与报道一致[9-10]。
经过化疗和放射治疗,癌症患者往往会出现白细胞减少,贫血及其他严重副作用,免疫功能遭到严重破坏,外周血中单个核细胞数量远少于健康人,此外,由单个核细胞诱导的CIK细胞数量及生物活性明显降低,异体CIK细胞有IFN-γ、IL-12、TNF-α的高分泌,提高了CIK细胞的细胞毒性和增值率,临床研究和体外实验数据已经表明,异体细胞免疫治疗不仅大大提高了抗肿瘤效应,且无自身免疫反应及其他副作用,显示较好的安全性,提供了一个过继细胞免疫治疗的新方法。异体CIK细胞将具有广泛的临床应用前景,在抗肿瘤免疫治疗中将发挥重要作用[11-12]。
[1] Steele L,Errington F,Prestwich R,et al.Pro-inflammatory cytokine/ chemokine production by reovirus treated melanoma cells is PKR/ NF-kappaB mediated and supports innate and adaptive anti-tumour immune priming[J].Mol Cancer,2011,10(1):20-25.
[2] 江 浩,刘开彦,童春容,等.化疗联合自体细胞因子诱导杀伤细胞治疗急性白血病的临床观察[J].中华内科杂志,2005,44 (3):198-201.
[3] Sun Y,Chen J,Cai P,et al.Therapy of relapsed or refractory non-Hodgkin's lymphoma by antigen specific dendric cells-activated lymphocytes[J].Journal of Experimental Hematology,2010,18(1): 219-223.
[4] Introna M,BorleriG,Conti E,et al.Repeated infusions of donor-derived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation:a phase I study[J].Haematologica,2009,92(7):952-9.
[5] Jiang H,Liu KY,Tong CR,et al.The efficacy of chemotherapy in combination with auto-cytokine-induced killer cells in acute leukemia[J].Chinese Journal of Internal Medicine,2005,44(3):198-201.
[6] Pievani A,Belussi C,Klein C,et al.Enhanced killing of human B-cell lymphoma targets by combined use of cytokine-induced killer cell(CIK)cultures and anti-CD20 antibodies[J].Blood,2011,117 (2):510-8.
[7] 陈宝安,李 曼,孙载阳,等.树突细胞联合细胞因子诱导的杀伤细胞对耐药K562细胞的体外杀伤作用[J].中华血液学杂志,2005,26(6):355-358.
[8] 王平乐,董 毅,夏瑞祥,等.细胞因子诱导的杀伤细胞对细胞的杀伤效应及机制的实验研究[J].中国医药,2006,1(10):594-596.
[9] Wang QJ,Wang H,Pan K,et al.Comparative study on anti-tumor immune response of autologous cytokine-induced killer(CIK)cells,dendritic cells-CIK(DC-CIK),and semi-allogeneic DC-CIK[J].Chin JCancer,2010,29(7):641-648.
[10]Bonanno G,Iudicone P,Mariotti A,et al.Thymoglobulin,interferonγ and interleukin-2 efficiently expand cytokine-induced killer (CIK)cells in clinical-grade cultures[J].J Transl Med,2010,7 (8):129-134.
[11]Brady J,Carotta S,Thong RP,etal.The interactions ofmultiple cytokines control NK cell maturation[J].J Immunol,2010,185(11): 6679-6688.
[12] Yang G,Tan J,Wei G,et al.Effects of ex vivo activated immune cells on syngeneic and semi allogeneic bone marrow transplantation in mice[J].Transpl Immunol,2006,16(3-4):166-171.

