荒漠植物红砂响应高浓度NaCl的生理机制
周航宇,包爱科,杜宝强,王锁民
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
我国北方荒漠区广泛分布的超旱生植物红砂(Reaumuriasoongorica)为柽柳科(Tamaricaceae)红砂属小灌木[1-2],在盐碱地改良、防风固沙及保护绿洲等方面具有重要的生态功能[3-7];同时,红砂还是荒漠区的优良牧草,以红砂为建群种的草地,是草原化荒漠和典型荒漠地区家畜的主要放牧地[5,8]。
红砂属典型的泌盐植物,既具有很强的耐盐性,又有很强的抗旱性,是一种典型的盐生-旱生植物,其体内必然存在耐盐-抗旱的协调机制[6-7],对该机制展开深入研究具有重要的科学意义。近年来,学术界对红砂进行了大量研究,主要集中在种群、水分生理生态学、种子萌发、劈裂生长、遗传多样性、内源激素和盐腺结构及其泌盐机制[9-11]等方面。有关红砂对高浓度盐处理的响应,特别是盐胁迫下其泌盐及Na+分配机制的相关研究还未见报道。
本研究通过分析高浓度NaCl处理下红砂的生长状况、盐腺的泌盐量以及植株体内的离子水平,初步探讨红砂对高盐胁迫的响应机制,旨在为理解泌盐植物的抗逆机制提供理论依据。
1 材料与方法
1.1材料培养及处理 挑选籽粒饱满、无缺损、均匀一致的红砂种子(2010年采自甘肃民勤),去掉外壳后于75%的乙醇中浸泡10 min,然后用蒸馏水冲洗4~5次,置于铺有滤纸的培养皿中并置于黑暗中28±2 ℃下催芽3 d。待种子萌发后,栽植于装有蛭石中,浇灌1/2 Hoagland营养液进行培养。每隔1 d换一次营养液,温室的昼夜温度为28 ℃/23 ℃,光照16 h·d-1,光强度约1 200 μmol·m-2·s-1,相对湿度为50%~70%。
红砂生长7周后,选取长势良好且大小一致的幼苗,用添加50 mmol·L-1NaCl的1/2 Hoagland营养液浇灌,每隔1 d以50 mmol·L-1NaCl递增,至终浓度150 mmol·L-1后每天更换一次溶液,以保持NaCl浓度的相对恒定。到达终浓度维持7 d后取样测量有关指标,每个指标取5个重复,每个重复包含10株幼苗。以浇灌不添加NaCl的1/2 Hoagland营养液的处理为对照。
1.2指标的测定
1.2.1鲜质量、干质量和组织含水量的测定 用去离子水快速冲洗样品表面灰尘和盐分,用吸水纸吸干表面水分,迅速分成根、地上部,然后称地上部鲜质量(Wf),同时把根放入20 mmol·L-1的冷LiNO3中漂洗2次(各4 min),以交换根质外体中的离子,之后用去离子水冲洗3次,吸干表面水分,称取鲜质量。将称过鲜质量的地上部和根于80 ℃烘箱48 h后称取其干质量(Wd)。根据以下公式计算组织含水量:
组织含水量=(Wf-Wd)/Wf×100%。
1.2.2盐腺分泌Na+、K+和Ca2+量的测定 采用洗叶法[12],将红砂地上部分浸泡在10 mL去离子水中 10 min,洗去其表面盐分,注意不要让茬口浸泡在水中,防止电介质外渗。将浸洗液定容至25 mL,稀释适当倍数后,用火焰分光光度计(2655-00)测定浸洗液中Na+、K+和Ca2+含量。盐腺泌盐量以每克地上部鲜质量中分泌的阳离子量(μmol·g-1)表示。
1.2.3红砂植株体内Na+、K+、Ca2+含量的测定和根系Na+净吸收速率的计算 将烘干至质量恒定的样品的根和地上部分并捣碎后分别放入试管中,加入100 mmol·L-1的冰乙酸10 mL后,密封试管,置于90 ℃水浴锅加热2 h,冷却,过滤。将提取液稀释适当倍数后,在火焰光度计上测定Na+、K+和Ca2+的含量,以每克干质量中的阳离子含量表示其浓度。并计算根系Na+净吸收速率(nmol·g-1·min-1)[13]:
根系Na+净吸收速率(n天后)=(处理n天后的整株Na+含量-处理前的整株Na+含量)/[根鲜质量(n天后)·处理时间]。
1.3数据分析 用SPSS 16.0软件(SPSS Inc.,USA)对数据进行单因素方差分析(ANOVA),用Duncan多重比较进行差异显著性分析,最小差异显著性水平为P=0.05。
2 结果与分析
2.1NaCl处理对红砂鲜质量、干质量和组织含水量的影响 与对照相比,150 mmol·L-1NaCl处理7 d后,红砂地上部鲜质量和干质量分别显著增加了14%和18%,但其根鲜质量和干质量则无显著变化(图1A,B),同时红砂各部位的组织含水量与对照无显著差异(图1C)。上述结果表明150 mmol·L-1NaCl处理促进了红砂地上部的生长,而且红砂体内的水分状况也保持稳定。
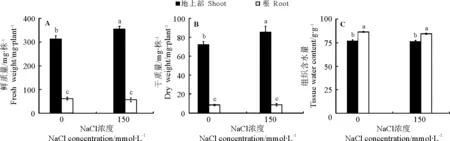
图1 150 mmol·L-1 NaCl处理7 d后红砂的鲜质量(A)、干质量(B)和组织含水量(C)
2.2NaCl处理对红砂盐腺分泌Na+、K+和Ca2+量的影响 150 mmol·L-1NaCl处理7 d后,红砂盐腺对K+、Ca2+的分泌量与对照无显著差异,但对Na+的分泌量显著高于对照,为对照的22.9倍,占3种阳离子分泌总量的82.2%(图2)。表明在高盐浓度下,红砂能够通过盐腺将大量的Na+分泌出体外,且盐腺对Na+具有高度的选择性。
2.3NaCl处理对红砂整株Na+、K+和Ca2+浓度的影响 150 mmol·L-1NaCl处理7 d后,红砂地上部和根中Na+浓度均显著增加,分别是对照的2.1和1.5倍(图3A),而K+浓度比对照分别下降了35.7%和51.4%(图3B);然而与Na+和K+不同,150 mmol·L-1NaCl处理对红砂体内Ca2+浓度无显著影响(图3C)。说明盐胁迫下红砂能在体内积累大量Na+,同时还保持Ca2+水平的稳定。
2.4NaCl处理对红砂整株Na+分配格局及根系Na+吸收的影响 进一步分析表明,在150 mmol·L-1NaCl处理下,红砂整株Na+分配格局发生了显著的变化,其Na+分泌量的占整株Na+总量的百分率由对照的4.3%增加到35.0%;地上部积累的Na+比例虽略有降低,但仍然高达43.0%;通过盐腺分泌和地上部积累的Na+占整株Na+总量的78.0%,比对照显著增加了21.4%(表1)。值得注意的是,与对照相比,在150 mmol·L-1NaCl处理下,红砂Na+净吸收速率显著提高,比对照增加了44倍(图4)。以上结果说明,地上部泌Na+和积累Na+均是红砂适应盐渍环境的重要机制,而其根系强大的Na+吸收能力为上述过程提供了支持。

图2 150 mmol·L-1 NaCl处理7 d后红砂盐腺分泌阳离子的量
3 讨论与结论
红砂是一种抗盐性和抗旱性均很强的泌盐型荒漠植物[1-2]。本研究中,150 mmol·L-1NaCl能显著促进红砂地上部的生长。类似的现象在一些盐生植物如细叶滨藜(Atriplexgmelini)和盐地碱蓬(Suaedasalsa)等及多浆旱生植物霸王(Zygophyllumxanthoxylum)等中均有报道[14-16];谭会娟等[9]的研究也发现,100~150 mmol·L-1NaCl对红砂愈伤组织的生长也具有显著的促进作用。在高盐胁迫下,植物除了直接遭受盐害外,往往还会遭遇生理干旱[17-18]。因此,在盐胁迫下保持体内良好的水分状况对植物能否正常生长至关重要。本研究中,在150 mmol·L-1NaCl处理下,红砂的组织含水量依然保持在对照的水平,这为维持其叶片膨压,保持其细胞各项重要生命活动的正常进行,从而促进其生长提供了重要保障。

图3 150 mmol·L-1 NaCl处理7 d后红砂体内Na+(A)、K+(B)和Ca2+(C)浓度

表1 150 mmol·L-1 NaCl处理7 d后红砂整株Na+的分配

图4 150 mmol·L-1 NaCl处理7 d后红砂根系Na+净吸收速率
大多数积盐型盐生植物和多浆旱生植物适应盐渍或干旱生境的主要策略是通过离子区域化将大量Na+积累在叶细胞的液泡中,一方面可减轻Na+对细胞的毒害,另一方面将Na+作为一种廉价的渗透调节剂维持植株的渗透势,从而提高植株的抗逆性[16,19-21]。然而,泌盐植物适应盐渍环境的方式有所不同,它们主要通过盐腺排出体内过剩的盐分,降低体内各组织的含盐量,从而对盐生境产生一定的适应性[22-25]。本研究也支持了上述结论,在高盐处理下,红砂的泌盐量急剧上升,将大量盐分排出体外;而分泌的阳离子中,Na+占主要比例,这也验证了前人关于盐腺对Na+具有高度选择性的观点[7,22]。
除泌盐外,本研究还发现盐胁迫下红砂地上部Na+积累量显著上升,其在整株Na+分配中的比例与盐腺分泌Na+的比例相当,王文卿和林鹏[26]在红树(Rhizophoraapiculata)、陈阳等[27]在柽柳(Tamarixchinensis)等泌盐植物上也发现了类似的规律,说明泌盐植物适应盐胁迫过程中也存在Na+区域化。大量细胞水平的证据显示,当植物泌盐时,盐腺周围组织中的盐分通常先被转运至收集细胞并区域化在其大液泡中;然后转运至分泌细胞并积累在其小液泡内;小液泡不断向分泌细胞膜的一侧移动,最终由外侧的分泌细胞通过其质膜排出体外[28-29]。因此,在盐渍生境中,泌盐植物可能通过盐腺泌盐和离子区域化两个重要生理过程的密切协作,实现减轻Na+毒害和维持渗透平衡的双重效果。对上述两个过程及其内部调控机制的深入研究对于全面理解泌盐植物的抗逆机制具有重要意义。
另外,Ca2+在植物耐盐性和抗旱性方面也发挥一系列重要的作用,如稳定细胞壁和细胞膜,刺激细胞对K+的吸收、调节水分平衡以及充当第二信使等[30]。在盐胁迫下,尽管红砂体内K+浓度有所下降,但Ca2+浓度却维持在稳定水平。特别是其在整株中的分配格局与对照相差不大,这可能也是红砂适应盐渍环境的又一重要保障。
综上所述,本研究发现150 mmol·L-1NaCl对泌盐植物红砂的生长具有显著的促进作用;在150 mmol·L-1NaCl处理下,红砂能够通过盐腺泌盐和离子区域化等过程的协同调节,减轻过量Na+对植株的毒害,并提高植株的渗透调节能力;此外,维持体内Ca2+水平的稳定也是红砂保持正常生长的重要原因。
[1]刘家琼,邱明新,蒲锦春,等.我国荒漠典型超旱生植物——红砂[J].植物学报,1982,24(5):485-488.
[2]刘家琼,蒲锦春,刘新民.我国沙漠中部地区主要不同生态类型植物的水分关系和旱生结构比较研究[J].植物学报,1987,29(6):662-673.
[3]马茂华,孔令韶.新疆呼图壁绿洲外缘的琵琶柴生物生态学特性研究[J].植物生态学报,1998,22(3):237-244.
[4]马剑英,陈发虎,夏敦胜,等.荒漠植物红砂叶片δ13C值与生理指标的关系[J].应用生态学报,2008,19(5):1166-1171.
[5]种培芳,李毅,苏世平,等.红砂3个地理种群的光合特性及其影响因素[J].生态学报,2010,30(4):914-922.
[6]Liu Y,Li X,Tan H,etal.Molecular characterization ofRsMPK2,a C1 subgroup mitogen-activated protein kinase in the desert plantReaumuriasoongorica[J].Plant Physiology and Biochemistry,2010,48:836-844.
[7]Gorai M,Neffati M.Osmotic adjustment,water relations and growth attributes of the xero-halophyteReaumuriavermiculataL.(Tamaricaceae) in response to salt stress[J].Acta Physiologiae Plantarum,2010,33:1425-1433.
[8]任继周.河西走廊山地-绿洲-荒漠复合系统及其耦合[M].北京:科学出版社,2007:181-187.
[9]谭会娟,贾荣亮,刘玉冰,等.NaCl胁迫下红砂愈伤组织中主要离子累积特征的研究[J].中国沙漠,2010,30(6):1305-1310.
[10]周红兵,王迎春,石松利,等.NaCl胁迫对盐生植物长叶红砂幼苗内源激素的影响[J].内蒙古大学学报(自然科学版),2010,41(5):531-535.
[11]陈阳,王贺,张福锁,等.盐渍生境下野生琵琶柴盐分分布及泌盐特点[J].土壤学报,2004,41(5):774-779.
[12]Wang C M,Zhang J L,Liu X S,etal.Puccinellia tenuiflora maintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+[J].Plant,Cell and Environment,2009,32:486-496.
[13]Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyteSuaedamaritima[J].Plant Physiology,2007,145:559-571.
[14]Bajji M,Kinet J M,Lutts S.Salt stress effects on roots and leaves ofAtriplexhalimusL.and their corresponding callus cultures[J].Plant Science,1998,137:131-142.
[15]张海燕,赵可夫.盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究[J].植物学报,1998,40(1):56-61.
[16]Ma Q,Yue L J,Zhang J L,etal.Sodium chloride improves photosynthesis and water status in the succulent xerophyteZygophyllumxanthoxylum[J].Tree Physiology,2011,DOI:10.1093/treephys/TPR098.
[17]Zhu J K.Plant salt tolerance[J].Trends in Plant Science,2001(6):66-71.
[18]Kronzucker H J,Britto D T.Sodium transport in plants:a critical review[J].New Phytologist,2011,189:54-81.
[19]Blumwald E,Poole R J.Na+/ H+antiporter in isolated tonoplast vesicles from storage tissue of Beta vulgaris[J].Plant physiology,1985,78:163-167.
[20]Wang S M,Zhao G Q,Gao Y S,etal.Puccinelliatenuifloraexhibits stronger selectivity for K+over Na+than wheat[J].Journal of Plant Nutrition,2004,27:1841-1857.
[21]Gaxiola R A,Palmgren M G,Schumacher K.Plant proton pumps[J].FEBS Letters,2007,581:2204-2214.
[22]Ramadan T.Ecophysiology of salt excretion in the xero-halophyteReaumuriahirtella[J].New Phytologist,2008,139:273-281.
[23]韩军丽,赵可夫.植物盐腺的结构、功能和泌盐机理的探讨[J].山东师范大学学报(自然科学版),2001,16(2):194-198.
[24]Liu Y,Wang G,Liu J,etal.Anatomical,morphological and metabolic acclimation in the resurrection plantReaumuriasoongoricaduring dehydration and rehydration[J].Journal of Arid Environments,2007,70:183-194.
[25]薛焱,王迎春.盐生植物长叶红砂泌盐特性的研究[J].中国沙漠,2008,28(3):437-443.
[26]王文卿,林鹏.红树植物体内元素分布特点与抗盐机理[J].林业科学,2003,39(4):30-36.
[27]陈阳,王贺,张福锁,等.新疆荒漠盐碱生境柽柳盐分分泌特点及其影响因子[J].生态学报,2010,30(2):511-518.
[28]Vassilyev A E,Stepanova A A.The ultrastructure of ion-secreting and non-secreting salt glands ofLimoniumplatyphyllum[J].Journal of Experimental Botany,1990,41:41-46.
[29]Semenova G A,Fomina I R,Biel K Y.Structural features of the salt glands of the leaf ofDistichlisspicata‘Yensen 4a’(Poaceae)[J].Protoplasma,2010,240:75-82.
[30]Yang T,Poovaiah B W.Hydrogen peroxide homeostasis: activation of plant catalase by calcium/calmodulin[J].Proceedings of the National Academy of Sciences,USA,2002,99:4097-4102.

