染料木黄酮对大鼠异位子宫内膜组织中MMP-9、TIMP-1表达的影响
郑 兰 朴松哲 金延泽,*
1.吉林省延边大学附属医院妇产科(延吉,133000);2.吉林省延边大学附属医院核医学科
子宫内膜异位症(EMs)具有种植、浸润、扩散、远处转移及复发等类似于恶性肿瘤的特点,一些肿瘤相关因子如基质金属蛋白酶(MMPs)在内膜异位症中的作用日益受到重视,基质金属蛋白酶抑制剂(TIMPs)是其天然特异性抑制因子。近年研究表明,二者体内表达与EMs的发生、发展密切相关。本实验通过建立大鼠EMs模型,观察染料木黄酮(GEN)治疗后移植物的体积变化和病理学改变,探讨GEN对大鼠EMs组织中MMP-9和TIMP-1表达的影响,为临床治疗EMs提供一条新的途径。
1 材料与方法
1.1 试验动物及试剂
体重200~250g的Wistar雌性大鼠68只(清洁级)由延边大学基础医学院动物科提供。GEN购于西安中鑫生物技术有限公司;17β-雌二醇购于北京天利生物化工公司;MMP-9兔抗大鼠多克隆抗体(即用型)、TIMP-1兔抗大鼠多克隆抗体(即用型)、SABC(兔IgG)-POD试剂盒购于武汉博士德生物技术有限公司。
1.2 方法
1.2.1 EMs模型建立 选择有两个以上正常动情周期(阴道涂片为大量无核角化细胞)的大鼠。造模前一天每只鼠皮下注射己烯雌酚0.1mg/kg.d,使其统一处于动情期。模型组(60只):10%的水合氯醛300mg/kg腹腔注射麻醉,腹部备皮,切口约2cm,钝镊找到并分离出大鼠右侧子宫,在右侧子宫靠近输卵管处及两侧子宫交接处分别结扎,剪下中间的子宫片段,迅速置于盛有生理盐水的弯盘中,沿系膜部位剪开管状子宫,切割成4mm×4mm大小的子宫片,注意区分内外膜。钝性分离腹壁切口两侧的腹肌与皮下筋膜层,以正好能置入子宫片为宜,左右各一,分别将切割好的子宫片平整地置入两侧腔隙底部,使内膜面紧贴腹肌,逐层连续缝合腹部切口,常规关腹。注意观察大鼠的呼吸、心跳,等待其自然苏醒。正常组(A组,8只):开腹之前同造模组,腹后将右侧子宫角结扎,常规关腹。目的使该组达到与模型组均为单侧宫角子宫的生殖环境。
1.2.2 术后处理方法 术后所有大鼠均常规禁食水6h,并肌内注射青霉素0.1ml/d预防感染,共5d。术后第2天开始为造模组大鼠肌注17β-雌二醇0.1mg/kg.d,溶解于 0.1ml芝麻油中,每隔 3d 1 次共21d,以促进异位内膜生长。假手术组仅注射同剂量芝麻油。手术后每周观察2次,有无形成包块,21d后观察移植物的生长情况,用游标卡尺测量移植物的体积(长×宽×高,mm3)并记录,术后无大鼠因感染死亡。
1.2.3 实验分组及给药方法 将EMs组大鼠随机分为4组:模型组(B组,15只)每日皮下注射芝麻油0.05ml。GEN治疗组分为低剂量组(C 组,0.5mg/kg,15 只),中剂量组(D 组,5mg/kg,15 只),高剂量组(E 组,100mg/kg,15 只),将 GEN 溶解于 0.05ml芝麻油中,日1次皮下注射,A组同B组每日皮下注射芝麻油 0.05ml,共 84d。
1.2.4 病理检查 末次给药后24h时取出移植物测量其体积。全部标本经10%中性福尔马林液固定,常规石蜡包埋,切片厚4~5μm,HE染色,光镜下观察。
1.2.5 观察指标 治疗前、后造模组大鼠移植物体积变化;病理学变化;全部标本做HE染色,观察各组移植物腺体厚度和内膜上皮细胞的厚度;观察移植物内膜中MMP-9和TIMP-1的表达。
1.2.6 结果判定 MMP-9阳性判断标准为腺上皮细胞胞浆呈棕黄色着色,间质中也有表达。随机选取高倍镜(×400)下至少5个视野[1],结果按染色强度分为阴性(-),弱阳性(+),中等阳性(++),强阳性(+++)。
1.3 统计学分析
实验数据采用SPSS14.0软件进行统计学处理,采用Fisher确切概率法。
2 结果
2.1 治疗前后移植物体积变化
造模后第3周,所有造模组大鼠左或右下腹可见子宫内膜种植结节。剪去大鼠腹部毛发可见种植物呈类球形突出,其内部充满淡黄色或淡红色液体,与周围组织有轻度粘连。GEN治疗12周后,C组、D组大鼠种植物肉眼观察治疗前后情况相近,测量体积无明显差异;E组移植物萎缩成扁平的斑块状物,治疗前后体积有差异(P<0.01)。见表1。
2.2 移植物镜下观察
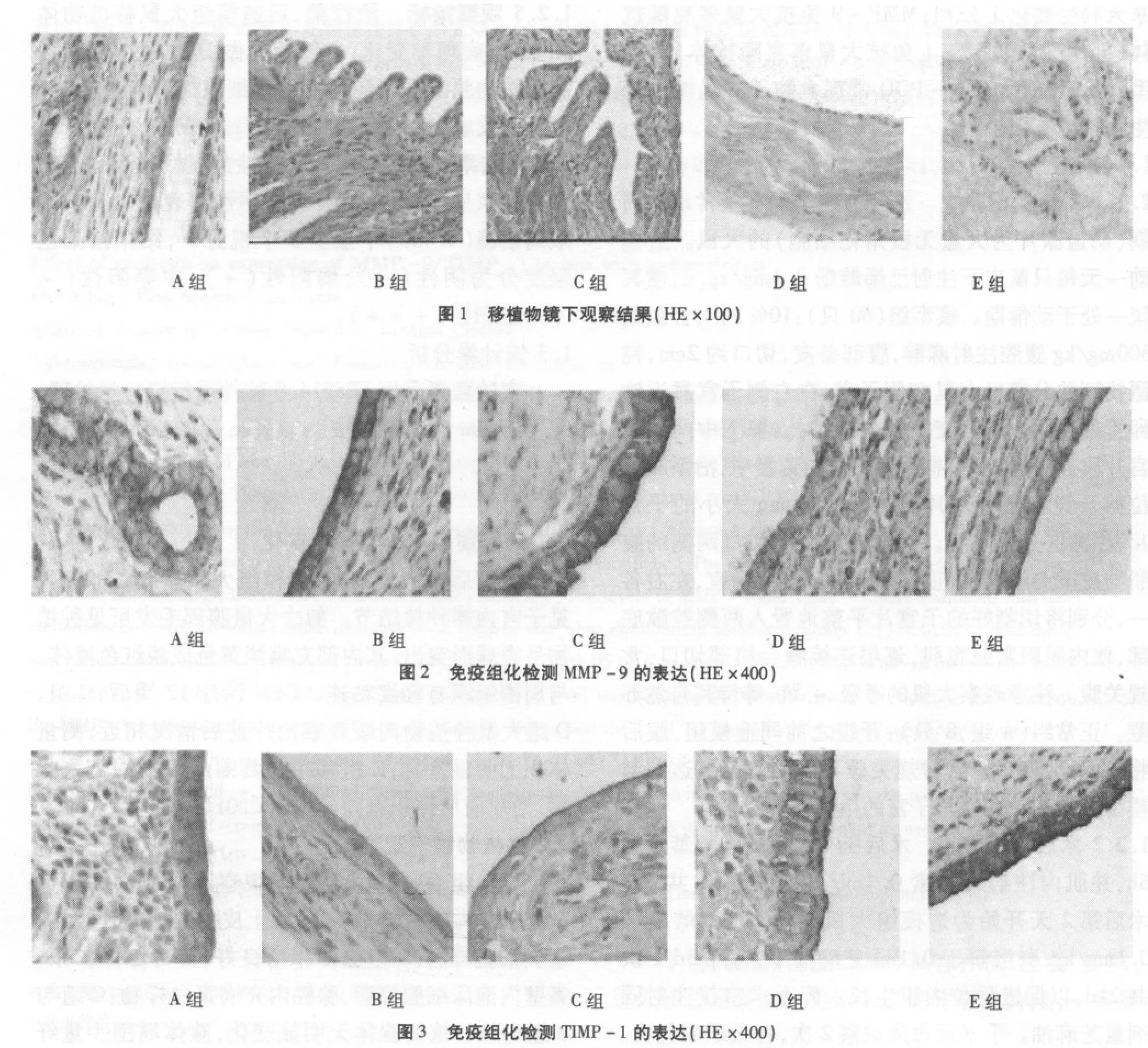
EMs组60只大鼠,镜下观察建模成功41只。A组子宫内膜腺体无扩张,腺上皮排列规整,间质少量炎细胞浸润;B组腺体存活良好,部分腺体扩张,囊壁内泡沫细胞浸润,腺腔内充满蛋白样物;C组与B组比较移植物腺体无明显变化,腺体周围少量纤维组织增生;D组腺体轻度扩张,腺上皮被挤压,变扁,部分处脱落,周围泡沫细胞浸润,腺体周围较多纤维组织增生。E组腺体明显萎缩,部分脱落入腔内,脱落超过50%,腺上皮被挤压,变扁,周围大量纤维组织增生。见图1。
表1 各组GEN治疗前后移植物体积比较(mm3,±s)
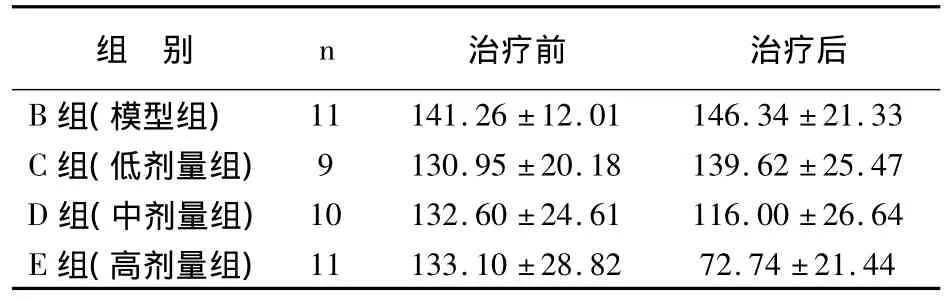
表1 各组GEN治疗前后移植物体积比较(mm3,±s)
组 别 n 11 141.26 ±12.01 146.34 ±21.33 C 组(低剂量组) 9 130.95 ±20.18 139.62 ±25.47 D 组(中剂量组) 10 132.60 ±24.61 116.00 ±26.64 E组(高剂量组)治疗前 治疗后B组(模型组)11 133.10 ±28.82 72.74 ±21.44
2.3 免疫组化分析
2.3.1 MMP -9表达情况 B 组(8 例,74.7%)与 A组(1例,12.5%)内膜组织中MMP-9阳性表达率明显增高(P <0.05);C 组(6例,66.7%)、D 组(6例,60.0%)与B组比较MMP-9阳性表达率无明显差异;E组(2例,18.2%)与B组比较MMP-9阳性表达率明显下降(P<0.05)。见图2。
2.3.2 TIMP -1 的表达情况 B 组(3例,27.3%)与A组(7例,87.5%)TIMP-1阳性表达率明显降低(P <0.01);C 组(4例,44.4%)、D 组(5例,50.0%)与B组比较TIMP-1阳性表达率无明显差异(P>0.05);E组(9例,81.8%)与 B组比较TIMP-1阳性表达率升高(P<0.05)。见图3。
3 讨论
EMs是一种激素依赖性疾病,具有类似恶性肿瘤的特性,即远处转移和侵袭的特性。细胞外基质(ECM)的降解和重建是子宫内膜异位症发病的关键环节[2]。MMPs是一组能降解大多数 ECM及各种类型胶原的锌依赖性蛋白水解酶,在许多生理和病理过程中都发挥着重要作用。其中MMP-9由于经常表达于具有高转移潜能的癌株而备受关注,TIMPs是近年来发现的MMPs的天然抑制物,二者在协调ECM成分的合成与降解过程中起重要作用。本实验中,MMP-9和TIMP-1在正常子宫内膜及EMs组织中均有阳性表达,主要表达于子宫内膜腺上皮细胞和间质细胞胞浆中。B组中异位内膜组织MMP-9异常高表达,而TIMP-1表达水平降低。MMP-9与TIMP-1表达失衡,可能改变了腹腔ECM的生长和重建过程,促使ECM降解,增强子宫内膜异位症病灶的侵袭性,从而有助于EMs的发生发展[3]。由此可见EMs组织中MMP-9表达增强,TIMP-1表达减弱,与EMs发生、发展密切相关[4],MMP-9与TIMP-1表达失衡可能是EMs发病的机制之一。
实验结果表明:GEN可以抑制大鼠EMs组织腺体中MMP-9阳性表达,GEN高剂量组效果最为明显,GEN低剂量组和中剂量组无明显差异,MMP-9表达与GEN剂量成量效关系,高剂量的GEN抑制大鼠EMs组织腺体中MMP-9的过度表达,抑制其降解ECM的能力,阻止异位子宫内膜细胞不断破坏基底膜,降解腹膜及周围组织,达到治疗效果。免疫组化结果显示:GEN具有上调大鼠EMs组织腺体中TIMP-1阳性表达的作用,增强了EMC的防御能力,使异位子宫内膜细胞在腹腔内种植、生长、扩散的能力减弱。GEN治疗后EMs组织中MMP-9表达下降,TIMP-1表达升高,说明GEN可以下调MMP-9且上调TIMP-1的表达,恢复二者间的平衡,抑制ECM的降解,增强其防御能力,抑制异位内膜细胞在腹腔内种植、生长、扩散。另外,有试验和临床数据表明,异位内膜组织越多,其周围血供就越丰富,在异位内膜组织中,MMP-9高表达和TIMP-1低表达与异位病灶区血管生成呈正相关[5],为EMs增殖、扩散创造了条件。GEN能下调MMP-9的表达水平,上调TIMP-1的表达水平,调节MMP-9/TIMP-1之间的平衡,抑制血管生成素诱导的血管内皮细胞出芽生长等,防止ECM降解,维持血管稳定性,抑制EMs的发展。
GEN可抑制大鼠EMs模型中异位内膜的生长,其抑制作用可能与MMP-9表达下降和TIMP-1表达升高,平衡MMP-9和TIMP-1的表达有关。GEN有望成为一种治疗EMs的新物质,MMP-9/TIMP-l的调节受多种因素影响,其确切机制还有待进一步研究。
1 吴秉铨,刘彦仿.免疫组织化学病理诊断[M].北京:北京科学技术出版社,2007:52-53.
2 Sillem M,Prifti S,Koch A,et al.Regulation ofmatrixmetalloproteinases and their inhibitors in uterine endometrial cells of patients with and without endometriosis[J].Eur J Obstet Gynecol Reprod Biol,2001,95(2):167 -174.
3 Paraskeva PA,Ridgway PF,Olsen S,et al.A surgically induced hypoxic environme-nt causes changes in the metastatic behaviour of tumours in vitro[J].Clin Exp Metastasis,2006,23(2):149 - 157.
4 Salata IM,Stojanovic N,Cajdler- Luba A,et al.Gelatinase A(MMP-2),gelatinase B(MMP-9)and their inhibitors(TIMP -1,TIMP-2)in serum of women with endometriosis:Significant correlation between MMP-2,MMP-9 and their Inhibitors without difference in levels ofmatrixmetalloproteinases and tissue Inhibitors ofmetalloproteinases in relation to the severity of endometriosis[J].Gynecol Endocrinol,2008,24(6):326 -330.
5 Ria R,Loverroq G,Vacca A,et al.Angiogenesis extent and expression ofmatrixmetalloproteinase-2 and- 9 agree with progression of ovarian endometriomas[J].Eur JClin Invest,2002,32(3):199 -206.
[责任编辑:王丽娜]

