表皮生长因子及其受体、转化生长因子-α在实验性胃溃疡愈合中的作用
张 静,房 涛,马义腾,吴靖芳,张江兰,张文静
(1.河北北方学院组织胚胎学教研室,河北 张家口075000;2.河北省张家口市第一医院心胸外科,河北 张家口075000;3.河北北方学院临床医学本科2010级2班,河北 张家口075000)
胃溃疡是消化系统较为常见的疾病之一,全球约有10%的人患有此病[1],其病理变化主要表现为黏膜完整性的破坏。溃疡后的黏膜修复过程直接关系到疾病的转归,这一过程是多种分子相互作用的复杂过程[2-3]。胃黏膜表皮生长因子 (epidermal growth factor,EGF)及其受体 (epidermal growth factor receptor,EGFR)、转化生长因子 (transforming growth factor-alpha,TGF-α)是重要的黏膜保护因子,在维持胃黏膜的完整性和促进胃黏膜的增殖、修复中发挥重要作用。本研究通过建立实验性大鼠胃溃疡模型,对胃黏膜EGF、EGFR、TGF-α进行定位及定量检测,探讨它们在胃黏膜修复过程中的意义。
1 材料和方法
1.1 材料与试剂
雄性8周龄SD大鼠购自北京维通利华实验动物技术有限公司,共48只,体质量180~230 g。兔抗大鼠EGF、EGFR、TGF-α多克隆抗体购自武汉博士德生物技术有限公司;SP9001试剂盒、DAB显色剂购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 动物模型建立及取材 48只大鼠按照随机数字表法分为实验性胃溃疡组 (简称溃疡组,n=42)和正常组(n=6)。正常组为正常大鼠,不做任何处理。模型组用0.3 g·L-1戊巴比妥钠(40 mg·kg-1)腹腔麻醉大鼠,在无菌条件下 (手术切口长约2 cm)暴露胃。在胃体前壁近胃窦处黏膜下注入0.01 m L冰醋酸,制成胃溃疡模型。各实验组分别于溃疡手术后1、2、4、6、10、14和23 d取大鼠胃壁组织 (每个时间点6只),正常组与1 d同时取材。各组动物饲养条件相同,取材前禁食12 h,不限饮水。动物用戊巴比妥钠麻醉后,迅速开胸,主动脉插管,剪开右心耳,首先灌注生理盐水100 m L,继之灌注4%多聚甲醛磷酸缓冲液 (p H 7.4)250 m L,维持20 min全身固定。取材时沿胃大弯剪开大鼠胃壁,冰生理盐水冲洗,溃疡组剪取溃疡边缘组织,正常组剪取近胃窦处胃组织,置于Bouin’s液中,石蜡包埋,连续切片,厚4μm,裱贴于涂有APES的载片,行HE染色和免疫组化染色。
1.2.2 免疫组织化学染色 石蜡切片常规脱蜡至水,枸橼酸缓冲液 (p H 6.0)95℃,15 min微波热修复,3%甲醇-H2O2去除内源性过氧化物酶,滴加一抗 (三种抗体工作液浓度均为1∶100),4℃孵育过夜,其余步骤按中杉金桥SP9001试剂盒步骤操作。常规DAB显色,苏木精复染细胞核,以PBS代替一抗作为对照。
1.3 图像分析与统计学方法
采用Motic6.0软件进行图像半定量分析,每张切片随机选取5个视野 (×200),测定各实验组大鼠胃黏膜阳性目标积分光密度。所有数据均以 (±s)表示,应用SPSS 17.0统计软件进行单因素方差分析和q检验。
2 结 果
2.1 造模后胃黏膜组织形态学变化
胃溃疡术后1 d,大鼠胃体前壁即可见一个直径约4 mm的溃疡,苍白色,圆形或椭圆形,边界清楚,周围黏膜呈环堤样水肿隆起;术后2~4 d溃疡最为明显,溃疡底部凹陷加深 (封二图1),并可见穿孔或者被大网膜、胰腺、肝脏等组织黏连包裹;随后溃疡面积逐渐减小,至14 d左右溃疡直径缩小至1~2 mm,逐渐形成瘢痕组织;溃疡术后23 d部分已经接近愈合。HE染色切片在光镜下观察可见溃疡部位黏膜缺损,腺体减少消失,炎性细胞浸润 (封二图2),溃疡术后6 d腺体数量增多可呈扩张状,至修复后期黏膜结构逐渐完整。
2.2 胃黏膜EGF、EGFR、TGF-α表达变化
阳性反应物质均呈棕黄色。正常组大鼠胃黏膜三种蛋白均呈弱阳性表达 (封二图3),溃疡术后1 d,EGF阳性细胞与正常组相比略有增多 (P<0.05),EGFR阳性细胞增多较为明显 (P<0.05),TGF-α表达从溃疡术后2 d增强较为明显 (P<0.01)。之后 (4~10 d)三者表达均呈增强趋势,阳性细胞数量明显增多,表达明显增强。至溃疡术后10 d,EGF、TGF-α阳性细胞积分光密度值达到高峰 (封二图4,6),EGFR阳性细胞于术后6 d表达最强 (封二图5)。溃疡修复后期 (14,23 d)三者阳性细胞积分光密度值虽略有降低,但仍显著高于正常组 (P<0.01)。EGF、EGFR、TGF-α主要表达于胃底腺细胞,可见壁细胞阳性表达、也可见胞体呈锥体形、具有突起的内分泌细胞表达。三种蛋白均可见胞质表达,EGFR还可见胞膜表达,阳性信号以靠近黏膜肌层为强。各实验组EGF、EGFR、TGF-α积分光密度值见表1。
表1 大鼠胃黏膜EGF、EGFR、TGF-α阳性细胞积分光密度值变化 ±s)
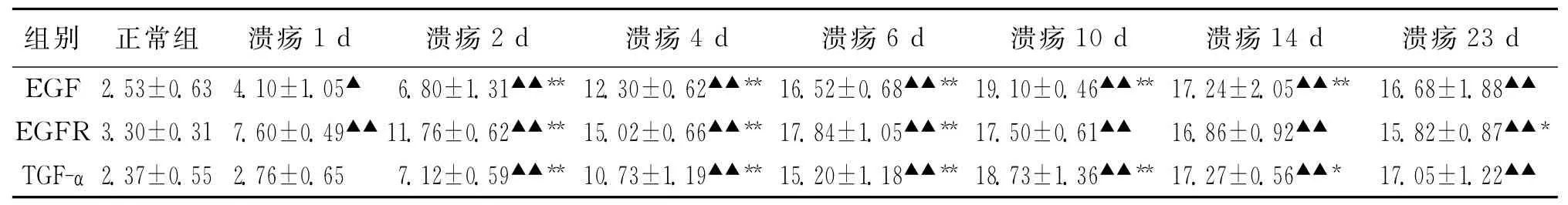
表1 大鼠胃黏膜EGF、EGFR、TGF-α阳性细胞积分光密度值变化 ±s)
注:与正常组比较▲P<0.05,▲▲P<0.01;与前一溃疡组相比*P<0.05,**P<0.01
23 d EGF 2.53±0.63 4.10±1.05▲ 6.80±1.31▲▲** 12.30±0.62▲▲** 16.52±0.68▲▲** 19.10±0.46▲▲** 17.24±2.05▲▲** 16.68±1.88组别 正常组 溃疡1 d 溃疡2 d 溃疡4 d 溃疡6 d 溃疡10 d 溃疡14 d 溃疡▲▲EGFR 3.30±0.31 7.60±0.49▲▲11.76±0.62▲▲** 15.02±0.66▲▲** 17.84±1.05▲▲** 17.50±0.61▲▲ 16.86±0.92▲▲ 15.82±0.87▲▲*TGF-α 2.37±0.55 2.76±0.65 7.12±0.59▲▲** 10.73±1.19▲▲** 15.20±1.18▲▲** 18.73±1.36▲▲** 17.27±0.56▲▲* 17.05±1.22▲▲
3 讨 论
研究发现,一旦溃疡形成,无论原因如何,其修复及愈合均经历相似的过程[4]。目前在溃疡愈合方面提出了QOUH (quality of ulcer healing,溃疡愈合质量)的概念,包括缺失黏膜的修复以及黏膜下组织结构与功能的重建[5]。EGF、TGF-α是一组能直接影响QOUH的表皮生长因子相关蛋白家族成员,它们通过作用于共同的受体EGFR,发挥他们黏膜修复与重建的功能。因此我们采用能较好模拟人类胃溃疡的大鼠乙酸胃溃疡模型,对胃黏膜EGF、EGFR、TGF-α进行定位及定量检测,研究它们在胃黏膜修复过程中的变化及意义,有助于明确胃溃疡黏膜愈合和修复机制,为胃溃疡临床治疗及药物筛选提供实验依据。
EGF在唾液腺和十二指肠Brunner腺中分泌较为丰富,是由53个氨基酸组成的单链蛋白质,是一种重要的促进溃疡愈合的调节因子[6]。TGF-α是另一参与胃黏膜修复的主要调节肽,成熟肽由50个氨基酸组成,产生于整个胃肠道,是维持黏膜完整性的重要介质,被称为 “黏膜完整肽”。TGF-α与EGF有35%的序列同源性,因此二者具有相似的生物活性,并且结合同一个受体[7-8]。EGF与TGF-α都具有促进胃黏膜上皮细胞增殖、成纤维细胞的生长以及胶原产生的作用,同时它们还可抑制胃酸分泌,增加胃黏膜血流量,参与黏膜上皮的更新以及损伤后的修复[8]。此外二者具有耐热和不被蛋白酶消化的特性[8],有利于它们长时间作用于胃肠道黏膜,因此这两种生长因子在溃疡修复中扮演着重要的角色。EGFR是一种单链跨膜糖蛋白,并具有酪氨酸激酶活性,有EGF及TGF-α两种配体,它们通过自分泌或旁分泌与EGFR结合并使之激活,诱导其磷酸化,提供持续分裂信号到细胞内,引起细胞增殖分化[9]。
从我们的实验结果分析,正常大鼠胃黏膜EGF、EGFR、TGF-α弱阳性表达是维持胃黏膜完整性的结构基础。在大鼠胃溃疡形成和愈合早期,三者表达明显增多,之后呈现上升趋势,在愈合后期表达水平略有下降,但显著高于正常组 (P<0.01),三种指标的表达趋势与胃溃疡愈合是一致的,说明在胃溃疡愈合过程中,胃黏膜自身可产生EGF、EGFR、TGF-α参与黏膜修复过程。但从表达时相上三者略有不同,EGFR在术后1 d增多就较为明显 (P<0.01),术后6 d表达最强;EGF在溃疡术后1 d与正常组相比略有增多 (P<0.05),于10 d积分光密度值达到峰值;TGF-α是于溃疡术后2 d增多较为明显(P<0.01),在溃疡10 d时阳性细胞最多,表达最强。国外研究中发现,EGFR作为初始反应蛋白最早出现在黏膜损伤后,而EGF作为中间反应蛋白出现时间滞后于EGFR[10],这与我们的实验结果是一致的。TGF-α虽然在国内外文献中并未提及它的表达时相,但由于TGF-α与EGF在结构上具有同源性,因此它与EGF的时相变化基本是一致的,这也体现在我们的实验结果中。
从我们的定位检测结果看,三种指标在表达部位上具有相同的特点。三种阳性细胞主要分布于近黏膜肌层,此部位与胃腺增殖关系密切,此部位细胞增殖核抗原 (proliferating cell nuclear antigen,PCNA)表达阳性[11],推断此表达特点可能与它们具有促进胃黏膜细胞分裂、分化等作用有关,这是黏膜损伤后修复的必要条件。同时三种阳性物质除见于内分泌细胞中,也可见表达于壁细胞中,此定位特点应与其抑制盐酸分泌的特性有关。阳性细胞胞膜以及胞质表达的EGFR能和EGF、TGF-α发生特异性结合,是它们发挥抑酸、促细胞增殖等作用的蛋白基础。
在大鼠胃溃疡自愈时期胃黏膜能特异性表达内源性EGF、EGFR、TGF-α,它们共同参与了溃疡愈合过程,通过自分泌或旁分泌的方式相互影响,相互作用,共同促进胃黏膜的修复。目前研发的抗溃疡药正是通过生长因子的介导而提高QOUL,减少溃疡复发。因此,对生长因子的研究有助于寻找抗消化性溃疡药物开发的新靶点。目前,国内已研制成功重组h EGF并用于溃疡病的治疗,而研究发现TGF-α与EGFR的结合能力更强[8],这给TGF-α应用于临床提供了更好的前景。同时促进EGFR的表达更是发挥治疗作用的关键环节。
[1] 成虹,胡伏莲,袁申元,等.北京地区消化性溃疡流行病学分析 [J].世界华人消化杂志,2007,15(33):3518-3523.
[2] Nie SN,Qian XM,Wu XH,et al.Role of TFF in healing of stress-induced gastric lesions [J].World J Gastroenterol,2003,9 (8):1772-1776.
[3] 张慧芹,房涛,程彦龙,等.大鼠实验性胃溃疡自愈期间胃黏膜5-HT和NPY的变化 [J].河北北方学院学报:医学版,2010,27 (4):19-22.
[4] 樊留博,马利中,李瀛,等.针刺对乙酸诱发大鼠胃溃疡愈合质量的影响 [J].中国中医急症,2006,15(11):1259-1260.
[5] Qi Z,Jie L,Haixia C,et al.Effect of rebamipide on quality of peptic ulcer healing in rat [J].Dig Dis Sci,2009,54(9):1876-1883.
[6] Elliott SN,Wallace JL,Mc Knight W,et al.Bacterial colonization and healing of gastric ulcers:the effects of epidermal growth factor [J].Am J Physiol Gastrointest Liver Physiol,2000,278 (1):105-112.
[7] Turner JR,Liu L,Fligiel SE,et al.Aging alters gastric mucosal responses to epidermal growth factor and transforming growth factor-alpha [J].Am J Physiol Gastrointest Liver Physiol,2000,278 (5):G805-G810.
[8] Alison MR,Chinery R,Poulsom R,et al.Experimental ulceration leads to sequential expression of spasmolytic polypeptide,intestinal trefoil factor,epidermal growth factor and transforming growth factor-alpha m RNAs in rat stomach[J].J Pathol,1995,175 (4):405-414.
[9] 林久茂,周建衡,钟晓勇,等.前列宁胶囊对BPH大鼠EGF、EGFR表达的影响 [J].福建中医药,2010,41(6):45-47.
[10] Syam AF,Sadikin M,Wanandi SI,et al.Molecular mechanism on healing process of peptic ulcer [J].Acta Med Indones,2009,41 (2):95-98.
[11] Yamaguchi H,Goldenring JR,Kaminishi M,et al.Association of spasmolytic polypeptide-expressing metaplasia with carcinogen administration and oxyntic atrophy in rats [J].Lab Invest,2002,82 (8):1045-1052.

